В крайних банках ниже плотность электролита. Как поднимать плотность электролита в аккумуляторе в домашних условиях
Вам понадобится
- Ареометр, «груша»-клизма, мерный стакан, электролит, аккумуляторная кислота, дистиллированная вода, раствор пищевой соды, дрель, паяльник.
Инструкция
Первое, с чего следует начать, это замерить плотность электролита в каждой в отдельности. Плотность должна быть в пределе от 1,25 до 1,29 – меньший показатель для южных районов с теплой , больший – для северных районов с холодным , а разброс показаний по банкам не должен быть 0,01. Если замер плотности показал, что ее значение находится в пределе 1,18-1,20, то вполне можно обойтись доливом электролита с плотностью 1,27. Сначала доведите плотность до нужной в одной банке. Откачайте электролит с помощью «груши», откачивайте по возможности большее количество, замерьте объем, долейте свежий электролит в половине объема от выкаченного. Покачайте из стороны в сторону и замерьте плотность.
Если плотность упала ниже предела 1,18, то электролит здесь не поможет, нужна аккумуляторная кислота. Ее плотность значительно выше, ведь электролит готовится из нее путем смешивания с дистиллированной водой. Работы проводите в том же порядке, как и при добавлении электролита, но в данном случае процедуру, возможно, придется провести повторно, если после первого этапа разбавления плотность не достигнет нужного показателя.
Еще один способ подразумевает полную замену электролита в аккумуляторе. Для этого нужно, откачать максимальный объем электролита с помощью «груши», герметично закрыть вентиляционные отверстия пробок банок аккумулятора, положить батарею на бок и в дне аккумулятора, сверлом на 3-3,5, просверлить отверстия, поочередно в каждой банке, не забывая при этом сливать электролит.
Обратите внимание
При работе с электролитом и, особенно с кислотой будьте осторожны, работайте в резиновых перчатках и очках.
При разведении электролита самостоятельно помните: добавлять нужно кислоту в воду, а не наоборот, это обусловлено разной плотностью кислоты и воды.
Аккумулятор нельзя переворачивать к верху дном, это может привести к осыпанию активной массы пластин и последующему короткому замыканию.
При полной замене электролита не надейтесь на долгую службу аккумулятора, готовьтесь к покупке нового.
Плотность аккумулятора нужно замерять при 20 градусах Цельсия.
Заранее подготовьте емкости под сливаемый электролит и для разведения свежего.
При зарядке аккумулятора плотность электролита повышается.
При запайке высверленных отверстий, проверьте устойчивость пластмассы на реакцию с электролитом.
Плотность электролита снижается при разрядке аккумулятора, куда он заливается. Чтобы поднять его плотность, попытайтесь зарядить аккумулятор до кипения в банках. Если после этого плотность электролита не поднялась до нужного показателя, освободите в нем место и долейте серную кислоту.
Вам понадобится
- ареометр, серная кислота или концентрированный электролит, зарядное устройство.
Инструкция
Поднятие плотности электролита без доливания кислотыПервым признаком падения плотности электролита является разрядка . Для того чтобы определить плотность, используйте ареометр. Для этого с его помощью оттяните некоторое количество электролита и по всплывающим поплавкам определите его плотность. Она должна составлять 1,27 г/см3, она может быть чуть выше. Если плотность электролита меньше нормы, подсоедините аккумулятор к зарядному устройству и заряжайте его до тех пор, пока в банках не закипит.
Поднятие плотности электролита доливанием кислотыВ том случае, если первый метод не , электролита остается менее 1,27 г/см3, долейте кислоту. Для этого ареометром оттяните некоторое количество электролита и залейте серную кислоту. Учтите, что ее плотность составляет 1,83 г/см3, и это очень едкое вещество. В автомагазинах продается концентрат электролита плотностью 1,4 г/см3 — он более безопасен, поэтому лучше используйте его. Доливайте концентрат, пока плотность не увеличится до нужного значения. После этого поставьте аккумулятор на зарядку с небольшим током (не более 2 А) на полчаса. За это время электролит полностью перемешается. Снова проверьте плотность во всех банках.
Особую осторожность соблюдайте при работе с серной кислотой. Не допускайте ее попадания на кожу или одежду. Если это произошло, смойте электролит большим количеством воды и обработайте это место раствором соды, которая нейтрализует кислоту. При оттягивании раствора ни в коем случае не переворачивайте аккумулятор, потому что шлам от пластин может закоротить батарею, и она испортится.
Уменьшение плотности электролита происходит в основном при полной разрядке аккумулятора. При этом увеличивается внутреннее сопротивление аккумулятора и уменьшается его емкость, что приводит к сложностям при попытке запустить двигатель из-за снижения мощности стартера. Рассмотрим, как можно повысить плотность электролита.
Вам понадобится
Инструкция
Откройте пробки в верхней части и с помощью специального прибора, ареометра, измерьте плотность . Для этого в стеклянную трубку, которой поплавок, наберите электролит и по делению на поплавке определите его плотность. Если плотность меньше, чем 1.12, то ее уже вряд ли получится.
Если плотность меньше, чем 1.12, то ее уже вряд ли получится.
Полностью зарядите аккумулятор до того, пока не закипит электролит в банках. При этом значение плотности должно подняться до 1.26-1.28. Желательно осуществить несколько полных циклов зарядки-разрядки, для этого зарядите аккумулятор при помощи малых токов, после чего разрядите до 10.8 вольт, подключив на несколько часов сопротивление в 50 Ом или лампочку на 20-30 Ватт.
После этого перемножьте ток на время, в течение которого разряжался аккумулятор — таким образом, вы рассчитаете значение реальной емкости. Повторите весь цикл еще раз. После этих манипуляций емкость и плотность должны увеличиться. Снова измерьте плотность ареометром.
Если после всех причисленных действий плотность электролита составляет менее 1.26, то откорректируйте ее с помощью добавления электролита плотностью 1.40. Для этого грушей удалите часть электролита из аккумулятора, а вместо нее добавьте новый электролит с высокой плотностью, пока плотность результирующего состава не достигнет требуемого значения.
После этого опять зарядите аккумулятор малым током, не более 2-х Ампер в течение получаса для того, чтобы дать перемешаться электролиту. Опять проверьте плотность и если она меньше нормы, снова добавьте электролит.
Говоря о необходимости повысить плотность аккумулятора, мы, конечно же, имеем в виду плотность электролита в аккумуляторных батареях. Повернул ключ два-три раза, и все – стартер не крутит. Особенно если зажигание не отрегулировано.
Вам понадобится
- — ареометр,
- — электролит,
- — зарядное устройство
Инструкция
В подобных случаях, прежде всего, проверьте, достаточно ли заряжен ваш .
Если он долго стоял на хранении, снятый с автомобиля, вполне возможно АКБ потеряла свой . Это явление саморазрядом. Потеря заряда АКБ может быть и на эксплуатируемом автомобиле при определенном режиме движения.
С понижением заряда падает и электролита. Эти два показателя тесно взаимосвязаны. Поставьте аккумулятор на зарядку, и вы повысите плотность.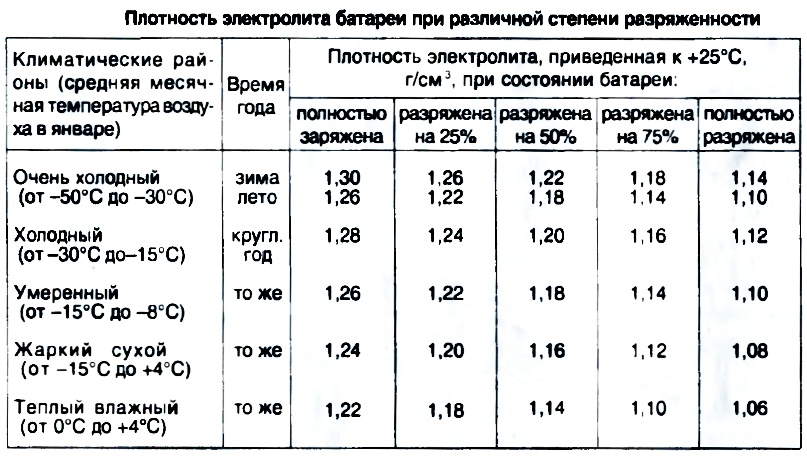
Учтите, чем меньшим током вы будете заряжать вашу батарею, тем полнее и глубже вы зарядите аккумулятор. Для «55-го», например, оптимальным будет ток 2.75 А.
Проверьте плотность заряженной батареи. Если по истечении 10-12 часов ее плотность не достигла показаний 1.27 – 1.28 г/куб. см, вы не наблюдали кипения и выделения газов из банок АКБ – переходите к повышению плотности доливом свежего электролита.
Для этого с соблюдением всех мер предосторожности резиновой грушей или тем же ареометром поочередно из каждой банки забирайте электролит и сливайте в какую-нибудь стеклянную посудину. Чтобы не переводить впустую свежий электролит, заберите и вылейте, в зависимости от потери плотности, из банки сразу несколько всасываний.
Наверняка большинство автомобилистов сталкивались с ситуацией, когда оставленная на некоторое время машина перестает заводиться. При этом стартер может вообще не подавать каких-либо признаков жизни. Основной причиной этому, скорее всего, является аккумуляторная батарея, что за несколько дней полностью разрядился.
Ведь эта жидкость, по сути является катализатором электрохимического процесса, без нее аккумулятор это набор и пластика, который работать не будет. Как мы с вами знаем, состоит от из (примерно 65%) и (35%), у этой жидкости есть определенная плотность, которая может понижаться и повышаться, в зависимости от заряженности.
Почему снижается плотность электролита?
Чаще всего с целью поддерживать на требуемом уровне количество жидкости внутри автомобильной батареи владельцы машины доливают туда дистиллированную воду. При этом редко проверяется плотность получившегося раствора. Вместе с тем, когда количество дистиллированной воды будет достаточно большим, при подзарядке вместе с этой жидкостью будет выкипать и электролит, что и приводит к снижению его плотности.
Рано или поздно этот показатель упадет ниже критического уровня, и завести транспортное средство уже не получиться.
В таком случае возникает необходимость повысить этот параметр раствора в аккумуляторе, что вернет его работоспособность.
Подготовка к восстановлению батареи
Перед тем, как своими силами повышать уровень плотности аккумуляторной батареи, к этому процессу следует тщательно подготовиться. В первую очередь:
- Замеряется этот основной показатель автомобильной батареи при температуре около 22 градусов. Сделать этом можно при помощи специального прибора – ареометра. При этом работать можно только в перчатках и защитных очках, чтобы избежать возможных ожогов.
- При приготовлении нового электролита кислота добавляется в воду. Если же сделать наоборот, жидкость , что может привести к кислотным ожогам.
- Переворачивать аккумулятор при работе с ним категорически запрещено, поскольку при этом могут посыпаться его пластины, что приведет к выходу прибора из строя.
- Наперед следует подготовить емкости, в которые будет сливаться старая жидкость и готовиться новая.

- Потребуются точные расчеты необходимого объема кислоты, поскольку в процессе зарядки плотность жидкости в АКБ возрастет.
Повышение плотности электролита
В АКБ есть несколько банок, электролитический раствор есть в каждой из них. Проверять и при необходимости повышать уровень плотности необходимо в каждой банке.
Нормальный уровень данного показателя зависит от нескольких факторов, в первую очередь – от температуры воздуха. Нормальным считается значение 1,25-1,29г/см3. Разница таких показателей между банками не должна превышать 0,1.
Если измерение этого показателя является ниже нормы, нужно повысить плотность электролита в аккумуляторе.
При помощи спринцовки из каждой банки выкачивается раствор. При этом набирать нужно как можно большее количество жидкости, измеряя ее объем, чтобы затем долить точно такое же количество свежего электролита.
Залив столько же свежего раствора, сколько было извлечено старого, АКБ хорошенько прокачивается с целью размешивания нового и старого электролита.
После этого снова проводиться измерение этого показателя: если он все еще находиться ниже нормы, все действия повторяются до достижения нужного значения плотности. По завершению при необходимости в банки автомобильной батареи добавляется дистиллированная вода.
Плотность ниже минимального значения
Бывают такие случаи, когда уровень этого показателя опускается ниже отметки 1,18. В таком случае вышеописанный способ ничем не поможет.
Чтобы восстановить работоспособность аккумуляторной батареи, вместо электролитического раствора нужно использовать кислоту, плотность которой выше, чему у электролита. При этом все действия проводятся точно так же, как и в предыдущем случае до того времени, пока показатель не придет в норму.
Можно ли повысить минимальную плотность?
Если уровень плотности раствора, что проводит ток в АКБ автомобиля упал намного ниже 1,18 г/см3, поднимать ее нет никакого смысла. В таком случае необходимо слить весь раствор, заменив его свежим.
Сначала с банок откачивается с помощью спринцовки как можно больше электролита. Далее батарея помещается в большую емкость, аккуратно переворачивается на бок, в дне каждой банки просверливается небольшое отверстие. Перевернув прибор, с него сливаются все излишки оставшейся жидкости.
Сделав это, в АКБ заливается свежий раствор, после чего прибор будет готов к использованию. Недостатком подобного способа является то, что в конечном результате снижается срок службы устройства, но некоторое время оно все еще поработает до покупки нового.
Как повысить при помощи зарядного устройстваТут также все просто, нам нужно заряжать аккумулятор на слабом токе, длительный промежуток времени. Суть такова, при достижении полного заряда, электролит начнет кипеть, пойдут пузырьки, это распадается и испаряется вода. Для повышения плотности нам нужно чтобы лишняя вода испарилась, а кислота осталась. Конечно, будет понижаться уровень в батареи – но вместо ушедшего уровня, добавляем нужный плотности электролит. Процесс этот долгий и муторный (выкипание — добавление), но примерно через пару суток можно догнать уже до плотности в 1,27 – 1,29 г/см3, что уже нормально.
Процесс этот долгий и муторный (выкипание — добавление), но примерно через пару суток можно догнать уже до плотности в 1,27 – 1,29 г/см3, что уже нормально.
Многим автовладельцам наверняка приходилось сталкиваться с проблемой некорректной работы аккумулятора. Бывает так, что машина простояла всего сутки, а завести ее после этого становится невозможно. При этом даже длительная зарядка батареи не помогает. Подобные симптомы свидетельствуют о снижении О том, какая должна быть плотность в аккумуляторе, почему она падает, и как ее поднять до нужного уровня, мы и поговорим в этой статье.
Электролит и его плотность
Электролит — это раствор, состоящий из серной кислоты и дистиллированной воды. Эти компоненты содержатся в примерно равных частях: вода — 1 часть, серная кислота — 1,25 части. Показатель 1,25 — это и есть плотность аккумулятора АКБ напрямую зависят от этого показателя — чем он выше,
тем ниже у нее температура замерзания, а сама она находится в удовлетворительном рабочем состоянии. Зная, какая должна быть плотность в аккумуляторе, можно судить о реальном состоянии своего устройства.
Зная, какая должна быть плотность в аккумуляторе, можно судить о реальном состоянии своего устройства.
Замер плотности АКБ
Перед тем как проверить плотность аккумулятора, следует обзавестись специальным прибором под названием ареометр. Он представляет собой устройство, состоящее из нескольких резиновых и стеклянных элементов.
Т.к. электролит является опасным химическим соединением, перед замером его плотности необходимо позаботиться о мерах предосторожности, а именно работы проводить в резиновых перчатках, избегая попадания жидкости на кожу и одежду. Категорически запрещается курить!
Откройте горловину банки, вставьте в нее наконечник устройства и с помощью груши наберите немного электролита так, чтобы поплавок ареометра свободно плавал в корпусе, не задевая дно, боковые стенки и верх. Подождите, пока жидкость в приборе успокоится, и, держа его на уровне глаз, визуально считайте показания. Данную процедуру проведите со всеми банками. Если разница плотности будет превышать 0,01 г на куб. см, то обязательно долейте дистиллированную воду либо поставьте АКБ на выравнивающую зарядку. При снижении плотности до показателя 1,24 г на куб. см или ниже аккумулятор следует подзарядить.
см, то обязательно долейте дистиллированную воду либо поставьте АКБ на выравнивающую зарядку. При снижении плотности до показателя 1,24 г на куб. см или ниже аккумулятор следует подзарядить.
Важно знать не только, как проверить плотность аккумулятора с помощью ареометра,
но и правила внесения поправок к показанию прибора в конкретных температурных условиях. Оптимальная температура электролита для измерения его плотности составляет +15 — +25˚С, но если приходится выполнять эту процедуру при более высокой или низкой температуре, то показания необходимо корректировать.
Температура электролита (˚С) | Поправка к показаниям ареометра |
Не следует выяснять, какая плотность в аккумуляторе, после того как туда недавно
была долита вода, или после неоднократных попыток запуска стартера. После выполнения всех процедур тщательно промойте ареометр водой.
После выполнения всех процедур тщательно промойте ареометр водой.
Как поднять плотность в аккумуляторе?
Самым простым способом поддержания необходимого уровня электролита в АКБ является долив Однако большинство автовладельцев забывают или не знают о том, что периодически необходимо замерять плотность аккумулятора, т.к. вода со временем выкипает, а вместе с ней и электролит, что влечет снижение плотности, иногда до критической отметки. Когда аккумулятор совсем
отказывается работать, то тут же возникает животрепещущий вопрос: «Как поднять плотность в аккумуляторе?»
Используя нижеизложенную инструкцию, вы сможете самостоятельно продлить жизнь АКБ. Однако помните, что эта процедура требует особого внимания и аккуратности.
Меры предосторожности
Соблюдайте максимальную осторожность при работе с электролитом: все действия выполняйте в защитных очках и резиновых перчатках.
. При самостоятельном разведении электролита обязательно следует добавлять кислоту в воду, но не наоборот! Эти жидкости имеют разную плотность, и результатом ошибки могут стать серьезные ожоги.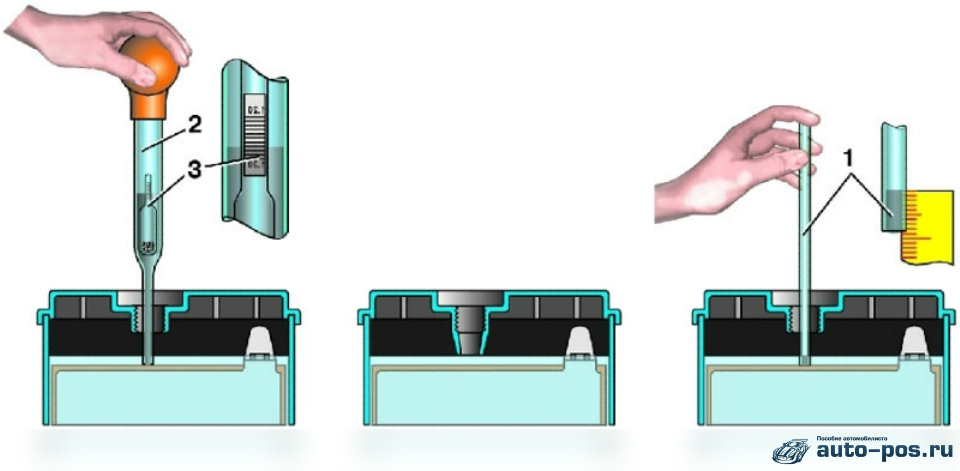
. Запрещено переворачивать АКБ вверх дном, т.к. вследствие этого активная поверхность пластин может осыпаться и вызвать короткое замыкание.
. Заранее подготовьте емкости для слива старого электролита и приготовления новой смеси.
. Предварительно проверьте пластмассу, которую будете использовать для запайки отверстий, на стойкость к электролиту.
. Помните, что заряженный аккумулятор будет иметь большую плотность.
Подготовительный этап
Для того чтобы поднять плотность электролита аккумуляторе, потребуются:
. ареометр;
. мерная емкость;
. клизма-груша;
. паяльник;
. дрель;
. электролит;
. аккумуляторная кислота;
. дистиллированная вода.
Как поднять плотность электролита в аккумуляторе: подробная инструкция
Производим замеры плотности электролита в каждой банке. Помня, какая должна быть
плотность в аккумуляторе, сопоставляем свои реальные показатели. Итак, если плотность составляет 1,25-1,28, а разброс значений в каждой банке не превышает 0,01, то аккумулятор вполне работоспособен, и каких-либо процедур ему не требуется. Если же показатели варьируются на уровне 1,18-1,20, то единственным вариантом будет долив электролита с плотностью 1,27.
Из одной банки откачайте с помощью клизмы-груши максимальное количество старого электролита и замеряйте его объем.
. Долейте свежий раствор в количестве, составляющем половину от откачанного.
. Активно, но аккуратно покачайте аккумулятор, чтобы перемешались жидкости.
. Замеряйте плотность. Если значение не такое, какая должна быть плотность в аккумуляторе, долейте еще ½ электролита от оставшегося количества. Операцию следует повторять, пока не получите требуемые показатели.
. Остаток долейте дистиллированной водой.
Что делать при критическом уровне плотности
Если показатель плотности ниже 1,18, то данную проблему решить доливом электролита не получится. В этом случае потребуется аккумуляторная кислота, имеющая существенно большую плотность. Данный процесс производится аналогично схеме добавления электролита. Если с одного раза не удалось достичь нужных результатов, повторяйте процедуру необходимое количество раз.
Если в аккумуляторе плотность даже ниже 1,18, то необходимо прибегнуть к процедуре полной замены электролита. Для этого сразу надо откачать с помощью груши максимальное количество раствора. Затем на аккумуляторных банках герметично закройте вентиляционные отверстия пробок. Поставьте АКБ набок и поочередно просверлите 3-3,5-миллиметровые отверстия в дне каждой из банок. Перед тем как проделывать очередное отверстие, из предыдущего сливайте остатки электролита.
Далее необходимо тщательно промыть дистиллированной водой. После этого запаяйте высверленные отверстия кислотостойкой пластмассой (к примеру, для этого можно использовать пробки с ненужного аккумулятора).
Проделав все подготовительные процедуры, можете приступать к заливке свежего электролита. В этом случае рекомендуется использовать раствор, приготовленный самостоятельно, плотность которого будет несколько выше, чем предусмотрена для вашего климатического пояса. При этом следует учесть, что даже полная замена электролита в старом аккумуляторе не сможет обеспечить ему такой же срок службы, как у новой АКБ.
Совет: если вы хотите, чтобы аккумулятор служил вам как можно дольше, не забывайте его вовремя заряжать и проверяйте периодически его плотность.
Аккумуляторная батарея – один из основных элементов автомобиля, отвечающих за пуск двигателя. Значение аккумулятора сложно переоценить, ведь без него невозможно завести мотор, а, значит, машина своим ходом передвигаться не сможет. Именно поэтому АКБ требует к себе особого внимания, исключающего возникновение неприятных ситуаций в виде невозможности совершить запланированную поездку. При этом стоит отметить, что для поддержания работоспособности это важного источника питания не требуется предпринимать каких-то сверхусилий, а достаточно выполнять лишь небольшой комплекс профилактических мер.
Свинцовая аккумуляторная батарея представляет собой гальванический элемент, внутри которого химическая энергия в результате протекающих реакций преобразуется в электрическую. Этот процесс невозможен без электролита – раствора кислоты, обеспечивающего движение заряженных частиц между погруженными в него электродами. Как правило, электролит представляет собой водный раствор серной кислоты определенной плотности. Именно такой параметр как плотность электролита оказывает значительное влияние на работоспособность аккумулятора, поэтому периодически его нужно контролировать.
Измерение плотности электролита в аккумуляторе
Измерить плотность залитого в свинцовый аккумулятор электролита не так уж сложно, однако есть определенные нюансы, связанные с особенностями устройства и принципом работы АКБ. Перечислим некоторые важные моменты, которые надо учесть:
- Осуществить процедуру измерения плотности получится только в случае с так называемым обслуживаемым аккумулятором, который предоставляет доступ к банкам (секциям) с электролитом посредством закрытых крышками заливных отверстий. Как раз через эти отверстия (обычно их число равно шести, как и количество секций) и осуществляется забор состава для замера плотности.
- В процессе своей работы автомобильная аккумуляторная батарея постоянно заряжается и разряжается. Разряд происходит при прокручивании стартера, а заряд – при уже заведенном двигателе от генератора. В зависимости от степени заряженности меняется и плотность электролита. Значения могут колебаться в пределах 0.15-0.16 г/см 3 . Важно отметить, что автомобильный генератор не способен полностью зарядить аккумуляторную батарею. При штатной работе на машине потенциал АКБ используется только на 80-90%. Полный заряд может обеспечить только внешнее зарядное устройство, к которому обязательно придется прибегнуть перед осуществлением замера плотности электролита.
- Плотность электролита зависит от его температуры. Обычно замер производится при температуре +25 °С, в противном случае делаются поправки.
Допустим, все вышеперечисленные условия приняты во внимание, и есть возможность приступить непосредственно к замеру плотности. Для этого понадобится специальный прибор – денсиметр, который состоит из ареометра, резиновой груши и стеклянной трубки с наконечником. Прибор вводится в банку аккумулятора через заливное отверстие, а затем осуществляется засасывание электролита с помощью резиновой груши. Оно происходит до тех пор, пока ареометр не всплывет. Показания считываются после того, как прекратятся колебания ареометра и появится возможность определения точного значения. Отсчет показаний производится по шкале, при этом взгляд должен находиться на уровне поверхности жидкости.
Полученное значение должно входить в диапазон 1.25-1.27 г/см 3 , если автомобиль эксплуатируется в средней полосе. В холодной климатической зоне (средняя месячная температура января ниже -15 °С) показатель должен находиться в интервале 1.27-1.29 г/см 3 . Проверять плотность электролита на соответствие этим числам нужно в каждой из шести банок аккумулятора. Показания не должны отличаться более чем на 0.01 г/см 3 , иначе потребуется их корректировка.
Как мы уже говорили, плотность электролита изменяется в зависимости от температуры. Это значит, что зимой и летом жидкость в одном и том же полностью исправном аккумуляторе будет иметь разную плотность. О том, насколько будут разниться показания, дает представление приведенная ниже таблица.
Зависимость температуры замерзания электролита от его плотности демонстрирует еще одна таблица. На основе этих данных можно установить оптимальную плотность электролита для конкретных климатических условий. Нижняя граница подобранного интервала должна гарантировать, что электролит не замерзнет даже при самых сильных холодах и обеспечит требуемое для прокручивания стартера усилие. В то же время чрезмерно завышать плотность тоже нельзя, так как на положительных электродах аккумулятора начинают ускоряться коррозионные процессы, приводящие к сульфатации пластин.
| Температура замерзания, °С | Плотность электролита при 25 °С, г/см 3 | Температура замерзания, °С | |
|---|---|---|---|
| 1.09 | -7 | 1.22 | -40 |
| 1.10 | -8 | 1.23 | -42 |
| 1.11 | -9 | 1.24 | -50 |
| 1.12 | -10 | 1.25 | -54 |
| 1.13 | -12 | 1.26 | -58 |
| 1.14 | -14 | 1.27 | -68 |
| 1.15 | -16 | 1.28 | -74 |
| 1.16 | -18 | 1.29 | -68 |
| 1.17 | -20 | 1.30 | -66 |
| 1.18 | -22 | 1.31 | -64 |
| 1.19 | -25 | 1.32 | -57 |
| 1.20 | -28 | 1.33 | -54 |
| 1.21 | -34 | 1.40 | -37 |
Причины изменения плотности электролита
Зафиксированные в результате измерения плотности значения не всегда соответствуют требуемым показателям. Расхождения могут касаться как отдельных банок аккумулятора, так и всех вместе. Если плотность завышена, то нужно обратить в первую очередь внимание на уровень электролита. Низкий уровень в большинстве случае является последствием электролиза, приводящего к разложению входящей в состав электролита воды на водород и кислород. Этот процесс выражается в появлении на поверхности жидкости пузырьков, что обычно происходит при зарядке аккумулятора. Частое «кипение» может приводить к снижению концентрации воды, и этот вопрос решается ее простым добавлением. Доливать в аккумулятор стоит только дистиллированную воду, контролируя при этом уровень электролита. Подробнее о корректировке плотности электролита поговорим ниже.
Если с повышенной плотностью все ясно, то с пониженной ситуация несколько сложнее. В теории, одной из причин понижения плотности, может быть то, что по какой-то причине в электролите уменьшилась доля серной кислоты. Однако на практике это маловероятно, так как сама по себе она обладает высокой температурой кипения, исключающей испарение даже при интенсивном нагреве, который происходит, например, при зарядке аккумуляторной батареи. Более распространенной причиной снижения плотности электролита является так называемая сульфатация пластин, заключающаяся в образовании на электродах сульфата свинца (PbSO4). На самом деле, это естественный процесс, происходящий при каждом разряде АКБ. Но дело в том, что при нормальном режиме работы после разряда аккумулятора обязательно происходит его заряд (на автомобиле аккумулятор постоянно подзаряжается от генератора). Заряд сопровождается обратным преобразованием сульфата свинца в свинец (на катоде) и двуокись свинца (на аноде) – в те активные вещества, которые составляют основу электродов и непосредственно участвуют в химическом процессе внутри аккумуляторной батареи. Если АКБ находится длительное время в разряженном состоянии, сульфат свинца кристаллизуется, безвозвратно теряя способность участвовать в химических реакциях. Это очень неприятный процесс, в результате которого аккумулятор уже не получится зарядить полностью даже при использовании внешнего зарядного устройства ввиду того, что не вся площадь пластин задействована в работе. Так как аккумулятор не заряжается до конца, то и плотность электролита не восстанавливается до своих исходных значений. По сути, здесь уже идет разговор об устранении нарушений в нормальном функционировании аккумулятора.
Частичную сульфатацию пластин можно устранить с помощью контрольно-тренировочных циклов, заключающихся в заряде и последующем разряде батареи до определенного уровня. Большинство современных зарядных устройств имеют такую функцию, поэтому имеет смысл ей воспользоваться, особенно если аккумулятор по какой-то причине долго находился в разряженном состоянии. Процедура десульфатации весьма длительная и может занять до нескольких дней. Если она не принесла результата, то крайней мерой является увеличение плотности с помощью добавления корректирующего электролита (плотность около 1.40 г/см 3). Такой способ можно рассматривать только как временное решение проблемы, потому что причина как таковая не устраняется.
Как поднять плотность электролита
Понизить или повысить плотность электролита в аккумуляторе можно путем откачивания его определенного количества, и долива взамен дистиллированной воды или электролита с повышенной плотностью (корректирующего). Данная процедура требует больших временных затрат, так как цикл откачки-долива может повторяться несколько раз, пока не будет достигнуто требуемое значение. После каждой корректировки необходимо поставить аккумулятор на зарядку (минимум на 30 минут), а затем дать ему постоять (0.5-2 часа). Эти действия необходимы для лучшего перемешивания электролита и выравнивания плотности в банках.
В процессе поднятия (или понижения) плотности электролита не стоит забывать и о контроле его уровня. Он осуществляется стеклянной трубкой с двумя отверстиями по краям. Один край погружается в электролит до тех пор, пока не упрется в предохранительную сетку. Далее верхний конец закрывается пальцем, а сама трубка осторожно поднимается вместе со столбиком жидкости внутри. Высота этого столбика указывает на расстояние от верхней кромки пластин до поверхности залитого электролита. Оно должно составлять 10-15 мм. Если аккумулятор имеет индикатор (тубус) или прозрачный корпус с нанесенными метками минимума и максимума, то контролировать уровень значительно проще.
Не стоит забывать, что все операции с электролитом необходимо выполнять осторожно, используя защитные перчатки и очки.
Как проверить аккумулятор автомобиля | Прием аккумуляторов в Санкт-Петербурге по лучшим ценам
Процесс проверки аккумулятора:
1. Внешний осмотр аккумулятора
2. Проверка уровня электролита в аккумуляторе
3. Проверка плотности электролита в аккумуляторе
4. Измерение напряжения на аккумуляторе вольтметром или мультиметром
5. Проверка аккумулятора нагрузочной вилкой.
1. Внешний осмотр аккумулятора
В процессе эксплуатации на поверхности аккумулятора накапливается грязь, влага, потеки электролита (испарение при кипении). Все это приводит к возникновению токов саморазряда аккумулятора. И если вовремя не подзарядить батарею, в результате получается глубокий разряд аккумулятора.
Частые глубокие разряды аккумулятора прямая дорога к сульфатации пластин и уменьшению срока службы аккумулятора.
Чтобы убедиться в наличии саморазряда:
Подключить один щуп вольтметра на клемму аккумулятора, а другим провести по поверхности аккумулятора, при этом вольтметр покажет какое-то напряжение, соответствующее определенному току саморазряда батареи.
Чтобы устранить саморазряд аккумулятора:
Нужно почистить аккумулятор. Потеки электролита убираются раствором соды в воде (чайная ложка на стакан воды). Электролит-кислота, раствор соды – щелочь, в результате химической реакции возникает соль и вода. Затем промыть аккумулятор водой.
Клеммы зачистите мелкой наждачной бумагой и проверьте надежность их соединения с проводами.
Обратите внимания на корпус в целом. В случае плохого крепления аккумулятора, особенно в морозы, когда пластиковый корпус довольно хрупок, могут возникнуть трещины в корпусе.
2. Проверка уровня электролита в аккумуляторе.
Проверить уровень электролита возможно только в обслуживаемых аккумуляторных батареях.
Операция производится специальной стеклянной трубкой, при этом уровень электролита должен быть в пределах 10-12 мм над свинцовыми пластинами аккумуляторной батареи
Для того, что бы замерить уровень электролита необходимо трубку поместить в заливное отверстие аккумулятора до соприкосновения с сеткой сепаратора, верхний конец трубки зажать пальцем и вытащить трубку. Верхний уровень электролита в уровнемерной трубке будет соответствовать уровню электролита в аккумуляторе.
Заниженный уровень является следствием «выкипания» электролита, в этом случае уровень электролита доводится доливкой дистиллированной воды.
Доливка в аккумулятор электролита производится только в том случае, когда вы уверены, что понижение уровня произошло вследствие разливания электролита из батареи.
Перед тем как приступить к дальнейшей проверки аккумулятора необходимо оценить степень его заряженности и дальнейшую проверку аккумулятора производить после полной зарядки.
Определить степень заряженности можно двумя способами: либо измерить плотность электролита в аккумуляторе, либо измерить напряжение на аккумуляторе.
3.Проверка плотности электролита в аккумуляторе (для обслуживаемых аккумуляторов)
Прибор для проверки плотности электролита в аккумуляторе называется – ареометр.
Для замера плотности электролита в аккумуляторе необходимо ареометр поместить в заливное отверстие аккумулятора, с помощью груши произвести забор электролита в колбу, так, что бы поплавок свободно плавал и снять показание плотности по шкале ареометра в соответствие с верхним уровнем электролита.
Значение плотности при 100 % заряженном аккумуляторе будет зависеть от температурных условий эксплуатации АКБ.
Таблица 1. Плотности электролита при различных температурах.
*SOC = State of charge — уровень заряда аккумуляторной батареи
Уменьшение плотности на 0,01 г/см3 от номинального значения соответствует разряду аккумулятора на 5-6%.
Значения, приведенные в таблице, будут верными, если вы производили проверку плотности при температуре электролита 20-30 °С. Если температура отличается от этого диапазона, то следует к измеренному значению плотности прибавить (вычесть) поправку согласно таблице.
Температура электролита,С | Поправка, г/см3 |
от –40 до –26 от –25 до –11 от –10 до +4 от +5 до +19 от +20 до +30 от +31 до +45 | –0,04 –0,03 –0,02 –0,01 0,00 +0,01 |
Оптимальная плотность электролита в аккумуляторе в зависимости от времени года и района эксплуатации
Обычно в автомобильных аккумуляторах, которые вы можете купить в магазине, плотность электролита соответствует 1,27 г/см3 . Допустим, при проверке плотности электролита в аккумуляторе ареометр показал значение 1,22 г/см3 (то есть плотность упала на 0,05 г/см3), то это значит, что АКБ разрядилась на 30 % от номинального значения.
В этом случае батарею необходимо зарядить. После этого, если АКБ исправна, то значение плотности электролита восстановится до номинального значения. Самое главное не допускайте разряда батареи больше чем на 50%.
Температура замерзания электролита в зависимости от плотности
Низкая плотность электролита в зимнее время ведет к его замерзанию, стремительной потери емкости аккумулятора, а иногда даже к физическим деформациям и появлению трещин.
4. Измерение напряжения на аккумуляторе вольтметром или мультиметром
Для измерения напряжение с помощью мультиметра, включите его в режим измерения постоянного напряжения, при этом диапазон установите выше максимального значения напряжения на заряженном аккумуляторе. Например, для популярного недорогого мультиметра серии DT-830 (M-830)
это 20 вольт. Далее подключите черный (COM) щуп мультиметра на минус аккумулятора, красный (плюсовой) на плюс и снимите показания с дисплея мультиметра.
Напряжение полностью заряженного аккумулятора должно быть не менее 12,6 вольта.
Если напряжение батареи менее 12 вольт — степень ее заряда упала больше чем на 50 %, аккумулятор необходимо срочно зарядить!
Нельзя допускать глубоких разрядов аккумулятора, это ведет, к сульфатации пластин аккумулятора.
Напряжение на аккумуляторной батареи величиной меньше 11,6 в означает, что батарея разряжена на 100 %.
Но нельзя жестко привязываться к конкретному значению напряжения, так как оно связано с плотностью электролита в аккумуляторе.
Автомобильный аккумулятор состоит из шести банок, соединенных последовательно. Напряжение одной банки можно вычислить по формуле:
Uб= 0,84 +ρ
где, ρ – плотность электролита;
Тогда напряжение на аккумуляторе будет равно:
Uакб = 6*(0.84 +ρ)
При плотности АКБ равной 1,27 г/см3 напряжение на аккумуляторе будет:
Uакб = 6*(0,84 +1,27) = 12,66 вольт
Соответственно при разной начальной плотности электролита в аккумуляторе будет и разной напряжение на нем.
5.Проверка аккумулятора нагрузочной вилкой.
Когда при измерении напряжения определяется, что аккумуляторная батарея полностью заряжена, а «крутит двигатель» плохо или вообще не «крутит» — можно предположить, что у такого аккумулятора упала емкость в результате долгой, или неправильной эксплуатации и разряжается он настолько быстро, что «умирает» за одну секунду.
Чтобы проверить работу аккумулятора под нагрузкой используется нагрузочная вилка. Схема нагрузочной вилки приведена на рисунке.
То есть нагрузочная вилка представляет собой вольтметр с возможностью подключения параллельно с его выводами нагрузки. Для стартерных батарей сопротивление нагрузки выбирается в диапазоне 1-1,4 от емкости аккумулятора. Это считается максимальным разрядным током для аккумулятора. Не путать со стартерным током.
Сначала проводится измерение напряжения аккумулятора без нагрузки и определение степени его заряженности с помощью таблицы.
Таблица. Зависимость степени заряженности АКБ от напряжения на холостом ходу. (АКБ находится в покое не менее 24 часов).
| Показания вольтметра. | >12,7 | 12,5 | 12,3 | 12,1 | < 11.9 |
| Процент заряженности % | 100 | 75 | 50 | 25 | 0 |
Вторым этапом является измерение напряжение на аккумуляторе при подключенной нагрузки и определение степени заряженности согласно таблице. Снятие показание под нагрузкой производится в конце пятой секунды с момента подключения нагрузки.
Таблица. Зависимость степени заряженности АКБ от напряжения в конце 5 секунды тестирования нагрузочной вилкой.
| Показания вольтметра. | >10,2 | 9,6 | 9 | 8,4 | < 7.8 |
| Процент заряженности % | 100 | 75 | 50 | 25 | 0 |
При 100% заряженном аккумуляторе напряжение, измеряемое под нагрузкой не должно быть меньше 10,2 вольта. В противном случае считается что аккумулятор не полностью заряжен и его необходимо зарядить.
Если же случилась такая ситуация, что без нагрузки аккумулятор показывает напряжение 100% заряженного аккумулятора, а при включении нагрузки напряжение сильно «просаживается» и сильно отличается от значений указанных в таблице, значит — в таком аккумуляторе неисправность (сульфатация, короткозамкнутые пластины и т. д.).
Необходимо, если это возможно устранять неисправность или приобретать новый аккумулятор.
О чем расскажет ареометр
10.05.2018Описание ареометра
Ареометр состоит из стеклянной (пластиковой) трубки, внутрь которой помещен герметичный стеклянный поплавок. Поплавок имеет шкалу по уровню погружения в жидкость которой можно снимать показания. Нижняя часть поплавка заполнена металлическими шариками, количество шариков позволяет довольно точно откалибровать прибор при его производстве.Нижний конец трубки ареометра снабжен гибким носиком для удобства использования. В верхней части трубки установлена пластичная помпа «груша». Общий вид ареометра соответствует большой пипетке.
Измерение плотности электролита
Для того чтобы измерить плотность электролита в аккумуляторе, необходимо для начала получить доступ к его содержимому, а именно к электролиту внутри. Большинство АКБ имеют отвинчивающиеся пробки, по одной для каждой банки аккумулятора. Возможно эти пробки скрываются под защитной пластиковой пластиной, в таком случае ее необходимо снять.Есть также необслуживаемые АКБ, пробки в которых запаяны на заводе изготовителе. В таких аккумуляторах не получиться измерить емкость электролита, не повредив аккумулятор. Так что перед покупкой ареометра первое что необходимо сделать, это убедиться в том, что аккумулятор обслуживаемый и имеет возможность демонтажа пробок электролита.
После того, как все пробки сняты можно переходить к измерению плотности. Следует отметить, что для наиболее точного измерения необходимо чтобы до момента измерения аккумулятор находился в состоянии «покоя» при комнатной температуре, то есть его не разряжали и не заряжали в течении 12 часов.
Вооружившись ареометром поочередно производим измерения в банках. Так же как пипеткой набирают лекарства, набираем раствор электролита из банки в ареометр до тех пор, пока внутренний поплавок ареометра не окажется на плаву. Отметка на поплавке, на границе с жидкостью и воздухом будет являться измеренным значением плотности электролита в конкретной банке.
Полученное значение можно сравнить с таблицей:
Для еще более точной диагностики рекомендуется производить совместные измерения напряжения на клеммах АКБ при помощи мультиметра или вольтметра.
В случае если плотность слишком большая, необходимо добавить дистиллированную воду. Если же плотность низкая, нужно добавить кислоту.
Ареометр, это довольно простой и поэтому дешевый инструмент который можно найти в арсенале практически у любого автолюбителя.
Ареометр АР-02 НПП Орион сделан из стекла, для большей долговечности и химической стойкости при контакте с кислотой.
Ультратонкий, высокоэффективный, искусственный интерфейс твердотельный электролит / металлический Li
Характеристика граната SSE
Li 7 La 2,75 Ca 0,25 Zr 1,75 Nb 0,25 O 12 (LLCZN) был выбран в качестве SSE в этой работе из-за его низкой температуры спекания, стабилизированной кубической фазы граната и высокой ионной проводимости ( 45 ). LLCZN был синтезирован с использованием модифицированного золь-гель метода с последующим термическим спеканием (см. Подробности в разделе «Материалы и методы»).Плотность спеченных гранул (92% от теоретического значения) измеряли методом Архимеда в этаноле. На рис. 2А показана структура полированной поверхности спеченного граната (светлая область) и алюминиевого покрытия (темная область). После полировки на поверхности спеченных гранул остались отдельные поры. На поперечном сечении гранатового керамического диска видны зерна граната микрометрового размера, спеченные вместе с образованием твердого электролита с покрытием из слоя алюминия толщиной 20 нм (рис. S1). Алюминиевое покрытие соответствовало полированной поверхности граната методом осаждения из паровой фазы (рис.S2 и S3). Вставка на рис. 2А представляет собой цифровое изображение керамического диска из граната, покрытого алюминием, с серым покрытием из алюминия на керамике из желтого граната. Рентгеновскую дифракцию (XRD) использовали для анализа фазы спеченных таблеток LLCZN на фиг. 2B. Пики хорошо совпадают с кубическим гранатом Li 5 La 3 Nb 2 O 12 (PDF 80-0457). Li 5 La 3 M 2 O 5 (M = Nb, Ta) является первым структурным примером быстрого литий-ионного проводящего граната и является стандартной структурой, используемой для изучения LLZO типа граната. материалы ( 26 , 46 — 48 ).Электрохимическая импедансная спектроскопия (EIS) была использована для измерения литий-ионной проводимости спеченного LLCZN. Кривые импеданса, измеренные от комнатной температуры до 50 ° C, были построены в форме Найквиста, как показано на фиг. 2C. Все графики Найквиста состоят из полукруга на средней частоте и почти вертикального низкочастотного хвоста. Реальная ось пересечения на высокой частоте может быть отнесена к объемному сопротивлению LLCZN, тогда как пониженная дуга связана с откликом границ зерен. Полное сопротивление как объемного, так и межзеренного вкладов рассчитывается с использованием низкочастотного интервала.Низкочастотный хвост соответствует емкостному поведению золотых электродов, которое блокирует диффузию литий-ионных ионов. Поскольку литий-ионная проводимость в LLCZN активируется термически, общее сопротивление гранул уменьшается с повышением температуры. Логарифмическая проводимость нанесена на график зависимости от температуры, а энергия активации литий-ионной проводимости (0,37 эВ) рассчитана с использованием уравнения Аррениуса (рис. 2D).Рис. 2 Характеристика ГСП ОООЗН.
( A ) Изображение морфологии поверхности керамики LLCZN с алюминиевым покрытием, полученное с помощью сканирующей электронной микроскопии (SEM).На вставке — цифровое изображение керамического диска LLCZN с алюминиевым покрытием. Желтый керамический диск покрыт алюминием и имеет серый цвет. ( B ) Рентгенограмма синтезированного LLCZN. ( C ) EIS-профили LLCZN при различных температурах. ( D ) График Аррениуса проводимости LLCZN.
Li смачиваемость SSE
Капля расплавленного лития была нанесена на поверхности граната и граната, покрытого алюминием, для наблюдения смачиваемости материала.Как показано на фиг. 3A, для чистого граната расплавленный Li мгновенно образовывал шар на верхней части гранатового диска, что демонстрирует плохое смачивание. В случае граната с алюминиевым покрытием расплавленный литий быстро растекся и покрыл поверхность искусственного граната. Обратите внимание, что тупой угол смачивания указывает на плохой контакт Li с гранатом без покрытия из-за более высокой поверхностной энергии Li, чем у граната; острый угол демонстрирует хорошую смачиваемость между Li и Al покрытием на поверхности граната.Рис. 3 Характеристики смачивания и морфологии поверхности раздела Li | гранат SSE и Li | Гранат с алюминиевым покрытием SSE.
( A ) Смачиваемость расплавленного лития SSE граната и SSE граната с алюминиевым покрытием. На вставке схематически показаны углы смачивания жидкой капли лития, смачивающей поверхность SSE граната как без покрытия, так и с алюминиевым покрытием. Улучшенная смачиваемость Li демонстрируется после покрытия алюминием поверхности граната. ( B и C ) СЭМ изображения Li | гранат SSE, демонстрирующий плохую смачиваемость литием граната без покрытия. (От D до F ) СЭМ изображения Li | Al-гранат SSE-Al демонстрирует превосходную смачиваемость литием гранатом с алюминиевым покрытием.( G ) Фазовая диаграмма Li-Al. ( H ) Элементное отображение Li | Al – гранатовый SSE в поперечном сечении. Сигнал Al регистрировался в объемном Li. ( I и J ) Элементная карта самой верхней части металлического Li, чтобы показать процесс диффузии Al.
Морфология границы раздела была охарактеризована с помощью SEM, как показано на рис. 3 (от B до F), на котором сравнивается поведение смачивания литием SSE граната с / без покрытия Al. Из-за плохого смачивания чистым гранатом только небольшая площадь контакта Li может быть использована для характеристики морфологии границы раздела Li | гранатовый образец SSE.Как показано на рис. 3 (B и C), верхний металлический Li и нижний гранат разделял большой зазор. Можно наблюдать только несколько пятен контакта, что показывает, что правильное смачивание литием имеет решающее значение для уменьшения межфазного сопротивления лития и граната ( 49 ). Элементарное отображение Ли | Образец SSE граната показывает распределение La и Al на поперечном сечении (рис. S4). Al в образце граната был из-за загрязнения тигля Al 2 O 3 во время подготовки образца и спекания.Предыдущие результаты показывают, что мелкие зерна и множественные границы зерен на границе раздела граната могут значительно снизить межфазное сопротивление с Li ( 35 ). Эти мелкие зерна и множественные границы зерен напрямую связаны с шероховатостью поверхности раздела, что может увеличить вероятность контакта граната с металлическим Li и снизить межфазное сопротивление. Если интерфейсы станут более грубыми, то их общая площадь контакта будет увеличиваться, вызывая меньшее межфазное сопротивление; однако смачиваемость лития гранатом остается проблемой.Как видно на рис. 3 (с D по F), гранат с алюминиевым покрытием поддерживает превосходный контакт с литием из-за образования сплава Li-Al на границе раздела. Увеличенное изображение, полученное на сканирующем электронном микроскопе, демонстрирует тесный контакт между литием и гранатом из-за конформного алюминиевого покрытия и межфазного слоя Li-Al (рис. 3F). Кроме того, мы видим, что Li заполняет поры частиц граната и границы зерен, что значительно увеличивает площадь контакта Li-граната. Сигнал Al был обнаружен в массивном металлическом Li Li | Образец SSE граната с алюминиевым покрытием (рис.3H и рис. S5), что указывает на диффузию Al в расплавленный Li. При легировании металлическим Li путем нагревания этот ультратонкий слой Al будет немедленно заменен металлическим Li, а затем мигрировать к массивному аноду Li. Поскольку массовое соотношение Li / Al составляет около 100% (см. Диаграмму состояния Li-Al на рис. 3G), твердый раствор можно рассматривать как чистую фазу Li. Был проведен дополнительный эксперимент, чтобы показать процесс диффузии Al. Алюминиевые фольги двух разных толщин (5 и 30 мкм) помещали под металлическую литиевую фольгу толщиной 1 мм для совместного нагрева до 200 ° C.Мы заметили, что алюминиевая фольга полностью корродировала и растворилась в расплавленном Li. Изучая поперечное сечение металлического Li, можно обнаружить сигнал Al в самой верхней части металлического Li, показывающий различные концентрации Li (рис. 3, I и J). Это наблюдение может моделировать состояние диффузии алюминиевого покрытия в расплавленное состояние Li на поверхности граната. Предполагается, что ультратонкое алюминиевое покрытие (20 нм) может быстро диффундировать в расплавленный Li. Чтобы определить фазу сплава Li-Al, мы использовали XRD для обнаружения литиированного алюминиевого покрытия на керамическом диске из граната.Первоначальное покрытие из алюминия потемнело при контакте с расплавленным литием. XRD идентифицировал пики Li-Al и Li 3 Al 2 в конформном слое покрытия (рис. S6), однако фаза Li 9 Al 4 может в основном образовываться на границе раздела на основе Li-Al. фазовая диаграмма. В будущем мы проведем дополнительную работу, чтобы понять состав сплава, образующегося на границе раздела.Электрохимическая оценка межфазного сопротивления
Межфазное сопротивление оценивали с помощью EIS для Li | гранат SSE | Li симметричные ячейки.Симметричные ячейки были приготовлены в соответствии со схемой, показанной на фиг. 4A. SSE был зажат между двумя свежими металлическими фольгами Li и затем покрыт пластинами из нержавеющей стали, чтобы заблокировать диффузию Li. Ячейки нагревали на горячей плите при 200 ° C в перчаточном боксе, заполненном аргоном, для плавления Li. Цифровое изображение на фиг. 4A показывает симметричную структуру ячейки, а процесс подготовки показан на фиг. S7. Пластины из нержавеющей стали были обрезаны по размеру в соответствии с размером Li и аккуратно прикреплены к поверхности Li вручную.Пластины из нержавеющей стали предотвращают окисление Li на внешней поверхности во время нагрева. Отметим, что к системе гранат и Li не применялось высокое внешнее давление. Две симметричные ячейки Li | гранат SSE | Ли и Ли | Аль-гранат SSE-Al | Li, были приготовлены и испытаны непосредственно в перчаточном ящике, заполненном аргоном. Две ячейки показали значительные различия в общем сопротивлении, которое зависит как от общего сопротивления граната, так и от сопротивления переносу заряда на границе раздела, как показано на графиках Найквиста (рис.4, Б и В). Ли | гранат SSE | Li-ячейка имела полное сопротивление ~ 2000 Ом · см 2 ; однако Ли | Аль-гранат SSE-Al | Li-ячейка показала сопротивление ~ 300 Ом · см 2 , что почти на порядок меньше, чем у SSE без покрытия. Небольшой частичный полукруг на высокой частоте можно отнести к общему сопротивлению материала граната. Большой полукруг на средней и низкой частоте соответствует сопротивлению переносу заряда, которое представляет собой комбинацию сопротивления SSE и границ раздела Li внутри симметричных ячеек.Уменьшение размера полукруга указывает на то, что межфазное сопротивление было значительно снижено при использовании покрытия из алюминия. Полное сопротивление граната составляло ~ 150 Ом · см 2 и оставалось неизменным в процессе плавления лития ( 49 ). Вычитая ASR граната, Li | гранат SSE | Сопротивление переноса заряда литиевых элементов составляло ~ 1900 Ом · см 2 при 20 ° C. Для Ли | Аль-гранат SSE-Al | Li, сопротивление переносу заряда уменьшено до ~ 150 Ом · см 2 .Обратите внимание, что межфазное сопротивление соответствует двум симметричным границам раздела. Межфазное сопротивление составляет ~ 950 и ~ 75 Ом · см 2 для Li | гранат SSE и Li | Al – гранат SSE – Al соответственно.Рис. 4 Электрохимическая стабильность границы раздела лития и граната.
( A ) Схема приготовления симметричной ячейки и цифровое изображение плавления металлического Li на УСЭ граната. ( B и C ) Сравнение графиков Найквиста Li | гранат SSE | Ли и Ли | Аль-гранат SSE-Al | Li на частоте от 1 МГц до 100 МГц при 20 ° C.( D ) Сюжеты Найквиста Ли | Аль-гранат SSE-Al | Li-симметричная ячейка при различных повышенных температурах. ( E ) Межфазное сопротивление Li | Аль-гранат SSE-Al | Симметричная ячейка Li в зависимости от температуры во время нагрева. ( F ) Профиль напряжения, отображающий поведение Li-покрытия / полос для Li | гранат SSE | Li симметричная ячейка при плотности тока 0,05 мА / см 2 . Плато напряжения продолжало увеличиваться с каждым циклом из-за высокой поляризации на неблагоприятном интерфейсе Li / SSE.Диапазон высокого напряжения отражает большое межфазное сопротивление чистого граната с металлическим литием. ( G ) Литиевое покрытие симметричного Li | Аль-гранат-Аль | Литиевый элемент при 60 ° C с плотностью тока 0,05 мА / см 2 в течение 24 часов. (От H до K ) Профили напряжения для Li | Аль-гранат SSE-Al | Li симметричная ячейка при плотностях тока 0,1 и 0,2 мА / см 2 . Плато напряжения оставалось плоским и стабильным во время циклирования, что доказывает, что сплав Li-Al создает стабильную границу раздела между SSE граната и металлическим Li.Низкий диапазон напряжения иллюстрирует небольшое межфазное сопротивление в ячейке.
Температурно-зависимое межфазное сопротивление было охарактеризовано с помощью EIS при температурах от 30 ° до 80 ° C. На рис. 4D полный импеданс Li | Аль-гранат SSE-Al | Ячейка Li уменьшалась при повышении температуры. Полукруг на средней и низкой частоте уменьшился, что указывает на то, что межфазное сопротивление сплава Li-Al отрицательно коррелировало с температурой. Межфазное сопротивление было рассчитано путем вычитания полного сопротивления материала граната, и данные были нанесены на график как функция температуры (рис.4E). Межфазное сопротивление уменьшается с температурой: ~ 75 Ом · см 2 при 20 ° C, ~ 27 Ом · см 2 при 60 ° C и ~ 20 Ом · см 2 при 80 ° C. Эти значения приближаются к типичному импедансу LIB в десятки Ом · см 2 . Стабильность интерфейса измерялась гальваностатической зарядкой и разрядкой при постоянном токе на пластину / полосу Li + и имитировала работу металлических литиевых батарей. Были изготовлены симметричные ячейки с двумя Li-электродами, которые собраны в 2032 монетных элемента (рис.S8). Углеродная губка с высокой проводимостью использовалась в качестве поглотителя силы и помещалась поверх симметричных ячеек, чтобы предотвратить растрескивание керамического диска из граната во время сборки батареи. Элемент был затянут с помощью зажима для батареи, а для герметизации монетных элементов использовалась эпоксидная смола (рис. S9). Все ячейки были собраны и протестированы в перчаточном боксе, заполненном аргоном, при 20 ° C. На рис. 4F показан временной профиль напряжения Li | гранат SSE | Li симметричная ячейка при плотности тока 0,05 мА / см 2 .Положительное и отрицательное напряжение обозначают удаление лития и покрытие литием соответственно. Ячейка показала высокое напряжение (~ 0,2 В) для снятия лития и низкое напряжение (~ 0,1 В) для гальванического покрытия из лития, что, вероятно, связано с разницей контактных площадей между гранатом и литием, вызывая поляризацию во время снятия изоляции и гальванического покрытия. В каждом цикле напряжение увеличивалось: напряжение снятия лития в первом цикле увеличивалось с 0,12 до 0,16 В. В последующих циклах напряжение непрерывно увеличивалось, указывая на нестабильную границу раздела, где межфазное сопротивление увеличивается со временем.Плохой контакт между Li и гранатом является вероятной причиной, вызывая накопление больших токов в точках / участках поверхности раздела, что приводит к значительной поляризации клеток. Следовательно, стабильная граница раздела важна для уменьшения поляризации и поддержания хороших характеристик циклирования с системами SSE. Напротив, алюминиевое покрытие эффективно стабилизирует межфазное сопротивление во время обратимого удаления Li и гальванического покрытия. Симметричный Al-гранат-Al | Li-ячейка была испытана при 60 ° C и плотности тока 0.05 мА / см 2 в течение 24 часов, что дало емкость 1,2 мАч (рис. 4G). Масса очищенного / покрытого Li, рассчитанная с использованием теоретической емкости металлического Li (3860 мАч / г), составила 0,31 мг, что составляет ~ 3,1% от общего количества использованного металлического Li ~ 10 мг. Мы можем видеть, что напряжение показывает плоское плато, что указывает на стабильный поток литий-ионных ионов через границу раздела между SSE граната и металлическим литием. Ли | Аль-гранат SSE-Al | Li-симметричная ячейка показала превосходную стабильность при плотности тока 0,1 мА / см 2 (рис.4, H и I). Симметричная ячейка периодически подвергалась циклам в течение 5 мин. Ячейка показывала постоянное напряжение ± 28 мВ для каждого цикла, а общее сопротивление, рассчитанное по закону Ома, составило ~ 280 Ом · см 2 , что хорошо согласуется с измерениями EIS. Объемное сопротивление гранатового твердого электролита составляло ~ 150 Ом · см 2 , что составляло 15 мВ в полное напряжение симметричной ячейки при этой плотности тока. Когда к симметричной ячейке применялась более высокая плотность тока 0,2 мА / см 2 , напряжение увеличивалось до 75 мВ с расчетным ASR ~ 375 Ом · см 2 .Плато напряжения по-прежнему остается ровным, что указывает на хорошую границу раздела между Li | Al – гранат SSE – Al (рис. 4, J и K). Длительное циклирование более 30 часов было испытано при плотности тока 0,1 мА / см 2 . Общее напряжение было менее 30 мВ без значительных колебаний напряжения. Когда плотность тока увеличилась вдвое, долговременные характеристики цикла оставались стабильными, и гистерезиса напряжения не наблюдалось. После цикла ячейка была открыта, и изображения поперечного сечения SEM показали, что никаких морфологических изменений на границе раздела из-за циклирования не произошло (рис.S10). Стабильные и постоянные напряжения снятия изоляции и покрытия подтверждают, что образование сплава является многообещающей стратегией для решения фундаментальной проблемы смачивания SSE граната металлическим Li. Конформное алюминиевое покрытие на керамическом диске граната резко изменило смачиваемость поверхности граната Li из-за образования литий-алюминиевый сплав. Реакция между Al и Li способствует усиленному проникновению расплавленного Li на шероховатую поверхность граната, в то время как образование сплава Li-Al заполняет зазор между твердым электролитом граната и металлическим Li, улучшая межфазный контакт и увеличивая перенос Li + ( 50 ).В этом случае образуется новая граница раздела между металлическим анодом Li и гранатом (рис. 5A). Мы применили расчеты из первых принципов для исследования стабильности границы раздела между SSE граната и промежуточным слоем сплава Li-Al, используя подход, определенный в предыдущей работе ( 28 ). Рассматривая интерфейс как псевдобинарную систему, состоящую из сплава Li-Al и SSE граната, мы определили наиболее термодинамически благоприятный интерфейс и рассчитали энергию взаимной реакции между двумя материалами ( 28 ).Расчет из первых принципов показывает, что сплавы Li-Al и SSE граната обладают стабильностью с энергиями взаимных реакций в диапазоне от -60 до -40 мэВ / атом (рис. 5B и таблица S1). Это небольшое количество межфазной реакции указывает на потенциальную кинетическую стабилизацию и отсутствие значительной межфазной деградации, как это наблюдается в других твердых электролитах ( 27 , 28 ). Кроме того, эти второстепенные реакции значительно улучшают смачиваемость на границе раздела. Следовательно, граница раздела между сплавом Li-Al и SSE граната может демонстрировать как хорошую смачиваемость, так и химическую стабильность, что улучшает межфазные контакты и снижает межфазное сопротивление.Рис. 5 Схема и расчет из первых принципов границы раздела сплава Li-Al между металлическим Li и SSE граната.
( A ) Реакция между Al и Li способствует усиленному проникновению расплавленного Li на шероховатую поверхность граната, в то время как образование сплава Li-Al заполняет зазор между твердым электролитом граната и металлическим Li для улучшения межфазного контакта и усилить транспорт Li + . ( B ) Расчетная энергия взаимной реакции Δ E D, взаимных границ раздела граната и сплава Li-Al.
Характеристики гибридных полных элементов твердое тело-жидкость
Чтобы продемонстрировать гибридную систему твердое тело-жидкость, мы оценили и подготовили три типа катодов (Li-содержащее катодное соединение, сера и кислород). Электрохимические характеристики гибридных твердотельных LIB с катодом из фосфата Li-железа (LiFePO 4 ) показаны на рис. 6 (от A до C). Подробные сведения о подготовке и сборке полной ячейки приведены в разделе «Материалы и методы». Все клетки были протестированы при 20 ° C. Профили импеданса свежего и циклического гибридных твердотельных LIB показаны на рис.6А. Частичный полукруг на высокой частоте подобен профилю импеданса симметричного Li | Аль-гранат SSE-Al | Ли ячейка. Большой полукруг на средней частоте объясняется сочетанием процессов переноса заряда и диффузии в системе жидкого электролита катода. Свежая ячейка имела полное сопротивление 1360 Ом · см 2 . После 100 циклов полное сопротивление уменьшилось до 1260 Ом · см 2 . Незначительное уменьшение частичного полукруга на высокой частоте демонстрирует снижение межфазного сопротивления SSE граната по отношению к металлическому Li после циклирования.Профили заряда и разряда гибридного твердотельного LIB-элемента показаны на рис. 6В. Активный катодный материал имеет загрузку ~ 1,0 мг / см 2 . При плотности тока 0,1 мА / см 2 элемент обеспечивал начальную зарядную и разрядную емкость 153 и 132 мАч / г с 86% кулоновской эффективностью (определяемой как отношение емкости заряда к емкости разряда). При дальнейшем циклировании емкости остаются относительно стабильными (> 120 мАч / г за 100 циклов). Как показано на рис.6C, кулоновский КПД составлял ~ 100%, и ячейка показывала хорошие быстродействие при применении более высоких плотностей тока (0,2 и 0,3 мА / см 2 ).Рис. 6 Демонстрация гибридных твердотельных аккумуляторов.
( A ) EIS гибридных твердо-жидких LIB. Катод LiFePO 4 используется с обычным электролитом на катодной стороне: 1 M LiPF 6 в этиленкарбонате (EC) / диэтилкарбонате (DEC) [1: 1 (об. / Об.)]. ( B ) Профили гальваностатического заряда / разряда гибридного твердожидкостного литий-ионного элемента.( C ) Циклическая производительность элемента более 100 циклов при различной плотности тока. ( D ) Электрохимические характеристики гибридного твердо-жидкого Li-S элемента. В качестве катода использовали элементарную серу, а в качестве электролита на катодной стороне использовали 1 М LiTFSI в диметоксиэтане (DME) / 1,3-диоксолане (DOL) [1: 1 (об. / Об.)]. ( E ) Электрохимические характеристики гибридной твердожидкостной батареи Li-O 2 . В качестве катода использовался высокопроводящий углерод, а на катодной стороне использовался 1 M LiTFSI в диметиловом эфире тетраэтиленгликоля (TEGDME).
Li-S и Li-O 2 были также продемонстрированы как гибридные твердо-жидкие электролитные системы. Обычные Li-S батареи, использующие жидкий электролит, страдают от эффекта переноса полисульфидов и побочных реакций с металлическим Li, которые вызывают значительное снижение емкости и низкую кулоновскую эффективность. Гибридная система SSE может избежать этих проблем. Плотный гранат SSE может физически блокировать растворенные полисульфиды от реакции с металлическим Li и локально ограничивать активные материалы серы / полисульфидов на стороне катода.Чтобы продемонстрировать эффект блокировки SSE граната в системе Li-S, мы использовали катод из элементарной серы для создания гибридной твердо-жидкой Li-S аккумуляторной батареи с полным аккумулятором. На серный катод наносили обычный жидкий электролит, 1 M LiTFSI в DME / DOL [1: 1 (об. / Об.)]. Содержание серы составляло ~ 1,0 мг / см 2 . Кривые гальваностатического разряда и заряда показаны на рис. 6D. Начальная разрядная и зарядная емкости составляли 1532 и 1388 мАч / г соответственно, что соответствует кулоновскому КПД 90,6%.Циклические характеристики продемонстрировали как высокую емкость, так и кулоновскую эффективность> 99%, что указывает на то, что SSE граната может эффективно блокировать эффект миграции / челночного перемещения полисульфидов для Li-S батарей (рис. S11). Обратите внимание, что эффект переключения в Li-S батареях на основе жидкого электролита демонстрирует более высокую зарядную емкость, чем разрядную емкость. В этой системе кулоновский КПД обычно определяется как отношение разрядной емкости к зарядной емкости. Снижение производительности ячейки возможно из-за осаждения растворенных серных и полисульфидных материалов в изолированные поры на поверхности SSE граната (рис.S12). У этих осажденных активных материалов отсутствует достаточный путь переноса электронов, и они стали «мертвыми активными материалами», которые больше нельзя использовать, что приводит к быстрому снижению емкости. Гранатовый SSE оставался стабильным, и фазовых изменений после циклического включения в батареях не наблюдалось (рис. S13). Подобно эффекту переключения в Li-S батареях, обычные батареи Li-O 2 страдают от диффузии кислорода через слой электролита. к металлическому Li, который образует изолирующий оксидный слой на поверхности анода и увеличивает межфазное сопротивление.Кроме того, для снижения перенапряжения заряда в жидком электролите часто используются окислительно-восстановительные медиаторы, которые могут напрямую вступать в реакцию с анодом из металлического Li и вызывать неблагоприятные побочные реакции. Путем введения этого гибридного твердо-жидкого электролита можно избежать этих проблем, поскольку металлический Li не будет окисляться газообразным кислородом или подвергаться коррозии под действием окислительно-восстановительных медиаторов. Здесь мы демонстрируем гибридную твердо-жидкостную ячейку Li-O 2 с углеродным катодом. На рисунке 6E показаны электрохимические характеристики элемента при плотности тока 15 мкА / см 2 с ограничением времени заряда / разряда 10 часов.Ячейка может работать в течение 10 циклов и показала стабильное плоское плато разряда при ~ 2,5 В. Недавно была разработана полностью твердотельная батарея с интерфейсной инженерией, в которой использовалась структура пористого гранатового электролита для улучшения переноса Li-иона на электроде. -электролитный интерфейс с улучшенными емкостями и циклическими характеристиками ( 51 ). Мы предполагаем, что гранатовая структура с проектированием интерфейсов может быть спроектирована во взаимосвязанные ионные и электронные сети для Li-S и Li-O 2 батарей для размещения растворенной серы / полисульфидов или активных катализаторов с большой площадью поверхности.Кроме того, пористая гранатовая структура может быть идеальным трехмерным ионопроводящим каркасом для удержания Li в ячейке во время повторяющихся циклов.Влияние фторированных растворителей на структуру сольватации электролита и границы раздела электрод / электролит для литий-металлических батарей
Значение
Литий (Li) -металлический аккумулятор (LMB) — очень многообещающий кандидат для батарей с высокой плотностью энергии следующего поколения. Однако его практическое применение затруднено из-за нестабильности металлического Li в современных карбонатных электролитах.Локализованные электролиты с высокой концентрацией (LHCE) проливают свет на практическое использование LMB, создавая стабильную и прочную межфазную поверхность твердого электролита на Li. Здесь мы исследуем различные типы фторированных сорастворителей в качестве разбавителей для LHCE, чтобы понять корреляцию между характеристиками батареи и структурой сольватации, а также химией межфазной границы электрод / электролит. Это ясно показывает, что разбавитель, окружающий кластеры высококонцентрированного сольватирующего сольватора растворителя, ускоряет / замедляет разложение анионов, регулирует свойства межфазных границ и, следовательно, влияет на характеристики батареи.Эти результаты могут служить ориентиром для дальнейшей разработки усовершенствованных электролитов для LMB.
Abstract
Электролит очень важен для работы высоковольтной литий-металлической батареи (LMB), которая является одним из наиболее привлекательных кандидатов для систем хранения энергии высокой плотности следующего поколения. Состав и структура электролита определяют физические свойства электролитов и их межфазный химический состав на поверхности электродов. Локализованные электролиты с высокой концентрацией (LHCE) превосходят современные карбонатные электролиты во многих аспектах в LMB из-за их уникальной сольватационной структуры.Типы фторированных сорастворителей, используемых в LHCE, исследуются здесь в поисках наиболее подходящего разбавителя для высококонцентрированных электролитов (HCE). Несольватирующие растворители (включая фторированные эфиры, фторированный борат и фторированный ортоформиат), добавленные в HCE, позволяют образовывать LHCE с сольватационной структурой с высокой концентрацией. Однако фторированный карбонат с низкой сольватирующей способностью координируется с ионами Li + и образует вторую сольватирующую оболочку или псевдо-LHCE, что снижает преимущества LHCE.Кроме того, очевидно, что разбавитель оказывает значительное влияние на межфазные границы электрод / электролит (EEI), помимо сохранения структур сольватации с высокой концентрацией. Молекулы разбавителя, окружающие кластеры с высокой концентрацией, могут ускорять или замедлять разложение анионов за счет совместного участия в разложении разбавителя в образовании EEI. Различные межфазные характеристики приводят к значительно разным характеристикам батарей. Это исследование подчеркивает важность разбавителей и их синергетических эффектов с проводящей солью и сольватирующим растворителем при разработке LHCE.Эти систематические сравнения и фундаментальные сведения о LHCE с использованием различных типов фторированных растворителей могут служить ориентиром для дальнейшей разработки усовершенствованных электролитов для высоковольтных LMB.
После десятилетий бездействия с момента появления литиевых (Li) -ионных батарей (LIB) в начале 1990-х, литий-металлические батареи (LMB) были возрождены в последние годы как одна из самых многообещающих электрохимических систем хранения энергии из-за их высокие плотности энергии (1⇓ – 3). Тем не менее, возрождение металлических литиевых анодов (LMA), используемых в LMB, по-прежнему сдерживается двумя критическими препятствиями: низкой кулоновской эффективностью (CE) и высоким ростом поверхностного Li при циклировании.В связи с этим электролит все чаще признается в качестве одного из наиболее важных компонентов для стабилизации LMA и регулирования осаждения и роста Li, поскольку он определяет природу межфазной границы твердого электролита (SEI) на LMA (4, 5). Современные (SOA) LiPF 6 / карбонатные электролиты, адаптированные к химическому составу LIB, продемонстрировали хорошую ионную проводимость, электрохимическую стабильность и благоприятные свойства SEI на графитовых анодах (6). Хотя общие цели проектирования идеального электролита остаются теми же, от LIB до LMB, металлический Li с электрохимическим потенциалом -3.040 В по сравнению со стандартным водородным электродом, очень реактивен по отношению к карбонатным электролитам SOA и приводит к серьезной коррозии LMA и истощению электролита. Это также приводит к неконтролируемому росту дендритов Li и увеличивает риски безопасности для практических приложений (5, 7). С этой целью необходимы электролиты помимо карбонатных электролитов SOA, чтобы обеспечить более длительный цикл и календарный срок службы и более высокую безопасность LMB. Хотя известно, что простые эфиры более стабильны с LMA, чем карбонатные растворители, их внутренняя нестабильность против окисления в обычных разбавленных электролитах долгое время препятствовала их применению выше 4.0 В по сравнению с Li / Li + . Однако недавно сообщалось о стабильности при длительном циклировании в элементах Li || LiNi 1/3 Mn 1/3 Co 1/3 O 2 (NMC111) с напряжением отсечки заряда 4,3 В, где эфир на основе высококонцентрированного электролита (ВКЭ) (8). ГХЭ бис (фторсульфонил) имида лития (LiFSI) в 1,2-диметоксиэтане (DME) при молярном соотношении LiFSI: DME = 1: 1,2 может значительно повысить стабильность LMB с Ni-богатым LiNi 0,8 Mn 0.1 Co 0,1 O 2 Катод (NMC811) при 4,4 и 4,5 В даже в практических условиях (9). В этом HCE отсутствие свободных молекул DME изменяет сольватные структуры Li + и приводит к SEI на основе соли на LMA и стабильной межфазной границе катодного электролита (CEI) на высоковольтном катоде. Эти стабильные слои SEI / CEI действуют как кинетические барьеры между электролитом и электродами и тем самым ограничивают непрерывные побочные реакции как на LMA, так и на высоковольтном катоде во время повторяющихся циклов (9).Группа Ямады также сообщила о суперконцентрированных электролитах LiFSI / диметилкарбонат (DMC) для высоковольтного (5 В) графита || LiNi 0,5 Mn 1,5 O 4 батареи с хорошей устойчивостью к циклам и высокой скоростью работы вместе с повышенной безопасностью (10 ).
Для дальнейшего развития HCE были разработаны локализованные электролиты с высокой концентрацией (LHCE) путем введения несольватирующих или слабосольватирующих растворителей (также называемых разбавителями) в HCE (9, 11–13). LHCE не только сохраняют благоприятные сольватационные структуры (высококонцентрированные координационные кластеры) в HCE, но также значительно снижают общую концентрацию соли в электролите, что полезно для снижения вязкости и стоимости электролита, а также для улучшения смачиваемости электролита на электродах и сепараторе. .Наша группа ранее исследовала эффекты ряда модельных растворителей электролитов (карбонат, сульфон, фосфат и эфир) для LHCE и выявила внутренние синергетические эффекты между солью и растворителем, когда они сосуществуют на поверхности электродов (14). В этой работе мы перейдем к другому важному компоненту LHCE — разбавителю. Требования к разбавителю были приведены в нашей предыдущей работе (11) и резюмированы в обзорной статье о HCEs, написанной Yamada et al. (15), которые включают низкую вязкость, достаточную электрохимическую стабильность, соответствующую диэлектрическую проницаемость и координационные свойства (11, 15).Несколько гидрофторэфиров (HFE), отвечающих указанным выше требованиям, были введены в качестве разбавителей в различные HCE на основе различных проводящих солей и сольватирующих растворителей, включая бис (2,2,2-трифторэтиловый) эфир (BTFE) (11, 13, 16 ⇓⇓ – 19), 1,1,2,2-тетрафторэтил-2,2,3,3-тетрафторпропиловый эфир (TTE) (9, 12), 1H, 1H, 5H-октафторпентил 1,1,2,2- тетрафторэтиловый эфир и 2,2,2-трифторэтил-1,1,2,2-тетрафторэтиловый эфир (20). Сформулированные LHCE успешно улучшают характеристики элементов батарей различного химического состава, чему в основном способствует плотно осажденный Li под благоприятным химическим составом SEI, полученным из солей.Чтобы выявить фундаментальный механизм преимуществ использования разбавителей в LHCE, здесь мы проводим систематические исследования разбавителей известных HFE (включая BTFE и TTE в качестве представителей) и не только, включая фторированный карбонат [бис (2,2,2-трифторэтил) ) карбонат (BTFEC)], фторированный борат [три (2,2,2-трифторэтил) борат (TFEB)] и фторированный ортоформиат [трис (2,2,2-трифторэтил) ортоформиат (TFEO)]. Молекулярные структуры приведены в приложении SI , рис. S1.Посмертный анализ и теоретическое моделирование выполняются для понимания основных механизмов различного поведения в LHCE на основе различных типов разбавителей. Очевидно, что разбавитель оказывает значительное влияние на границы раздела фаз электрод / электролит, помимо сохранения структур сольватации с высокой концентрацией. Высокая концентрация солевых анионов, присутствующих в первичной сольватной оболочке Li + , не является единственным ключевым моментом в LHCE. Молекулы разбавителя, окружающие кластеры с высокой концентрацией, могут ускорять или замедлять разложение анионов за счет совместного участия в разложении разбавителя в образовании SEI.Химия другой природы также обнаруживается в CEI, образованном в LHCE на основе различных разбавителей. Различные межфазные характеристики в конечном итоге приводят к значительно разным уровням производительности батареи. Это исследование подчеркивает важность разбавителей и их синергетических эффектов с проводящей солью и сольватирующим растворителем при разработке LHCE. Эти систематические сравнения и фундаментальное понимание LHCE, основанных на различных типах разбавителей, могут направить дальнейшую разработку усовершенствованных электролитов для высоковольтных LMB.
Результаты и обсуждение
В таблице 1 перечислены основные физические свойства пяти фторированных растворителей (обозначены D). Эти растворители плохо растворяют соль LiFSI, но хорошо смешиваются с HCE (LiFSI в DME при молярном соотношении 1: 1,2 или 1: 1,4), поэтому они работают как разбавители для HCE. Во всех этих разбавителях значения энергии наивысших занятых молекулярных орбиталей (ВЗМО) ниже, чем у растворителя ДМЭ (ВЗМО -7,19 эВ), потому что разбавители имеют сильные электроноакцепторные группы CF 3 или CF 2 , которые указывает на то, что они имеют более высокую теоретическую стойкость к окислению, чем растворитель ДМЭ.Наименьшие значения энергии незанятой молекулярной орбитали (НСМО) этих разбавителей ниже, чем у растворителя ДМЭ (-0,18 эВ), что указывает на то, что они могут быть восстановлены раньше, чем ДМЭ, и могут участвовать в образовании SEI на аноде. В таблице 1 также представлены ключевые физические свойства соответствующих LHCE (обозначенных E) на основе этих разбавителей (при молярном соотношении LiFSI: DME: разбавитель = 1: 1,2: 3 для всех разбавителей, кроме TFEB; когда разбавителем является TFEB, LiFSI: DME: TFEB составляет 1: 1,4: 3). LHCE имеют общую концентрацию соли от 1.65 и 1,06 М, в зависимости от разбавителя. Поскольку молярное соотношение LiFSI, DME и разбавителя фиксировано, разбавитель с более высокой молекулярной массой даст более низкую концентрацию соли в соответствующем LHCE. Эта общая концентрация соли определяет ионную проводимость электролита, в которой ионы Li + проводятся прыжками внутри кластеров соль-растворитель и диффузией кластера / носителя (сольватационной оболочки) в LHCE, а более высокая концентрация соли приводит к более высокая ионная проводимость LHCE.При комнатной температуре (25 ° C) ионная проводимость этих электролитов составляет от 4,88 до 1,61 мСм см -1 . Аналогичные плотности электролита (от 1,39 до 1,48 г / мл -1 ) и гораздо более низкие вязкости (от 2,86 до 4,92 сП при 25 ° C), чем у HCE (49,2 сП при 30 ° C) (21), получены во всех этих LHCEs.
Таблица 1.Физические свойства исследуемых разбавителей и соответствующих им LHCE
Моделирование молекулярной динамики Ab initio (AIMD) было выполнено для исследования влияния различных фторированных растворителей на сольватационные структуры (микроскопические структуры) HCE и пяти LHCE. .Молекулярные структуры компонентов электролита показаны в приложении SI , рис. S1, а снимки HCE и пяти структур LHCE из моделирования AIMD показаны на рис. 1 A — F . Ясно, что соль LiFSI равномерно распределена в растворителе ДМЭ в ГХЭ. Однако кластеры (агрегации) с высокой концентрацией соли можно увидеть на рис.1 B , C , E и F с BTFE, TTE, TFEB и TFEO в качестве разбавителей в LHCE соответственно, тогда как сильно изолированный LiFSI присутствует в LHCE с BTFEC в качестве разбавителя, как показано на рис.1 Д . Разбавители БТФЭ, ТТЕ, ТФЭБ и ТФЭО, очевидно, сохраняют благоприятные характеристики ГХЭ (LiFSI-1.2DME), в то время как БТФЭК в определенной степени повреждает структуру сольватации ГХЭ. Для упрощения структур сольватации электролита схемы HCE и LHCE показаны в приложении SI , рис. S2; Также на рис.1 G — K и показано на рис.1 L . Два острых пика при 2 Å во всех LHCE (рис. 1 G — K ) идентифицированы как Li-O в DME (ODME; S для растворителя на рис. 1 L ) и Li-O в FSI . — (OFSI; A для аниона на рис. 1 L ).
Рис. 1. Снимки моделированияAIMD для ( A ) HCE и LHCE с ( B ) BTFE, ( C ) TTE, ( D ) BTFEC, ( E ) TFEB и () F ) ТФЭО в качестве разбавителя.Подробное радиальное распределение LHCE с ( G ) BTFE, ( H ) TTE, ( I ) BTFEC, ( J ) TFEB и ( K ) TFEO в качестве разбавителя. D1-D5 определены в таблице 1. S — растворитель; А, анион. ( L ) Схематическое изображение радиального распределения LHCE, перечисленных в таблице 1. Зеленый контур на кругах в G — L означает координацию между конкретным элементом и ионом Li + , сплошная линия указывает относительно сильная координация, а пунктирная линия указывает на относительно слабую координацию.
Это указывает на то, что все ионы Li + окружены молекулами растворителя ДМЭ и анионами FSI — в первой координационной сфере (отмечены пунктирным кружком на рис. 1 L ). Это результат сильного притягивающего взаимодействия между Li + и DME / FSI — . Между тем, атомы O в молекулах разбавителей BTFE (D1), TTE (D2), TFEB (D4) и TFEO (D5) практически не координируются с Li + в этих LHCE (рис. 1 G , рис. H , J и K ).Это демонстрирует, что эти четыре разбавителя находятся за пределами локализованных пар или кластеров LiFSI / DME с высокой концентрацией, как показано на фиг. 1 L . BTFEC (D3), исключение, показывает два дополнительных пика при ∼3,25 и 3,75 Å (рис. 1 I ), которые связаны с Li-O в BTFEC, что позволяет предположить, что BTFEC также участвует в координации Li + , хотя он не находится в первой сольватной оболочке иона Li + . В этом электролите существует вторая сольватационная оболочка (на рис.1 L ). В результате использование BTFEC ослабляет сольватную структуру HCE, что снижает координационное число DME и FSI — в первой оболочке с 4 в других системах LHCE ( SI Приложение , рис. S3 A , B , D и E ) до 1,5 ( SI Приложение , рис. S3 C ). Следовательно, в этом LHCE на основе BTFEC все еще существуют свободные молекулы DME, которые не тесно координированы с Li + , что делает его псевдо-LHCE.С точки зрения сольватационной структуры, некоординирующие молекулы разбавителя, включая BTFE, TTE, TFEB и TFEO, являются хорошими кандидатами в разбавители для LHCE, в то время как разбавитель с низкой координацией BTFEC не является хорошим разбавителем.
Помимо физических свойств LHCE на основе различных разбавителей, влияние разбавителей на LMA и характеристики батареи является значительным. Поскольку LHCE имеют разные сольватационные структуры, как описано выше, минимум зоны проводимости (CBM) варьируется в разных LHCE.Как показано на графиках прогнозируемой плотности состояний (PDOS) ( SI Приложение , рис. S4 A — E ), CBM в LHCE на основе BTFEC находится на BTFEC, в то время как CBM в других LHCE находится на FSI — анион, подразумевая, что анионы FSI — преимущественно восстановлены во всех LHCE, кроме BTFEC-LHCE. Это преобладающее разложение FSI — приводит к образованию SEI на основе LiFSI и оказывает сильное влияние на осаждение Li. На рис. 2 показаны морфологии осажденного Li (1 мАч / см −2 Li, нанесенного на медную [Cu] -подложку при плотности тока 0 мкм, полученную с помощью сканирующей электронной микроскопии (SEM)).5 мА см −2 ) в исследуемых LHCEs, а также в электролите SOA (1 M LiPF 6 в EC-EMC [3: 7 по массе] + 2 мас.% Виниленкарбоната). В отличие от сильного образования дендритов Li в электролите SOA (рис. 2 A ), гораздо более крупные частицы Li обнаруживаются во всех LHCE с различными деталями (рис. 2 B — F ). В BTFEC-LHCE (рис. 2 D ) размер осажденного Li неоднороден, и некоторые мелкие частицы (близкие к морфологии дендритов) растут вместе с крупными частицами.В TFEB-LHCE (рис. 2 E ) видимые дефекты наблюдаются на крупных зернистых частицах. Желаемые морфологии Li видны в LHCE с BTFE, TTE или TFEO в качестве разбавителя; осажденный Li в этих электролитах большой и гладкий (рис. 2 B , C и F ). Морфология осаждения Li сильно влияет на КЭ Li. Как показано на рис. 3 A , SOA-электролит дает низкий средний CE 89,8% в результате образования дендритов и тяжелых побочных реакций с металлическим Li.В LHCE гораздо лучший CE объясняется большим размером Li, нанесенного на Cu. В частности, очень высокие значения CE 99,4, 99,5 и 99,5% достигаются в трех LHCE с разбавителями BTFE, TTE и TFEO соответственно.
Рис. 2. СЭМ-изображенияморфологий осажденного Li в электролите SOA ( A ) и LHCE с ( B ) BTFE, ( C ) TTE, ( D ) BTFEC, ( E ) TFEB и ( F ) TFEO в качестве разбавителя.
Рис. 3.Электрохимические свойства LHCEs на основе различных разбавителей по сравнению со свойствами SOA-электролита.( A ) Li CE, ( B ) Спектры EIS после 100 циклов в ячейках Li || NMC811, ( C ) кривые начального заряда / разряда элементов Li || NMC811 при C / 10 для образования, ( D ) кривые заряда / разряда элементов Li || NMC811 при C / 3 после двух циклов формирования и ( E ) долговременная стабильность при циклическом воздействии.
Когда литиевый анод был соединен с высоковольтным катодом NMC811 с высоким содержанием никеля в качестве Li || NMC811 батарей для получения батареи с высокой плотностью энергии, характеристики элемента показаны на рис.3 С — E . Достаточно высокая удельная емкость 217 мАч г -1 достигается в электролите SOA в первом цикле образования при C / 10 (рис. 3 C ), за которым следует LHCE-BTFE при 211 мАч г -1. и остальные LHCE при ∼200 мАч г -1 . Для первого цикла при C / 3 после циклов формирования такая же тенденция наблюдается с удельной емкостью 210 мАч г -1 для SOA, 206 мАч г -1 для LHCE-BTFE и ∼200 мАч г −1 для остальных LHCE.Небольшая разница перенапряжения ∼0,05 В наблюдается в элементах, использующих эти электролиты, в порядке SOA
Для дальнейшего выявления эффекта разбавителя в ячейках Li || NMC811, циклические LMA и катоды NMC811 были собраны для лучшего понимания межфазной химии, включая SEI на LMA и CEI на катоде NMC811. В недавних исследованиях различные HCE и LHCE использовались в LMB и продемонстрировали гораздо лучшую стабильность LMB, чем обычные электролиты, за счет создания SEI, производных от соли (21–23). Тем не менее роли разбавителя уделялось мало внимания.Здесь был проведен анализ рентгеновской фотоэлектронной спектроскопии (XPS) для характеристики составов SEI, образованных в LHCEs с различными разбавителями.
Рис. 4 A суммирует распределения элементов на разных глубинах в SEI, а на рис. 4 B — E показаны спектры C 1s, S 2p, N 1s и F 1s в качестве представителей для подробного анализа состава. На рис. 4 обозначены пять важных тенденций. 1) Во всех LHCE SEI имеют высокое содержание неорганических соединений, полученных из соли, на что указывает высокое содержание Li, O и / или F элементов.В LHCE с разбавителями TTE и TFEO атомное соотношение Li и O составляет более 80%. BTFE-LHCE содержит Li и O в сочетании примерно на 60% и F примерно на 20%, в то время как гораздо больше Li и F содержится в BTFEC-LHCE (70%) и TFEB-LHCE (40%) вместе с примерно 20% O. Рис. 4 C — E для S 2p, N 1s и F 1s демонстрируют разложение LiFSI; частичный LiFSI почти полностью восстанавливается в LHCEs с TTE и TFEO из-за более высокой интенсивности S 2– и S n 2– видов.2) Как показано атомным соотношением C и спектрами C 1s, молекулы растворителя / разбавителя все еще участвуют в образовании SEI, хотя SEI в основном происходят из LiFSI в этих LHCE. BTFEC-LHCE имеет наивысшее атомное отношение C (20%) среди пяти различных LHCE на основе разбавителя. Это предполагает наиболее сильное разложение растворителя / разбавителя в этом электролите, что согласуется с результатами PDOS, полученными при моделировании AIMD, как упоминалось в предыдущем разделе. Это может быть тесно связано с псевдо-LHCE природой BTFEC-LHCE.3) Дополнительный пик при 293 эВ (CF 3 ) в LHCE с BTFEC и TFEB также доказывает, что разбавители BTFEC и TFEB сильно взаимодействуют с LMA. Содержание B (5%) в TFEB-LHCE дополнительно подтверждает, что TFEB принимает участие в образовании SEI. 4) Переходный металл Ni обнаруживается на поверхности Li после циклирования в TFEB-LHCE, что указывает на то, что TFEB-LHCE также обладает высокой реакционной способностью с катодом, что приводит к растворению переходного металла и его миграции в LMA. Это будет дополнительно обсуждено в следующем разделе, посвященном анализу катода.5) Согласно распределению атомных соотношений на разных глубинах, показанному на рис. 4 A , LHCE с TTE и TFEO имеют наиболее равномерное распределение элементов по толщине SEI, что предполагает очень однородные SEI в этих двух электролитах. Мы можем сделать вывод, что разные степени реактивности между разбавителем и LMA существуют в LHCE с разными разбавителями, и гомогенные Li 2 O x SEI в LHCE с TTE и TFEO благоприятны для стабильности LHCE и приводят к высокому CE. (Инжир.3 A ) и длительное циклирование в ячейках Li || NMC811 (рис. 3 E ).
Рис. 4.( A ) Атомные отношения XPS различных элементов на разной глубине на циклированных анодах Li с использованием различных LHCE. Региональные XPS-спектры для выбранных элементов на циклических литиевых анодах: ( B ) C 1s, ( C ) S 2p, ( D ) N 1s и ( E ) F 1s.
Кроме того, выбор разбавителя также тесно связан с реакциями между электролитом и активным катодом.Чтобы выяснить межфазные реакции, XPS также использовался для характеристики CEI на катодах NMC811 после 100 циклов. Рис. 5 A показывает атомные отношения элементов, обнаруженных на катодах, включенных в цикл в различных LHCE, а их региональные спектры показаны на рис. 5 B — E . Три основных момента можно резюмировать следующим образом. 1) В четырех LHCE с BTFE, BTFEC, TTE и TFEO в качестве разбавителя LiF доминирует в CEI, о чем свидетельствуют высокие содержания Li и F, а также пик F1s при 685 эВ (рис.5 E ). 2) Рассмотрение спектров S 2p (рис. 5 C ) и N 1s (рис. 5 D ) с гораздо большей интенсивностью NSO x F y в LHCE с BTFE, TTE и TFEO, в этих LHCE происходит большее разложение LiFSI, что способствует образованию LiF в этих электролитах. С другой стороны, образование LiF в BTFEC-LHCE в основном происходит за счет разложения BTFEC, о чем свидетельствует ограниченное разложение LiFSI в этом электролите. 3) Тяжелое разложение TFEB происходит в TFEB-LHCE, о чем свидетельствует очень высокое содержание C (от 40 до 50%) и B (от 30 до 10%) от поверхности до дна CEI, как показано на рис.5 А .
Рис. 5.( A ) Атомные отношения XPS различных элементов на разной глубине на циклических катодах NMC811 с использованием различных LHCE. Региональные XPS-спектры для выбранных элементов на циклических катодах NMC811: ( B ) C 1s, ( C ) S 2p, ( D ) N 1s и ( E ) F 1s. ( F — J ) Изображения HAADF-STEM и ( K — O ) изображения ABF-STEM катодов NMC811 после 100 циклов в различных LHCE.
Циклические катоды также были охарактеризованы с помощью кольцевой сканирующей электронной микроскопии в светлом поле (ABF-STEM) и высокоугловой кольцевой темнопольной микроскопии (HAADF) -STEM для изучения катодных структур и морфологии КЭИ, образованных в различных LHCE. Как показано на рис. 5 F — O , в BTFE-LHCE слой CEI толщиной менее 2 нм покрывает NMC811 (рис. 5 F ), а на поверхности катодной частицы образовался катион — структура фазы смешения толщиной около 2 нм (рис.5 К ). Это фазовое превращение из исходной слоистой структуры (9, 21), вероятно, связано с коррозией электролита, и кислородные вакансии, оставленные межфазными реакциями, вызовут большее перемешивание Li + / Ni 2+ в промежуточном слое (24). Кроме того, кислородные вакансии преимущественно диффундируют вдоль плоскостей {104}, что впоследствии способствует росту фазы смешения катионов (рис. 5 K ) (24). В TTE-LHCE наблюдается несколько более толстый CEI (3 нм) (рис. 5 G ), но гораздо более тонкий слой смешения катионов толщиной 1 нм без объемной коррозии можно увидеть на рис.5 Л . В TFEO-LHCE на катоде NMC получается еще более толстый CEI в 5 нм, что успешно подавляет фазовый переход смешения катионов. Для этих LHCE толщина CEI и кристалличность LiF следуют порядку BTFE
Заключение
Различные типы фторированных растворителей, включая фторированные эфиры (BTFE и TTE), фторированный карбонат (BTFEC), фторированный борат (TFEB) и фторированный ортоформиат (TFEO), были исследованы в качестве разбавителей в LHCE для перезаряжаемых LMB. Работа.Значительные различия наблюдались в LHCE (на основе LiFSI-1.2DME HCE) с этими разбавителями. Среди них BTFEC координируется с Li + во второй сольватационной оболочке после первой сольватации с DME и FSI —, что частично повреждает высококонцентрированные координированные кластеры в HCE, образуя псевдо-LHCE; таким образом, в BTFEC-LHCE теряются благоприятные свойства HCE. LHCE с BTFE, TTE, TFEB и TFEO поддерживают кластеры солей с высокой концентрацией, в то время как общая концентрация LiFSI в этих электролитах снижается.Помимо решающей роли аниона FSI – в свойствах SEI и CEI в LHCE, молекулы разбавителя также вносят большой вклад в межфазную химию как на катоде, так и на аноде. TFEB значительно ускоряет выделение кислорода в материале NMC811 с высоким содержанием никеля и вызывает быстрый распад катода из-за его электронодефицитной природы. LHCE на основе BTFE, TTE и TFEO продемонстрировали ХЭ с высоким содержанием Li 99,4, 99,5 и 99,5% соответственно. Для этих трех LHCE характеристики высоковольтного элемента Li || NMC811 были определены химическим составом CEI в условиях тестирования.Сохранение емкости Li || NMC811 с протестированными LHCE следует в следующем порядке: TFEO-LHCE> TTE-LHCE> BTFE-LHCE> BTFEC-LHCE> SOA-электролит> TFEB-LHCE. Эта работа дает представление о разработке LHCE и подчеркивает правила выбора разбавителей для достижения стабильного цикла высоковольтных LMB.
Материалы и методы
Материалы.
Аккумуляторный LiFSI был получен от Nippon Shokubai и использовался после вакуумной сушки при 120 ° C в течение 24 часов. DME (аккумуляторный) был приобретен у Gotion, Inc., и используется в полученном виде. BTFE, TTE, BTFEC, TFEB и TFEO были приобретены в SynQuest Laboratories и были высушены с помощью предварительно активированных молекулярных сит перед использованием. Электролиты получали растворением LiFSI в растворителе DME и затем смешиванием с разбавителями в желаемых соотношениях. Катодный материал NMC811 с высоким содержанием никеля был приобретен у Targray. Катодный ламинат с поверхностной нагрузкой около 1,5 мАч см -2 был приготовлен путем покрытия алюминиевой фольги катодной суспензией, содержащей 96% материала NMC811, 2% проводящего углерода (C-NERGY Super P C65) и 2% связующего PVDF. (Kureha L # 1120) в N, N -диметилпирролидиноне.Катодные диски пробивались диаметром 1,27 см. LMA представлял собой Li (50 мкм) на медной фольге, заказанный в China Energy Lithium Co., Ltd.
Electrochemical Tests.
Для испытаний Li CE элементы Li || Cu собирали внутри перчаточного бокса, заполненного аргоном (MBraun, H 2 O <1 ppm, O 2 <1 ppm). Li-фольга, полиэтиленовый (PE) сепаратор (Asahi Kasei) и медная фольга были зажаты вместе в ячейках типа CR2032 (MTI) и запечатаны 75 мкл электролита. Li CE был протестирован с использованием протокола CE (метод 3 с Q T 5 мАч см −2 , Q C 1 мАч см −2 и n из 10) сообщалось в предыдущей работе (25).Ячейки Li || Cu также использовались для осаждения Li, с 1 мАч см −2 Li, нанесенным на Cu при токе 0,5 мА см −2 , и Li на фольге Cu собирали для изучения морфологии. Ячейки Li || NMC811 были собраны таким же образом, но вместо медной фольги использовался катодный диск NMC811, а во избежание коррозии нержавеющей стали при высоких напряжениях использовался покрытый алюминием катодный кожух. Еще одна алюминиевая фольга диаметром 1,9 см была помещена между катодным диском и алюминиевым корпусом для дополнительной защиты.Ячейки заряжались / разряжались в диапазоне напряжений от 2,8 до 4,4 В на тестерах наземных аккумуляторных батарей (Ухань, земля) при 25 ° C и со скоростью C / 3 (заряд постоянного напряжения при 4,4 В применялся после того, как элемент был заряжен до 4,4 В, пока ток не достигнет C / 20 или время не достигнет 1 ч) после двух циклов формирования при C / 10. Измерения EIS проводили на ячейках Li || NMC811 для контроля сопротивления после 100 циклов. Спектры импеданса переменного тока регистрировали в потенциостатическом режиме на электрохимической рабочей станции CHI 660 в диапазоне частот от 100 кГц до 10 мГц с возмущением 5 мВ при 25 ° C и при напряжении холостого хода при 0% степени заряда.
Характеристики.
Вязкость электролита (η) измеряли на вискозиметре Brookfield DV-II + Pro при 25 ° C (20). Ионную проводимость электролитов измеряли с помощью полностью интегрированного многоканального спектрометра проводимости (Bio-Logic MCS10) (21). Для посмертного анализа циклические ячейки были разобраны внутри перчаточного бокса, заполненного аргоном, чтобы собрать циклические электроды. Затем электроды промывали растворителем DME для удаления остаточных электролитов, сушили в вакууме и переносили в герметичные сосуды для измерений XPS, SEM и STEM.XPS-измерения проводились на сканирующем рентгеновском микрозонде Physical Electronics Quantera с фокусированным монохроматическим источником рентгеновского излучения Al K и (21). Для профилирования по глубине образцы распыляли ионами аргона при 2 кВ, 0,5 мА и угле падения 45 °, а скорость распыления основывалась на скорости распыления, калиброванной по известной толщине SiO 2 , которая составляла 6,1 нм · мин. -1 (21). Образцы STEM были приготовлены на системе FEI Helios Dual Beam.Слой Pt ∼2 мкм был нанесен на целевую частицу, которую случайным образом выбирали из циклического NMC811 для процесса подъема, а затем извлекали вместе с покрывающими слоями и приваривали к решетке ТЕМ (24). Процессы утонения проводились при 30 кВ, затем пучком ионов Ga 5 кВ, а затем 2 кВ для полировки поверхности и удаления поврежденных слоев (24). Затем свежеприготовленный образец был охарактеризован на микроскопе JEOL JEM-ARM200CF с коррекцией сферической аберрации с углом конвергенции 20.6 мрад для визуализации; сигналы от 90 до 370 мрад были собраны для HAADF-STEM, а сигналы от 10 до 23 мрад были собраны для визуализации ABF-STEM (24).
AIMD Simulation.
Моделирование AIMD было выполнено с использованием пакета моделирования Vienna Ab initio. Электрон-ионные взаимодействия описывались псевдопотенциалами усиленных прожектором волн (26) с энергией отсечки 400 эВ. Функционал обменно-корреляции был представлен с использованием обобщенного градиентного приближения Пердью-Берка-Эрнцерхофа.Использовался обменно-корреляционный функционал с шириной размытия по Гауссу 0,05 эВ. Критерий сходимости для электронной самосогласованной итерации был установлен равным 1 × 10 −5 эВ. Действие различных разбавителей в LHCE исследовали в каноническом ансамбле. Начальные плотности этих систем и их молярные отношения перечислены в таблице 1. Температура систем моделирования AIMD поддерживалась постоянной с использованием метода термостата Нозе с параметром массы Нозе 0,1 при 298 К.Исходная структура каждой системы LiFSI-DME-разбавитель была создана путем случайного размещения количества молекул LiFSI, DME и разбавителя на основе экспериментальных плотностей и молярных соотношений. Эти исходные геометрические структуры были впервые оптимизированы с помощью классической молекулярной динамики с использованием полностью атомных оптимизированных потенциалов для моделирования жидкости (OPLS-AA) силового поля (27). Затем системы были предварительно уравновешены в течение 5 пс с помощью AIMD. Наконец, моделирование продукта длительностью 10 пс было выполнено с шагом по времени 1 фс. PDOS были рассчитаны и усреднены по 10 различным конфигурациям (извлеченным из моментальных снимков моделирования MD), чтобы представить среднее по ансамблю PDOS.Использовалась сеточная схема с k-точечной сеткой Monkhorst-Pack с размерами 2 нм × 2 нм × 2 нм.
Доступность данных
Все данные исследования включены в статью SI и Приложение .
История изменений
26 февраля 2021 г .: Приложение SI обновлено.
Выражение признательности
Эта работа была поддержана помощником секретаря по энергоэффективности и возобновляемым источникам энергии Управления автомобильных технологий Министерства энергетики США (DOE) в рамках программы передовых исследований аккумуляторных материалов (Консорциум Battery500) по контракту №.DE-AC05-76RL01830. СЭМ, ПЭМ и XPS были выполнены в Лаборатории молекулярных наук об окружающей среде (сетка 436923.9), учреждении научного пользователя Министерства энергетики, спонсируемом Управлением биологических и экологических исследований и расположенном в Тихоокеанской северо-западной национальной лаборатории (PNNL). PNNL управляется Battelle для Министерства энергетики по контракту DE-AC05-76RL01830. Соль LiFSI была предоставлена доктором Кадзухико Мурата из Nippon Shokubai Co., Ltd.
Сноски
Вклад авторов: X.C., W.X. и J.-G.Z. спланированное исследование; X.C., P.G., X.R., L.Z., M.H.E., B.E.M., J.H., C.N. и D.L. проведенное исследование; X.C., P.G., X.R., L.Z., M.H.E., B.E.M., J.H., C.N., D.L., B.W.A., C.W., J.X., J.L., W.X. и J.-G.Z. проанализированные данные; и X.C., P.G., W.X. и J.-G.Z. написал газету.
Авторы заявляют об отсутствии конкурирующей заинтересованности.
Эта статья представляет собой прямое представление PNAS.
Эта статья содержит вспомогательную информацию на сайте https: // www.pnas.org/lookup/suppl/doi:10.1073/pnas.2020357118/-/DCSupplemental.
Как мы доберемся до следующего крупного прорыва в области аккумуляторных батарей — Quartz
Вы читаете эксклюзивную статью для участников Quartz, доступную для всех читателей в течение ограниченного времени. Чтобы разблокировать доступ ко всем Quartz, станьте участником.
Электрические самолеты могут быть будущим авиации. Теоретически они будут намного тише, дешевле и чище, чем те самолеты, которые есть у нас сегодня. Электрические самолеты с дальностью полета 1000 км (620 миль) на одной зарядке могут использоваться сегодня для половины всех рейсов коммерческих самолетов, сокращая глобальные выбросы углерода в авиации примерно на 15%.
То же самое и с электромобилями. Электромобиль — это не просто более чистая версия своего кузена, извергающего загрязнения. По сути, это лучший автомобиль: его электродвигатель мало шумит и молниеносно реагирует на решения водителя. Зарядка электромобиля обходится намного дешевле, чем оплата эквивалентного количества бензина. Электромобили могут быть построены с небольшим количеством движущихся частей, что удешевляет их обслуживание.
Так почему же электромобили уже не повсюду? Это связано с тем, что батареи дороги, поэтому первоначальная стоимость электромобиля намного выше, чем стоимость аналогичной модели с бензиновым двигателем.И если вы не водите много, экономия на бензине не всегда компенсирует более высокие первоначальные затраты. Короче говоря, электромобили по-прежнему не экономичны.
Точно так же современные батареи не обладают достаточной энергией по весу или объему для питания пассажирских самолетов. Нам все еще нужны фундаментальные прорывы в аккумуляторных технологиях, прежде чем это станет реальностью.
Портативные устройства с батарейным питанием изменили нашу жизнь. Но есть еще много вещей, которые могут вывести из строя батареи, если бы только более безопасные, более мощные и энергоемкие батареи могли быть сделаны дешево.Никакой закон физики не исключает их существования.
И все же, несмотря на более чем два столетия тщательного изучения с момента изобретения первой батареи в 1799 году, ученые до сих пор не до конца понимают многие основы того, что именно происходит внутри этих устройств. Что мы действительно знаем, так это то, что, по сути, есть три проблемы, которые необходимо решить, чтобы батареи действительно снова изменили нашу жизнь: мощность, энергия и безопасность.
Не существует универсальной литий-ионной батареи
Каждая батарея имеет два электрода: катод и анод.Большинство анодов литий-ионных батарей изготовлено из графита, но катоды изготавливаются из различных материалов, в зависимости от того, для чего будет использоваться батарея. Ниже вы можете увидеть, как различные материалы катода меняют работу типов батарей по шести параметрам.
Проблема питания
В просторечии люди используют термины «энергия» и «мощность» как синонимы, но при разговоре об аккумуляторах важно различать их. Мощность — это скорость, с которой может высвобождаться энергия.
Батарея, достаточно мощная для запуска и удержания в воздухе коммерческого реактивного самолета на расстояние 1000 км, требует большого количества энергии, чтобы высвободиться за очень короткое время, особенно во время взлета. Так что дело не только в накоплении большого количества энергии, но и в способности очень быстро извлекать эту энергию.
Решение проблемы энергоснабжения требует от нас заглянуть в черный ящик коммерческих аккумуляторов. Будет немного занудно, но терпи меня. Новые аккумуляторные технологии часто преувеличиваются, потому что большинство людей не уделяют должного внимания деталям.
Самая современная химия аккумуляторов, которая у нас есть, — это литий-ионные. Большинство экспертов сходятся во мнении, что никакая другая химия не сможет подорвать ионно-литиевый сплав в течение как минимум еще одного десятилетия или более. Литий-ионный аккумулятор имеет два электрода (катод и анод) с сепаратором (материал, который проводит ионы, но не электроны, предназначен для предотвращения короткого замыкания) в середине и электролит (обычно жидкий) для обеспечения обратного потока ионов лития и вперед между электродами. Когда батарея заряжается, ионы перемещаются от катода к аноду; когда батарея что-то питает, ионы движутся в противоположном направлении.
Представьте себе две буханки нарезанного хлеба. Каждая буханка — это электрод: левый — катод, а правый — анод. Предположим, что катод состоит из кусочков никеля, марганца и кобальта (NMC) — одного из лучших в своем классе — и что анод состоит из графита, который по сути представляет собой слоистые листы или кусочки атомов углерода. .
В разряженном состоянии, то есть после того, как энергия была истощена, буханка NMC содержит ионы лития, расположенные между каждым ломтиком. Когда батарея заряжается, каждый ион лития извлекается из промежутков между пластинами и вынужден проходить через жидкий электролит.Сепаратор действует как контрольно-пропускной пункт, гарантирующий, что только ионы лития проходят через графитовую буханку. Когда батарея полностью заряжена, в катодной буханке не останется ионов лития; все они будут аккуратно зажаты между ломтиками графитового хлеба. По мере того, как энергия батареи расходуется, ионы лития возвращаются к катоду, пока на аноде не останется ни одного. Вот тогда аккумулятор нужно зарядить снова.
Емкость аккумулятора в основном определяется скоростью этого процесса.Но не так-то просто увеличить скорость. Слишком быстрое извлечение ионов лития из катодной буханки может привести к появлению дефектов на ломтиках и, в конечном итоге, к их разрушению. Это одна из причин, почему чем дольше мы пользуемся смартфоном, ноутбуком или электромобилем, тем хуже время автономной работы. Каждая зарядка и разрядка заставляют буханку немного ослабевать.
Над решением проблемы работают разные компании. Одна из идей — заменить слоистые электроды чем-то более прочным.Например, швейцарская компания по производству аккумуляторов Leclanché со 100-летней историей работает над технологией, в которой используется фосфат лития-железа (LFP), имеющий структуру «оливина», в качестве катода, и оксид титаната лития (LTO), который имеет Структура «шпинель», как анод. Эти структуры лучше справляются с потоком ионов лития в материал и из него.
Leclanché в настоящее время использует свои аккумуляторные элементы в автономных складских вилочных погрузчиках, которые можно полностью зарядить за девять минут. Для сравнения: лучший нагнетатель Tesla может зарядить автомобильный аккумулятор Tesla примерно до 50% за 10 минут.Leclanché также внедряет свои аккумуляторы в Великобритании для быстрой зарядки электромобилей. Эти батареи находятся на зарядной станции, медленно потребляя небольшое количество энергии в течение длительного периода времени из сети, пока они не будут полностью заряжены. Затем, когда автомобиль пристыковывается, аккумуляторы док-станции быстро заряжают аккумулятор автомобиля. Когда машина уезжает, аккумулятор станции снова начинает заряжаться.
Такие попытки, как Лекланше, показывают, что можно изменить химический состав аккумуляторов, чтобы увеличить их мощность. Тем не менее, никто еще не построил батарею, достаточно мощную, чтобы быстро доставить энергию, необходимую коммерческому самолету для преодоления гравитации.Стартапы стремятся строить самолеты меньшего размера (вмещающие до 12 человек), которые могли бы летать на относительно менее энергоемких батареях, или электрические гибридные самолеты, где реактивное топливо выполняет тяжелую работу, а батареи — инерцию.
Но на самом деле в этой сфере нет ни одной компании, которая могла бы даже приблизиться к коммерциализации. Кроме того, технический скачок, необходимый для полностью электрического коммерческого самолета, вероятно, займет десятилетия, — говорит Венкат Вишванатан, эксперт по аккумуляторным батареям в Университете Карнеги-Меллона.
Reuters / Alister Doyle
Двухместный электрический самолет, сделанный словенской фирмой Pipistrel, стоит у ангара в аэропорту Осло, Норвегия.Энергетическая проблема
Tesla Model 3, самая доступная модель компании, стоит от 35 000 долларов. Он работает от батареи на 50 кВтч, что стоит примерно 8750 долларов, или 25% от общей стоимости автомобиля.
Это все еще удивительно доступно по сравнению с тем, что было не так давно. По данным Bloomberg New Energy Finance, средняя мировая стоимость литий-ионных аккумуляторов в 2018 году составляла около 175 долларов за киловатт-час, что ниже почти 1200 долларов за киловатт-час в 2010 году.
Министерство энергетики США подсчитало, что как только стоимость батареи упадет ниже 125 долларов за кВтч, владение и эксплуатация электромобиля будет дешевле, чем бензинового автомобиля в большинстве частей мира. Это не означает, что электромобили победят автомобили с бензиновым двигателем во всех нишах и сферах — например, для грузовиков дальнего следования еще нет электрического решения. Но это переломный момент, когда люди начнут отдавать предпочтение электромобилям просто потому, что в большинстве случаев они будут иметь более экономичный смысл.
Один из способов добиться этого — увеличить удельную энергию аккумуляторов — втиснуть в аккумуляторную батарею больше киловатт-часов без снижения ее цены. Теоретически это может сделать специалист по производству аккумуляторов, увеличив удельную энергию катода или анода, либо того и другого.
Самый энергоемкий катод на пути к коммерческой доступности — это NMC 811 (каждая цифра в номере представляет собой соотношение никеля, марганца и кобальта, соответственно, в смеси). Это еще не идеально. Самая большая проблема заключается в том, что он может выдержать только относительно небольшое количество жизненных циклов заряда-разряда, прежде чем он перестанет работать.Но эксперты прогнозируют, что отраслевые исследования и разработки должны решить проблемы NMC 811 в течение следующих пяти лет. Когда это произойдет, батареи, использующие NMC 811, будут иметь более высокую плотность энергии на 10% или более.
Однако увеличение на 10% — это не так уж и много в общей картине.
И хотя ряд инноваций за последние несколько десятилетий поднял плотность энергии катодов еще выше, аноды — это то, где открываются самые большие возможности для плотности энергии.
Графит был и остается главным анодным материалом.Он дешевый, надежный и относительно энергоемкий, особенно по сравнению с современными катодными материалами. Но он довольно слабый, если сравнивать его с другими потенциальными анодными материалами, такими как кремний и литий.
Кремний, например, теоретически намного лучше поглощает ионы лития, чем графит. Вот почему ряд производителей аккумуляторов пытаются добавить кремний вместе с графитом в свои анодные конструкции; Генеральный директор Tesla Илон Маск сказал, что его компания уже делает это в своих литий-ионных батареях.
Большим шагом была бы разработка коммерчески жизнеспособного анода, полностью сделанного из кремния. Но у этого элемента есть черты, которые затрудняют это. Когда графит поглощает ионы лития, его объем не сильно меняется. Однако кремниевый анод по тому же сценарию набухает в четыре раза по сравнению с исходным объемом.
К сожалению, вы не можете просто увеличить корпус, чтобы приспособиться к этому вздутию, потому что расширение разрушает то, что называется «межфазной фазой твердого электролита», или SEI, кремниевого анода.
SEI можно рассматривать как своего рода защитный слой, который анод создает для себя, подобно тому, как железо образует ржавчину, также известную как оксид железа, чтобы защитить себя от элементов: когда вы оставляете кусок недавно кованое железо снаружи, оно медленно вступает в реакцию с кислородом воздуха, образуя ржавчину. Под слоем ржавчины остальная часть железа не постигает та же участь и, таким образом, сохраняет структурную целостность.
В конце первого заряда батареи электрод образует собственный слой «ржавчины» — SEI, отделяющий неэродированную часть электрода от электролита.SEI предотвращает потребление электрода дополнительными химическими реакциями, гарантируя, что ионы лития могут течь как можно более плавно.
Но с кремниевым анодом SEI ломается каждый раз, когда батарея используется для питания чего-либо, и восстанавливается каждый раз, когда батарея заряжается. И во время каждого цикла зарядки расходуется немного кремния. В конце концов, силикон рассасывается до такой степени, что батарея перестает работать.
За последнее десятилетие несколько стартапов Кремниевой долины работали над решением этой проблемы.Например, подход Sila Nano заключается в том, чтобы заключить атомы кремния в наноразмерную оболочку с большим количеством пустого места внутри. Таким образом, SEI формируется снаружи оболочки, и расширение атомов кремния происходит внутри нее, не разрушая SEI после каждого цикла заряда-разряда. Компания, оцениваемая в 350 миллионов долларов, заявляет, что ее технология будет использоваться в устройствах уже в 2020 году.
Enovix, с другой стороны, применяет особую производственную технологию, чтобы подвергнуть 100% кремниевый анод огромному физическому давлению, заставляя его поглощать меньше ион лития и, таким образом, ограничивает расширение анода и предотвращает разрушение SEI.У компании есть инвестиции от Intel и Qualcomm, и она также ожидает, что к 2020 году ее батареи будут в устройствах.
Эти компромиссы означают, что кремниевый анод не может достичь своей теоретической высокой плотности энергии. Однако обе компании заявляют, что их аноды работают лучше, чем графитовые. Третьи стороны в настоящее время тестируют аккумуляторы обеих фирм.
Tesla
В 2020 году новый Tesla Roadster должен стать первым электромобилем, который может проехать 1000 км (620 миль) на одной зарядке.Проблема безопасности
Все молекулярные переделки, предпринятые для накопления большего количества энергии в батареях, могут происходить за счет безопасности. С момента своего изобретения литий-ионный аккумулятор вызывает головные боли из-за того, как часто он воспламеняется. Например, в 1990-х годах канадская компания Moli Energy начала продавать литий-металлические батареи для использования в телефонах. Но в реальном мире его батареи начали воспламеняться, и Moli был вынужден отозвать свой заказ и, в конечном итоге, объявить о банкротстве. (Некоторые из его активов были куплены тайваньской компанией, и она до сих пор продает литий-ионные батареи под торговой маркой E-One Moli Energy.) Совсем недавно смартфоны Samsung Galaxy Note 7, которые были сделаны на современных литий-ионных батареях, начали взрываться в карманах людей. В результате отзыв продукции в 2016 году обошелся южнокорейскому гиганту в 5,3 миллиарда долларов.
Современные литий-ионные батареи по-прежнему сопряжены с риском, поскольку в них почти всегда используются легковоспламеняющиеся жидкости в качестве электролита. Одна из прискорбных (для нас, людей) причуд природы заключается в том, что жидкости, способные легко переносить ионы, также имеют более низкий порог воспламенения.Одно из решений — использовать твердые электролиты. Но это означает другие компромиссы. Конструкция батареи может легко включать жидкий электролит, который контактирует с каждым битом электродов, что позволяет эффективно переносить ионы. С твердыми телами намного сложнее. Представьте, что вы бросаете пару кубиков в чашку с водой. А теперь представьте, что те же самые кости бросают в чашку с песком. Очевидно, что вода будет касаться гораздо большей площади поверхности игральных костей, чем песок.
До сих пор коммерческое использование литий-ионных батарей с твердыми электролитами ограничивалось приложениями с низким энергопотреблением, такими как датчики, подключенные к Интернету.Усилия по увеличению масштабов твердотельных батарей, то есть не содержащих жидкий электролит, можно в общих чертах разделить на две категории: твердые полимеры при высоких температурах и керамика при комнатной температуре.
Твердые полимеры при высоких температурах
Полимеры представляют собой длинные цепочки молекул, связанных вместе. Они очень распространены в повседневном использовании — например, одноразовые полиэтиленовые пакеты делают из полимеров. Когда некоторые типы полимеров нагреваются, они ведут себя как жидкости, но без воспламеняемости жидких электролитов, используемых в большинстве батарей.Другими словами, они обладают высокой ионной проводимостью, как жидкий электролит, без каких-либо рисков.
Но у них есть ограничения. Они могут работать только при температуре выше 105 ° C (220 ° F), что означает, что они не подходят, например, для смартфонов. Но их можно использовать, например, для хранения энергии от сети в домашних батареях. По крайней мере, две компании — SEEO (США) и Bolloré (Франция) — разрабатывают твердотельные батареи, в которых в качестве электролита используются высокотемпературные полимеры.
Керамика при комнатной температуре
За последнее десятилетие два класса керамики — LLZO (оксид лития, лантана и циркония) и LGPS (литий, германий, сульфид фосфора) — показали почти такие же хорошие проводящие ионы при комнатной температуре. как жидкости.
Toyota, а также стартап из Кремниевой долины QuantumScape (который в прошлом году привлек 100 миллионов долларов финансирования от Volkswagen) работают над внедрением керамики в литий-ионные батареи. Включение крупных игроков в пространство свидетельствует о том, что прорыв может быть ближе, чем многие думают.
«Мы очень близки к тому, чтобы увидеть что-то реальное [с использованием керамики] через два или три года», — говорит Вишванатан из Карнеги-Меллона.
Закон о балансе
Аккумуляторы — это уже большой бизнес, и их рынок продолжает расти.Все эти деньги привлекают множество предпринимателей с еще большим количеством идей. Но стартап с аккумуляторными батареями — сложная ставка — они терпят неудачу даже чаще, чем компании-разработчики программного обеспечения, которые известны своим высоким уровнем отказов. Это потому, что инновации в области материаловедения — это сложно.
На данный момент химики, занимающиеся аккумуляторными батареями, обнаружили, что, когда они пытаются улучшить одну характеристику (например, плотность энергии), им приходится идти на компромисс в отношении другой характеристики (например, безопасности). Такой баланс означает, что прогресс на каждом фронте был медленным и чреват проблемами.
Но если внимательнее присмотреться к проблеме — Йет-Мин Чан из Массачусетского технологического института считает, что сегодня в США в три раза больше ученых по батареям, чем всего 10 лет назад, — шансы на успех возрастут. Потенциал аккумуляторов остается огромным, но, учитывая предстоящие проблемы, лучше относиться к каждому заявлению о новых аккумуляторах с хорошей долей скептицизма.
Как ареометр измеряет заряд автомобильного аккумулятора?
Ареометр батареи используется для проверки состояния заряда элемента батареи .Это выполняется посредством измерения плотности электролита, что достигается путем измерения удельного веса электролита. Чем больше концентрация серной кислоты, тем плотнее становится электролит.
Щелкните, чтобы увидеть полный ответ
С учетом этого, каковы показания ареометра для полностью заряженной батареи?
Поплавок в ареометре откалиброван на , читать с точки зрения удельного веса.Обычно в этих поплавках используется диапазон удельного веса от 1,160 до 1,325. Обычный удельный вес , показывающий , составляет от 1,250 до 1,280 в большинстве климатических условий для полностью заряженной батареи , с , показывающий от 1,210 до 1,230 в тропическом климате.
Далее вопрос, как проверить силу тяжести аккумулятора в домашних условиях? Опубликовано 11 февраля 2018 г.
- Откройте каждую ячейку аккумулятора.
- Добавьте инструмент для измерения силы тяжести в каждую ячейку батареи, и он будет называться ареометром.
- Если меньше 1250 уровня. Добавьте еще кислоты и водного раствора.
- Если больше 1250 уровня. Удалите из аккумулятора избыток раствора кислоты и воды.
Проще говоря, как измерить силу тяжести в батарее?
Состояние заряда каждой ячейки можно измерить с помощью ареометра, чтобы определить удельный вес электролита (удельный вес — это его вес по сравнению с водой). Наберите кислоту в ареометр так, чтобы поплавок поднимался свободно и не касался верха или низа.
Заливаете ли вы воду в автомобильный аккумулятор?
Используйте только дистиллированную воду для заполнения ячеек. Дистиллированную воду можно купить в большинстве продуктовых магазинов. Если уровень электролита в ячейках низкий (пластины обнажены), заполните каждую ячейку, чтобы просто закрыть пластины. Затем используйте зарядное устройство battery , чтобы зарядить батарею , или просто проехать на автомобиле в течение нескольких дней в обычном режиме.
Больше никаких проб и ошибок при выборе электролита для металло-воздушных батарей — The Source
Металл-воздушные батареи были предложены как преемники литий-ионных батарей из-за их исключительной гравиметрической плотности энергии.Они потенциально могут позволить электромобилям проехать тысячу миль и более без подзарядки.
Перспективным новым представителем семейства щелочно-металлических-воздушных батарей является калиево-воздушная батарея, плотность энергии которой более чем в три раза превышает теоретическую гравиметрическую плотность энергии ионно-литиевых батарей. Ключевой проблемой при разработке калиево-воздушных батарей является выбор правильного электролита, жидкости, которая облегчает перенос ионов между катодом и анодом.
RamaniОбычно электролиты выбираются методом проб и ошибок, основанным на практических правилах корреляции нескольких свойств электролита, с последующим исчерпывающим (и требующим много времени) тестированием нескольких кандидатов в электролиты, чтобы увидеть, достигаются ли желаемые характеристики.
Исследователи из Вашингтонского университета в Сент-Луисе под руководством Виджая Рамани, Рома Б. и Раймонда Х. Витткоффа, заслуженного профессора окружающей среды и энергетики инженерной школы Маккелви, теперь показали, как можно использовать электролиты для щелочно-металлических воздушных батарей. выбирается с помощью одного легко измеряемого параметра.
Их работа была опубликована 10 июля в Трудах Национальной академии наук.
Команда Рамани изучила фундаментальные взаимодействия между солью и растворителем в электролите и показала, как эти взаимодействия могут влиять на общую производительность батареи.Они разработали новый параметр, а именно «электрохимический» модуль Тиле, показатель легкости переноса ионов и реакции на поверхности электрода.
Демонстрация того, как один дескриптор параметра энергии сольватации коррелирует как с переносом ионов, так и с кинетикой поверхностных реакций, является прорывным достижением. Это позволит рационально разрабатывать новые высокоэффективные электролиты для металло-воздушных аккумуляторов.
Виджай Рамани
В этом исследовании документально подтверждено, что впервые теория переноса электронов Маркуса-Хуша, лауреата Нобелевской премии, была использована для изучения влияния состава электролита на движение ионов через электролит и их реакцию на поверхности электрода.
Было показано, что этот модуль Тиле экспоненциально уменьшается с увеличением энергии реорганизации растворителя — меры энергии, необходимой для модификации сольватационной сферы растворенного вещества. Таким образом, энергия реорганизации растворителя может быть использована для рационального выбора электролитов для высокоэффективных металло-воздушных батарей. Больше никаких проб и ошибок.
«Мы начали с попытки лучше понять влияние электролита на реакцию восстановления кислорода в системах металл-воздух», — сказал Шрихари Санкарасубраманян, научный сотрудник команды Рамани и ведущий автор исследования.«Мы закончили тем, что показали, как диффузия ионов в электролите и реакция этих ионов на поверхности электрода коррелируют с энергией, необходимой для разрушения сольватной оболочки вокруг растворенных ионов».
«Демонстрация того, как один дескриптор параметра энергии сольватации коррелирует как с переносом ионов, так и с кинетикой поверхностных реакций, является прорывным достижением», — сказал Рамани. «Это позволит нам рационально разрабатывать новые высокоэффективные электролиты для металло-воздушных аккумуляторов.”
Джошуа Каки, начинающий юноша в Департаменте энергетики, окружающей среды и химической инженерии, является вторым автором исследования. Он помогал проводить исследование в качестве летнего стажера в лаборатории Рамани.
Инженерная школа Маккелви при Вашингтонском университете в Сент-Луисе концентрирует интеллектуальные усилия на новой парадигме конвергенции и опирается на сильные стороны, особенно в применении к медицине и здоровью, энергетике и окружающей среде, предпринимательству и безопасности.Имея 96,5 штатных / постоянных преподавателей и 33 дополнительных штатных преподавателя, 1361 студента бакалавриата, 1291 аспирант и 21000 выпускников, мы работаем над тем, чтобы использовать наши партнерские отношения с академическими и отраслевыми партнерами — по дисциплинам и по всему миру — для содействия решению величайшие глобальные вызовы 21 века.
Микроскопия и ИК-Фурье спектроскопия, представленные в этой работе, были выполнены в Нано-исследовательском центре, который поддерживается Национальным научным фондом в рамках гранта ECS-0335765.
Отчет о рынке твердотельных автомобильных аккумуляторов, 2022-2032 гг.
Нью-Йорк, 26 ноября 2021 г. (GLOBE NEWSWIRE) — Reportlinker.com объявляет о выпуске отчета «Отчет о рынке твердотельных автомобильных аккумуляторов 2022-2032 гг.» — https://www.reportlinker.com/p06186249/? utm_source = GNW
Отчет о рынке твердотельных автомобильных аккумуляторов за 2022–2032 годы: этот отчет окажется бесценным для ведущих фирм, стремящихся получить новые источники дохода, если они хотят лучше понять отрасль и ее основную динамику.Это будет полезно для компаний, которые хотели бы выйти в другие отрасли или расширить свою существующую деятельность в новом регионе.
Твердотельный аккумулятор может быстро заряжаться
Твердотельный аккумулятор не содержит жидкого электролита, который нагревается во время быстрой зарядки, и поэтому обеспечивает большую безопасность, чем жидкие литий-ионные аккумуляторы. Твердотельные батареи в электромобилях обеспечат более быстрое время зарядки, лучший диапазон хода и даже более высокую плотность энергии в дополнение к повышенной безопасности, компактности и стабильности.Твердотельные батареи могут заряжаться до 80% за 15 минут и менее подвержены нагрузкам после многочисленных циклов зарядки. Литий-ионные аккумуляторы, которые сегодня заряжаются часами, заряжаются всего за несколько минут. Он значительно плотнее, чем литий-ионный, и может хранить в три раза больше энергии на той же площади. Даже при четырех градусах ниже нуля такая батарея сохраняет высокую проводимость (или -20 градусов по Цельсию). Стабильность твердотельного аккумулятора очень важна.
Растущая потребность в SSB в электромобилях
Твердотельные батареи могут изменить правила игры для электромобилей (EV), сохраняя больше энергии, заряжаясь быстрее и обеспечивая более высокую безопасность, чем жидкие литий-ионные батареи, ускоряя переход от автомобили, работающие на ископаемом топливе.В результате электромобили, работающие от литий-ионных аккумуляторов, более чувствительны к пожарам и утечкам химических веществ.
Какие вопросы следует задать перед покупкой отчета об исследовании рынка?
• Как развивается рынок твердотельных автомобильных аккумуляторов?
• Что движет и сдерживает рынок твердотельных автомобильных аккумуляторов?
• Как будет расти каждый сегмент субрынка твердотельных автомобильных аккумуляторов в течение прогнозируемого периода и какую выручку будут приносить эти субрынки в 2032 году?
• Как будут развиваться рыночные доли каждого субрынка твердотельных автомобильных аккумуляторов с 2022 по 2032 год?
• Что станет основным драйвером для рынка в целом с 2022 по 2032 год?
• Будут ли ведущие рынки твердотельных автомобильных аккумуляторов в целом следовать за макроэкономической динамикой или отдельные национальные рынки будут опережать другие?
• Как изменится рыночная доля национальных рынков к 2032 году и какой географический регион будет лидером рынка в 2032 году?
• Кто являются ведущими игроками и каковы их перспективы на прогнозируемый период?
• Какие проекты по производству твердотельных аккумуляторных батарей для этих ведущих компаний?
• Как отрасль будет развиваться в период с 2020 по 2032 год?
• Каковы последствия проектов по производству твердотельных автомобильных аккумуляторов, реализуемых сейчас и в ближайшие 10 лет?
• Существует ли большая потребность в коммерциализации продукта для дальнейшего расширения рынка твердотельных автомобильных аккумуляторов?
• Куда движется рынок твердотельных автомобильных аккумуляторов? И как вы можете быть уверены, что находитесь в авангарде рынка?
• Какие варианты инвестиций могут быть наилучшими для новых продуктов и услуг?
• Каковы основные перспективы вывода компаний на новый путь роста? С-люкс?
Вам необходимо выяснить, как это повлияет на рынок твердотельных автомобильных аккумуляторов сегодня и в следующие 10 лет:
• Наш 485-страничный отчет содержит 270 таблиц и 264 диаграмм / графиков специально для вас.
• В отчете выделены ключевые прибыльные области в отрасли, чтобы вы могли на них ориентироваться — СЕЙЧАС.
• Содержит углубленный анализ глобальных, региональных и национальных продаж и роста.
• Подчеркивает для вас ключевые успешные тенденции, изменения и прогнозы доходов, сделанные вашими конкурентами.
В этом отчете СЕГОДНЯ будет рассказано, как будет развиваться рынок твердотельных автомобильных аккумуляторов. будут развиваться в следующие 10 лет в соответствии с изменениями в экономической рецессии и отскоке от COVID-19. Этот рынок сейчас более критичен, чем когда-либо за последние 10 лет.
Прогнозы до 2032 года и другие анализы раскрывают коммерческие перспективы
• В дополнение к прогнозу доходов до 2032 года наше новое исследование предоставляет вам последние результаты, темпы роста и доли рынка.
• Вы найдете оригинальные анализы с прогнозами и событиями в бизнесе.
• Узнайте о качественном анализе (включая динамику рынка, движущие силы, возможности, ограничения и проблемы), структуре затрат, влиянии роста цен на твердотельные автомобильные аккумуляторы и последних событиях.
Этот отчет включает анализ данных и бесценную информацию о том, как COVID-19 повлияет на отрасль и вашу компанию. В этом отчете обсуждаются четыре модели выздоровления от COVID-19 и их влияние, а именно V, L, W и U.
Мировой рынок твердотельных автомобильных аккумуляторов (анализ воздействия COVID) по типам транспортных средств
• Легковые автомобили
• Коммерческие автомобили
Глобальный рынок твердотельных автомобильных аккумуляторов (анализ воздействия COVID) по силовым установкам
• Аккумуляторные электромобили (BEV)
• Подключаемый к сети гибридный электромобиль (PHEV)
• Другая силовая установка
Глобальный рынок твердотельных автомобильных аккумуляторов (анализ воздействия COVID) по плотности энергии
• <450 Втч / кг
•> 450 Втч / кг
Мировой рынок твердотельных автомобильных аккумуляторов (анализ воздействия COVID) по типу
• Гибридные твердо-жидкие электролиты
• Полимерные и композитные твердые электролиты
• Гранатовые твердые электролиты
• Сульфидные твердые электролиты
• Тонкопленочные твердотельные Аккумуляторы
• Другой тип
В дополнение к прогнозам доходов для всего мирового рынка и сегментов, вы также найдете прогнозы доходов для 4 региональных и 20 ведущих национальных рынков:
• Рынок твердотельных автомобильных аккумуляторов Северной Америки, 2022–2032 гг. Обзор рынка
• U.S. Рынок твердотельных автомобильных аккумуляторов, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов в Канаде, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов в Мексике, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Европейский рынок твердотельных автомобильных аккумуляторов, 2022–2032 гг. Обзор рынка
• Рынок твердотельных автомобильных аккумуляторов Германии, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов Испании, Прогноз рынка на 2022–2032 годы и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов Соединенного Королевства, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных аккумуляторов во Франции, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов Италии, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Прогноз рынка остальных стран Европы и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов в Азиатско-Тихоокеанском регионе, 2022 г. до 2032 г. Обзор рынка
• Рынок твердотельных автомобильных аккумуляторов в Китае, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных аккумуляторных батарей в Японии, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Твердотельные автомобильные аккумуляторы в Индии Рынок, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов в Австралии, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных аккумуляторов в Южной Корее, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Прогноз рынка остальной части Азиатско-Тихоокеанского региона и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов LAMEA, 2022–2032 гг. Обзор рынка
• Рынок твердотельных аккумуляторов в Бразилии, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Турция Solid -Государственный рынок автомобильных аккумуляторов, прогноз рынка на 2022–2032 годы и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов Саудовской Аравии, прогноз рынка на 2022–2032 годы и анализ воздействия COVID
• Sou й Рынок твердотельных автомобильных аккумуляторов в Африке, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Рынок твердотельных автомобильных аккумуляторов в ОАЭ, 2022–2032 гг. Прогноз рынка и анализ воздействия COVID
• Остальная часть Латинской Америки, Ближнего Востока и Африки
В отчет также включены профили некоторых ведущих компаний на рынке твердотельных автомобильных аккумуляторов с 2022 по 2032 годы, с акцентом на этот сегмент деятельности этих компаний.
Ведущие компании и потенциал роста рынка
• Akasol
• BrightVolt
• BYD
• CATL
• Cymbet
• Electrovaya Inc
• Ilika Ltd.
• Leclanche SA
• LG Chem Ltd.
• Mitsubishi Motors
• Northvolt
• Octillion Power Systems
• Panasonic Corporation
• Аккумулятор Prieto
• ProLogium
• Samsung SDI
• SK Innovation
• Solid Power
• Stellantis NV
• Toyota Motor Corporation
Общий мировой доход от продаж твердотельных автомобилей Рынок аккумуляторов, с 2022 по 2032 год, по оценке нашей работы, в 2022 году рынок превысит XX млн долларов США в стоимостном выражении.Мы прогнозируем значительный рост доходов до 2032 года. Наша работа определяет, какие организации обладают наибольшим потенциалом. Узнайте об их возможностях, прогрессе и коммерческих перспективах, помогая вам оставаться впереди.
Чем вам поможет отчет о рынке твердотельных автомобильных аккумуляторов, 2022–2032 гг.?
Таким образом, наш отчет с более чем 480 страницами предоставляет вам следующую информацию:
• Прогнозы доходов до 2032 года для рынка твердотельных автомобильных аккумуляторов, с 2022 по 2032 годы, с прогнозами для каждого из них на глобальном и региональном уровнях — открыть для себя перспективы отрасли, найти наиболее прибыльные места для инвестиций и доходов
• Прогнозы доходов до 2032 года для 4 региональных и 20 ключевых национальных рынков — см. прогнозы для рынка твердотельных автомобильных аккумуляторов на 2022–2032 годы в Северной Америке, Европе, Азиатско-Тихоокеанский регион и LAMEA.Также прогнозируется рынок США, Канады, Мексики, Бразилии, Германии, Франции, Великобритании, Италии, Китая, Индии, Японии и Австралии среди других ведущих экономик.
• Перспективы для устоявшихся фирм и тех, кто хочет выйти на рынок, включая профили компаний для 20 основных компаний, участвующих в рынке твердотельных автомобильных аккумуляторов, с 2022 по 2032 годы.
Прочтите полный отчет: https://www.reportlinker.com/p06186249/?utm_source=GNW
О Reportlinker
ReportLinker — это отмеченное наградами решение для исследования рынка.Reportlinker находит и систематизирует самые свежие отраслевые данные, чтобы вы могли мгновенно получать все необходимые исследования рынка в одном месте.
__________________________
Плотность электролита
Осмотр аккумуляторной батареи позволяет оценить ее техническое состояние. Можно выделить некоторые недостатки. Проверка АКБ (внешнее состояние, качество изоляционной мастики, плотность) снятого с автомобиля аккумулятора проводится в определенном порядке.
В первую очередь нужно проверить состояние самого моноблока, убедиться в отсутствии протечек. Для этого протрите стенки и дно сухой тканью и осмотрите. Если есть течь, необходимо заменить моноблок.
Далее следует проверить состояние поверхностей крышек аккумуляторных батарей, слоя мастики. Крышки не должны быть грязными, на них не должно быть трещин и шероховатостей. Электролит и грязь, попавшие в трещины, способны проводить электрический ток.Это ускоряет саморазряд аккумулятора. Если на поверхности аккумулятора есть грязь или видны следы пролитого электролита, протрите поверхность тканью, смоченной 10% -ным водным раствором аммиака. После этого насухо вытрите крышки.
С особой тщательностью необходимо проверить зажимы аккумуляторной батареи. Слой оксида, образовавшийся на штыревых фиксаторах, следует удалить стеклянной пленкой (при закрытых пробках). Также необходимо очистить винтовые зажимы, вынуть заглушки и прочистить газоотводные отверстия тонкой деревянной палочкой.Не используйте для этой цели металлическую проволоку.
Разряженный аккумулятор, неспособный вращать коленчатый вал с необходимой скоростью, необходимо зарядить. При обнаружении инородных частиц в электролите или изменении цвета электролит необходимо заменить. Перед заменой следует разрядить аккумулятор до приемлемого уровня. После этого необходимо слить электролит. Аккумулятор необходимо промыть. Для этого используйте дистиллированную воду. Промывку следует проводить, соблюдая технику безопасности.После того, как заливка сделана снова. Плотность электролита, заливаемого после промывки, должна быть такой же, как и раньше. После этого следует снова зарядить аккумулятор.
Необходимо регулярно проверять уровень и плотность электролита в каждой «банке» в соответствии с климатическими условиями и временем года.
Для определения уровня следует использовать специальную стеклянную трубку. Опускается в гидроаккумулятор до упора в верхний край пластины. После того, как трубку следует зажать пальцем, достаньте ее и посмотрите уровень жидкости в ней.
Однако, как правило, трубка отсутствует. В этом случае можно взять лист бумаги, согнуть его в виде палочки и бросить в «банку». Электролит пропитает бумагу, и уровень будет виден. Нормой считается десять-пятнадцать миллиметров (если все в порядке, можно проверить плотность).
Следует добавить дистиллированную воду, если уровень ниже нормы. Допускается пополнение только h3O. Это связано с тем, что во время работы из электролита испаряется вода.Более тяжелая кислота остается в пластинах. Если долить электролит, кислоты будет в избытке. Это приведет к быстрому отрыву слоя и выходу из строя аккумулятора.
Плотность электролита является показателем степени заряда аккумулятора. Если в него вводится h3O, измерения можно проводить через два часа после повторного заполнения. Плотность полностью заряженного аккумулятора составляет 1,28-1,30 грамма на кубический сантиметр.
