Порядок применения коэффициента бонус-малус | Порядок расчёта КБМ
Порядок применения коэффициента бонус-малус
Приобретая полис ОСАГО, автовладельцы должны разобраться в процессе вычисления его стоимости. Коэффициент бонус-малус значительно влияет на окончательную сумму страховки. Соблюдение правил безопасной езды, сведение к нулю риска аварийных ситуаций на дороге сэкономят деньги водителя при оформлении полиса. КБМ – своеобразное поощрение водителей за уверенное и безаварийное вождение.
Полис на автомобиль Определение и применение бонус-малус исходит из доступной и открытой базы данных АИС РСА, в которой хранится вся информация за предыдущие периоды. Если на каком-то этапе при переоформлении полиса страхователь заметил, что применение КБМ было завышенным, он имеет право написать заявление страховщику с просьбой пересчитать тариф и сделать возврат части платежа.
Порядок применения коэффициента бонус-малус регулируется Указанием Центрального Банка Российской Федерации. Он определяется классом, который зависит от количества страховых возмещений за предыдущий период. Если автовладелец впервые оформляет полис, то ему автоматически присваивается коэффициент равный 1 (класс 3).
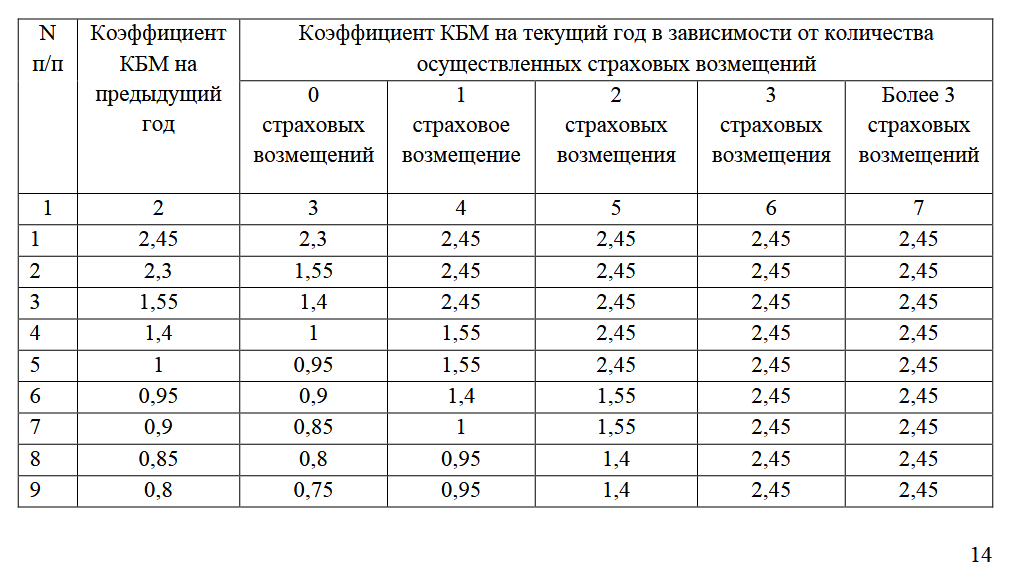
Для расчёта КБМ пользуются таблицей:
Согласно нововведениям, вступившим в силу с 1 апреля 2019 г., КБМ будет устанавливаться на 1 год и пересчитываться 01 апреля ежегодно. Его значение станет фиксированным в течение срока и будет применяться ко всем заключенным договорам обязательного страхования в этом промежутке времени.
Порядок расчета коэффициента зависит от количества водителей, указанных в договоре страхования, и устанавливается по самому «аварийному» водителю.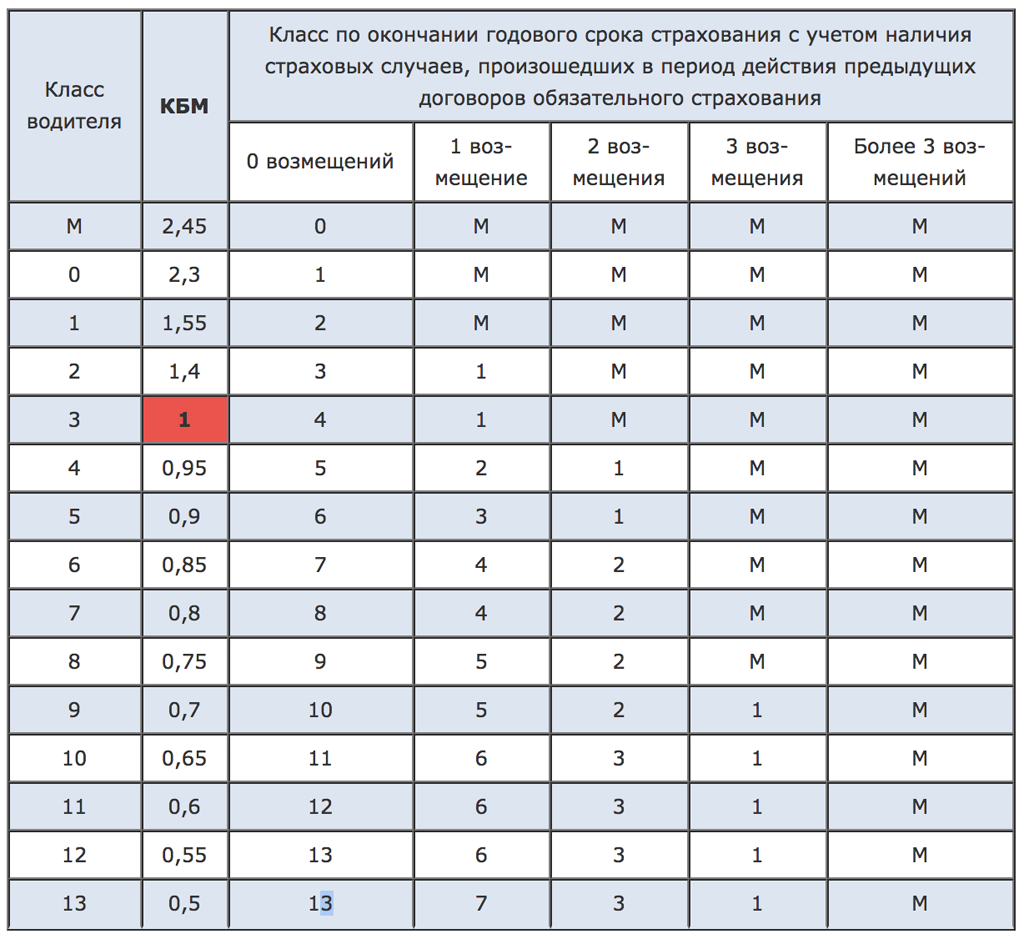
Проверить свой КБМ можно онлайн на сайте РСА. В ответ на запрос вы получите таблицу с данными о последней страховке, информацию о количестве страховых случаев и новый КБМ.
Применение коэффициента бонус-малус стимулирует водителей быть внимательными, соблюдать правила дорожного движения. Некоторые страховые компании используют практику поощрения клиентов, применяя заработанную скидку за безаварийную езду по ОСАГО при определении тарифа по КАСКО. Таким образом, водитель получает двойное вознаграждение и еще большую материальную заинтересованность.
Что такое коэффициент бонус-малус (КБМ) в ОСАГО — Страховка Ру
Стоимость автогражданки рассчитывается по единой формуле во всех страховых компаниях: базовая ставка тарифа (в пределах коридора 2 746–4 942 ₽) умножается на 9 коэффициентов. Один из них – бонус-малус (КБМ), в народе его называют «коэффициент аварийности». Он нужен, чтобы поощрять рублем водителей за вождение без аварий и наказывать тех, кто был виноват в ДТП. Этот коэффициент влияет на цену страховки.
Один из них – бонус-малус (КБМ), в народе его называют «коэффициент аварийности». Он нужен, чтобы поощрять рублем водителей за вождение без аварий и наказывать тех, кто был виноват в ДТП. Этот коэффициент влияет на цену страховки.
Что такое КБМ в ОСАГО?
Нам часто задают вопрос: «Коэффициент КБМ в ОСАГО. Что это?» Если объяснять простыми словами, то этот параметр показывает, с какой периодичностью автомобилист попадает в ДТП. Чем реже это происходит по вине водителя, тем ниже его КБМ и дешевле страховка. И наоборот.
Виды КБМ
В страховке можно указать перечень лиц, которые могут сидеть за рулем, или оформить страховку без него – тогда за рулем сможет сидеть любой человек. Это влияет на размер КБМ по ОСАГО.
1. Если страховка закрытая (то есть на определённый список лиц):
Страхователь страхует гражданскую ответственность нескольких водителей, поэтому в полис вносят сведения о каждом из них: ФИО, серию и номер прав. КБМ высчитывают для всех персонально. А при определении цены полиса берут самый большой коэффициент, поэтому стоимость ОСАГО зависит от человека с худшим КБМ.
А при определении цены полиса берут самый большой коэффициент, поэтому стоимость ОСАГО зависит от человека с худшим КБМ.
2. Если перечень водителей не ограничен:
Если приобретать страховку ОСАГО на Страховка.Ру или в офисе страховой компании и не ограничивать список лиц, допущенных к управлению, то при определении цены КБМ водителей не учитывается.
Получается, что возьмут коэффициент, равный 1, но в этой ситуации появится еще один коэффициент за неограниченный перечень лиц – КО. Его размер для физлиц составляет 1,94, то есть надбавка будет равна 94%. Поэтому открытая страховка выгодна в финансовом плане, если у кого-то из водителей КБМ превышает 2.
Когда применяется КБМ
Коэффициент используют при определении цены страховки, если перечень водителей, которые допущены к вождению ТС, ограничен.
Как рассчитать КБМ для ОСАГО
Чтобы понять, как определяется размер КБМ ОСАГО, нужно помнить, что у каждого водителя, который оформляет страховой полис на Страховка.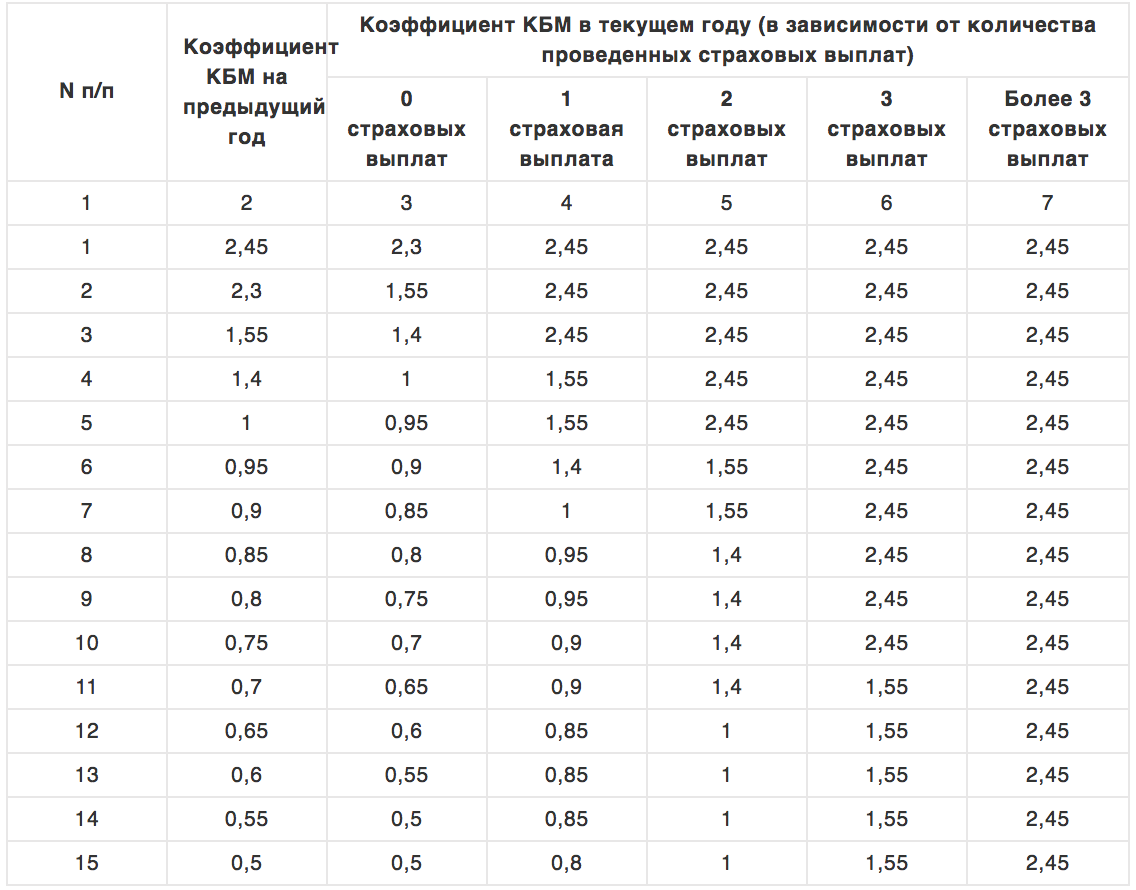 Ру, есть свой коэффициент и класс.
Ру, есть свой коэффициент и класс.
КБМ ОСАГО новичка (того, кто страхуется в первый раз) равен 1. Ему присваивают 3-й класс. Если за год по вине водителя не произошло ни одного ДТП, то коэффициент снижают до 0,95, а класс поднимают до 4-го. Если произошла хотя бы одна авария, то класс снижают до 1-го, а КБМ увеличивают до 1,55.
На нашем сайте есть удобная таблица, по которой можно узнать размер своего коэффициента.
Самый выгодный вариант – получить 13-й класс и снизить коэффициент до 0,5. В этом случае вы сможете купить страховку за полцены. Но для этого не нужно попадать в дорожно-транспортные происшествия на протяжении 10 лет.
КБМ напрямую влияет на цену по страховке. Когда он равен 1, то цена полиса полная. Если коэффициент снижается на 0,05, то цена уменьшается на 5%. Если КБМ вырастает на 0,5, цена ОСАГО подскакивает на 50%.
Обратите внимание, чтобы сохранить сниженный коэффициент, вы должны страховаться каждый год. Если сделаете перерыв, потому что продали машину и купили новую только через пару лет, КБМ обнуляется, точнее вновь возвращается к единице.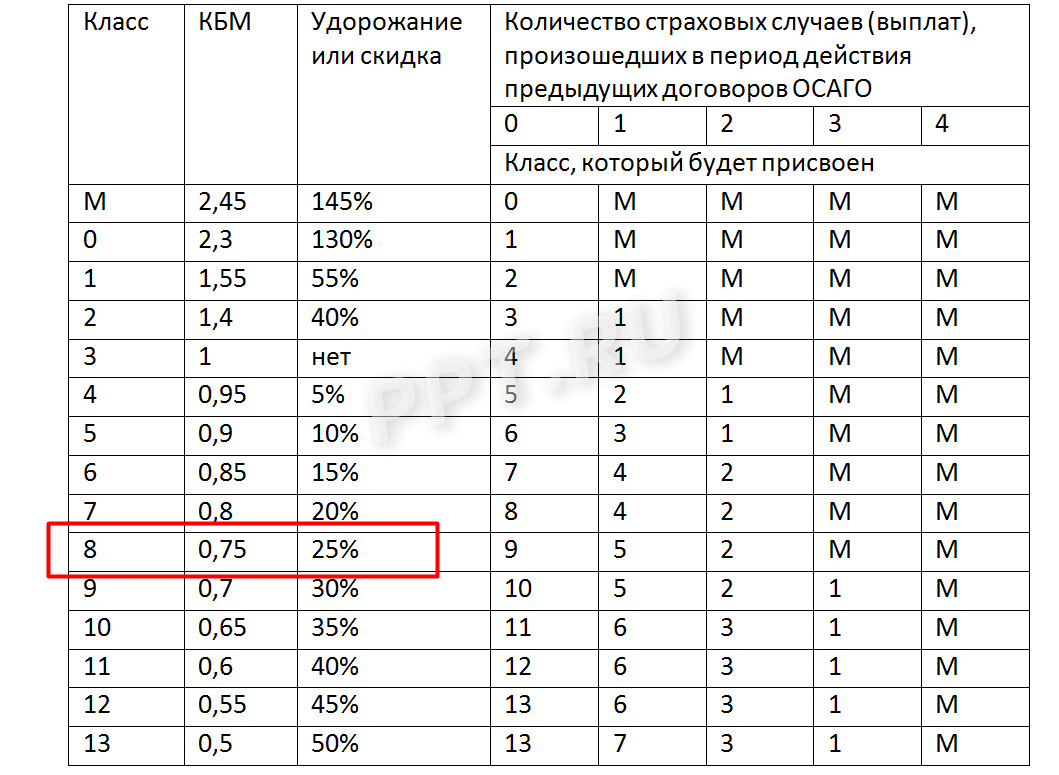
Итак, запомним:
КБМ – это единственный показатель, который может уменьшить стоимость страховки, который полностью зависит от вас — вы прямо на него влияете. Вот поэтому бонус-малус в народе называют «скидкой» на ОСАГО.
Как восстановить КБМ при замене прав или ошибке страховщика
При замене прав нужно посетить страховщика и внести изменения в полис. Если вы сделаете это, то проблем с коэффициентом при продлении страховки не возникнет. Если же вы забудете известить страховщика о замене прав, то для восстановления скидки нужно будет написать заявление в страховую.
Если КБМ изменил свое значение по ошибке страховой компании, нужно написать туда заявление с просьбой проверить коэффициент и при необходимости внести изменения в базу Российского союза автостраховщиков.
В заявлении нужно указать:
- Серию и номер действующих и (по возможности) предыдущих прав;
- Номер последнего полиса ОСАГО;
- Дату подписания договора страхования;
- Причину, которая, на ваш взгляд, повлияла на ошибочный расчет.

От чего зависит КБМ?
На коэффициент влияет число аварий, в которые попал водитель по своей вине.
Максимальный коэффициент КБМ
Он составляет 2,45. Надбавка в этой ситуации – 145%. Она присваивается, если по вине водителя произошло четыре аварии за год.
Таблица расчета коэффициента скидки (КБМ) 2021
КБМ ОСАГО таблица поможет вам узнать размер скидки или над бавки за страховку. Чтобы определить размер коэффициента, найдите в таблице свой класс вождения и число выплат.
Как проверить КБМ ОСАГО онлайн?
Если вы хотите оформить ОСАГО на Страховка.Ру, и у вас нет возможности разбираться в таблице, узнайте свой коэффициент на портале РСА.
- Перейдите по ссылке https://autoins.ru/osago/raschet-stoimosti-osago/proverit-kbm/ ;
- Поставьте галочку, согласившись на обработку персональных данных.

- Выберите сведения о страховке: дату подписания договора, собственника ТС и наличие ограничения числа лиц, допущенных к управлению;
- Введите данные автомобилиста: ФИО, дату рождения, серию и номер прав;
- Укажите дату начала действия договора;
- Подтвердите код безопасности и нажмите на кнопку «Поиск». В нижней части страницы будет указан КБМ водителя.
От чего зависит коэффициент скидки по ОСАГО
Три волшебные буквы
КБМ, то есть коэффициент Бонус-Малус, – это показатель, существенно влияющий на стоимость страховки. Его рассчитывают с помощью специальных таблиц, где указывается класс водителя, зависящий от непрерывного страхового стажа и количества аварий с его участием, по которым были получены выплаты от СК.
Базовая ставка ОСАГО с КБМ=1 применяется в таких случаях:
- ОСАГО оформляется впервые;
- прошло больше года с момента завершения действия предыдущего договора страхования;
- в базе данных по каким-либо причинам отсутствует информация о страхуемом.

Кнут и пряник
- В зависимости от страховой истории коэффициент скидки по ОСАГО может быть как понижающим, так и повышающим, его возможные значения составляют 0,5-2,45.
- Если по первому полису не было выплат в течение года, КБМ снижается до 0,95, это 5% скидки; каждый последующий год без происшествий прибавляет ней еще 5%.
- КБМ 0,5 дает право приобретать полис ОСАГО за полцены; это максимальный размер скидки за безаварийное вождение.
- Выше единицы он у водителей, имевших невысокий начальный класс и попавших в аварию; для них стоимость страхования на следующий год будет рассчитываться с надбавкой.
- Максимальная надбавка за убыточность для СК договоров с клиентом, часто попадающим в ДТП – 145%, она соответствует КБМ 2,45 и статусу М (присваивается всем водителям ниже 0 класса).
Как не потерять свой Бонус-Малус
Чтобы добиться максимального размера льгот, нужно не допускать наступления страховых случаев целых 10 лет, и дальше не расслабляться. Ведь единственная авария по вине водителя наивысшего, 13 класса, снижает его уровень до 7, дающего право всего лишь на 20% снижения стоимости. Возвращаться на прежний уровень придется 6 лет.
Ведь единственная авария по вине водителя наивысшего, 13 класса, снижает его уровень до 7, дающего право всего лишь на 20% снижения стоимости. Возвращаться на прежний уровень придется 6 лет.
Вдвойне обидно потерять с трудом добытые привилегии по собственной неосмотрительности или вследствие ошибки в базе данных. Поэтому важно помнить о таких моментах:
- при досрочном расторжении договора, хотя бы на день раньше предусмотренного срока, все достижения за год аннулируются;
- при перерыве в страховании больше года страховая история обнуляется;
- для договоров с ограничением количества допущенных к управлению лиц КБМ рассчитывается по худшему водителю, так что с добавлением в полис новичков нужно быть осторожнее;
- обо всех изменениях (смена водительского удостоверения, паспортных данных и прочих) следует незамедлительно уведомлять страховщика и проверять, внес ли он эти изменения в базу РСА;
- штрафные санкции страховщиками применяются, только если они делали выплаты в связи с ДТП.
 Если у вас хорошая история, взвесьте, что выгодней: испортить ее, обратившись за компенсацией, или решить вопрос с пострадавшей стороной без привлечения СК.
Если у вас хорошая история, взвесьте, что выгодней: испортить ее, обратившись за компенсацией, или решить вопрос с пострадавшей стороной без привлечения СК.
ОСАГО — Армеец
Страница изменена: 30.09.2021 15:27:08
Страховой полис «ОСАГО» — простое и надежное решение для каждого водителя
Страховой полис «ОСАГО» — максимально простой способ уберечься от расходов на возмещение ущерба при ДТП, в котором виноваты вы.
В отличие от КАСКО полис ОСАГО является обязательным для всех водителей. Объектом страхования является гражданская ответственность, то есть страховая компания покроет стоимость вреда, причиненного в результате ДТП по вашей вине. Стоимость полиса ОСАГО рассчитывается индивидуально и зависит от таких факторов как общий стаж вождения, территориальный коэффициент, мощность автомобиля, история безаварийного вождения, количество водителей, вписанные в страховой полис.
Также на нашем сайте вы можете оформить электронный полис ОСАГО онлайн.
Внимание! Страховое мошенничество!
АО СК «Армеец» выявлен факт страхового мошенничества, когда неизвестные лица, представляясь сотрудниками Компании, предлагают гражданам, осуществляющим посредническую деятельность по заключению договоров страхования, заключить агентские договоры и реализовывать электронные полисы ОСАГО. При этом, в целях убедительности, они ведут длительную переписку от имени Компании, а после подписания агентского договора, предоставляют Логин и Пароль к сфальсифицированному сайту (базе) АО СК «Армеец».
В случае поступления подозрительных предложений по сотрудничеству, либо выявления поддельных полисов ОСАГО (подлинность полиса можно проверить здесь), просим сообщать данные факты в Службу безопасности Компании по телефону 8 (843) 204-05-06 (вн. 1355).
ВНЕСЕНИЕ ИЗМЕНЕНИЙ И ДОСРОЧНОЕ ПРЕКРАЩЕНИЕ
Для внесения изменений в договор страхования, а так же для досрочного прекращения договора необходимо обратиться в ближайший офис АО СК «Армеец», либо направить оригинал заявления и копии документов, послужившие основанием для внесения изменений/досрочного прекращения договора, посредством почтовой связи по адресу: 420073, РТ, г. Казань, ул. Шуртыгина, д. 24.
Казань, ул. Шуртыгина, д. 24.
По электронной почте заявления на внесение изменений и досрочное прекращение договоров страхования не принимаются!
ВОЗВРАТ ДЕНЕЖНЫХ СРЕДСТВ
При ошибочном переводе денежных средств необходимо заполнить заявление (DOC, PDF) и выслать скан-копии заполненного заявления и паспорта (страницы с фотографией и пропиской) на адрес: [email protected]ВОССТАНОВЛЕНИЕ КБМ
Проверить свой КМБ можно тут.Если вы не согласны с примененным КБМ по действующему договору ОСАГО, либо при заключении нового договора, скачайте и заполните одно из заявлений на пересмотр КБМ и вышлите его на адрес [email protected]
Заявление на перерасчет КБМ и заявление на возврат денежных средств по одному водителю
Заявление на перерасчет КБМ и заявление на возврат денежных средств, если полис — без ограничения количества лиц
Телефон горячей линии
Вопросы и ответы по страховым условиям и продуктам компании Медэкспресс
Ниже приведены ответы на наиболее часто поступающие вопросы об оформлении электронных полисов ОСАГО:
1.
 Зависит ли стоимость полиса ОСАГО от способа его оформления?
Зависит ли стоимость полиса ОСАГО от способа его оформления?Стоимость полиса ОСАГО не зависит от способа его оформления и рассчитывается по единым тарифам и коэффициентам, утвержденным законодательно.
2.Представляется ли скидка за безаварийность при оформлении электронного полиса ОСАГО?
Для определения класса автоматически отправляется запрос в АИС РСА, и при расчете страховой премии используется значение КБМ, присвоенное АИС РСА.
3. Я не согласен с Кбм, устанавливающимся при расчете полиса. Что делать?
При несогласии с примененным Кбм, вы можете:
- Обратиться в страховую компанию, в которой у Вас оформлен действующий или закончившийся договор для проверки данных, отправленных в АИС РСА или
- После оформления полиса в САО «Медэкспресс», подать заявление о несогласии с примененным КБМ.
4. Что делать, если оформленный и оплаченный полис не пришел на электронную почту?
Отправьте запрос на электронную почту eosago@medexpress. ru с описанием проблемы. Наш специалист отправит документ повторно.
ru с описанием проблемы. Наш специалист отправит документ повторно.
Также Вы всегда можете распечатать полис из Личного кабинета.
5. Как подтвердить сотруднику ГИБДД, что у меня есть электронный полис?
Рекомендуем распечатать полученный электронный полис и иметь его в машине, когда Вы находитесь за рулем. Сотрудники ДПС осуществляют проверку наличия полисов ОСАГО у владельцев транспортных средств, заключивших договор ОСАГО в виде электронного документа, с использованием специального ресурса в сети ИМТС МВД России.
6. Куда обращаться при проблемах с оформлением электронного полиса ОСАГО?
По всем вопросам, связанным с заключением электронных договоров ОСАГО, пожалуйста, обращайтесь по электронной почте [email protected] или по телефону 8 800 200 33 03.
7. Почему у меня не меняется статус проекта?
Для обновления статуса нажмите кнопку «Обновить статус».
8. Как внести изменения в действующий электронный полис?
Для внесения изменений в договор ОСАГО, заключенный в виде электронного полиса, Вы можете:
- Обратиться с соответствующим заявлением в любой офис страховой компании САО «Медэкспресс»
Адреса офисов размещены на сайте www. medexpress.ru в разделе «Контакты»
medexpress.ru в разделе «Контакты» - Оформить самостоятельно дополнительно соглашение через Личный кабинет. Инструкция по оформлению электронного полиса ОСАГО (в том числе по внесению изменений) размещена на сайте www.medexpress.ru в разделе «Электронный полис»
9. Не проходит оплата. Что делать?
Если после нажатия кнопки «Оплатить» на экране появилась ссылка на модуль оплаты Сбербанка, и после нажатия на ссылку ничего не происходит, скопируйте эту ссылку и вставьте ее в новую вкладку браузера. Или зайдите в личный кабинет е-ОСАГО и произведите оплату из другого браузера или с другого компьютера.
Если эта ссылка не появляется или возникли другие проблемы при оплате, то необходимо зайти в личный кабинет е-ОСАГО и произвести оплату в другом браузера или с другого компьютера.
Что такое КБМ в ОСАГО: таблица 2020
КБМ в ОСАГО: что это такое и как его рассчитать? От чего зависит КБМ ОСАГО для водителя? Как рассчитывается КМБ по ОСАГО для физических лиц?
КБМ в ОСАГО
Государственная Дума еще в 2019 году приняла несколько поправок, повлиявших на ОСАГО. В результате изменился диапазон тарифов, после чего страховщики стали использовать индивидуализированные коэффициенты. Некоторые положения вступили в силу лишь в 2020 году, поэтому вопрос о том, как сейчас рассчитывается коэффициент КБМ в страховании, остается открытым.
В результате изменился диапазон тарифов, после чего страховщики стали использовать индивидуализированные коэффициенты. Некоторые положения вступили в силу лишь в 2020 году, поэтому вопрос о том, как сейчас рассчитывается коэффициент КБМ в страховании, остается открытым.
Осуществляя расчет стоимости ОСАГО, перейдя по ссылке inguru.ru/kalkulyator_osago/reg_rjazanskaja_oblast/ryazan, абсолютно все страховщики используют коэффициент бонус-малус. Он способен значительно изменять размер страховой премии с учетом персональной истории вождения страхователя.
Как рассчитывается КБМ по ОСАГО для физических лиц?
При определении коэффициента бонус-малус страховыми организациями используется специальная таблица, представленная на официальном сайте РСА. Также учитывается история страховых выплат, характеризующая поведение автолюбителя на дороге. Важным условием вычисления служит завершение срока действия предыдущего полиса. При этом договор страхования должен быть оформлен на весь год, так как на краткосрочные полисы этот коэффициент не распространяется.
Важно! Значение КБМ в страховом полисе ОСАГО указывается не всегда, так как нет закона, обязывающего страховщиков это делать. Но некоторые организации берут инициативу в свои руки и вписывают значение параметра в раздел «Особые отметки».
Чтобы посчитать КБМ самостоятельно, нужно изначально отталкиваться от класса, присвоенного автомобилисту. Если «автогражданка» оформляется впервые, страхователь получает 3 класс с КБМ равным единице. При наличии страховых выплат а отчетном периоде выбирается строка, соответствующая числу платежей за последний период страхования.
Чтобы стало более понятно, как коэффициент бонус-малус (КБМ) в ОСАГО рассчитывается по таблице в 2020 году с учетом класса водителя, рассмотрим пример: Ивантеев Алексей Николаевич со стажем вождения 7 лет за весь период эксплуатации авто не стал виновником аварии, приведшей к страховым выплатам. Для него отсчет был начат с 3 класса, но за каждый «чистый» год значение повышалось. В итоге Алексей Николаевич получил следующий результат — 10 класс с коэффициентом, равным 0,65. При следующем оформлении «автогражданки» он может рассчитывать на 35% скидку, так как за каждый безаварийный год стоимость полиса снижается на 5%.
При следующем оформлении «автогражданки» он может рассчитывать на 35% скидку, так как за каждый безаварийный год стоимость полиса снижается на 5%.
Если договор предполагает страхование без ограничений, коэффициент бонус-малус определяется для собственника транспортного средства. В случае с ограниченной страховкой агенты применяют максимальный множитель из всех указанных.
От чего зависит КБМ ОСАГО водителя?
Согласно расшифровке, КБМ в страховке ОСАГО — значение, устанавливаемое за вождение без аварий. Оно зависит от количества страховых возмещений, произведенных по вине водителя. Если страховщик не компенсирует убытки потерпевшей стороне в течение всего срока действия договора, значение бонус-малуса уменьшается на 0,05% в следующем периоде.
С августа 2020 года страховые компании начали учитывать не только историю вождения, но и иные обстоятельства, которые тоже влияют на итоговую цену ОСАГО. Многие из них давно используются при расчете стоимости КАСКО inguru. ru/kalkulyator_kasko, поэтому они не стали для автовладельцев чем-то новым. Речь идет о грубых нарушениях ПДД, наличии телематических устройств, установленных в машине, семейном положении страхователя и т.д. Однако ключевую роль всегда играет безаварийное вождение, которое и регулятор и страховщики готовы поощрять.
ru/kalkulyator_kasko, поэтому они не стали для автовладельцев чем-то новым. Речь идет о грубых нарушениях ПДД, наличии телематических устройств, установленных в машине, семейном положении страхователя и т.д. Однако ключевую роль всегда играет безаварийное вождение, которое и регулятор и страховщики готовы поощрять.
Коэффициент аварийности в ОСАГО будет теперь присваиваться водителям раз в год
МОСКВА, 1 апр — ПРАЙМ. Система расчета коэффициента бонус-малус (КБМ) при определении стоимости ОСАГО изменяется с 1 апреля: КБМ будет присваиваться каждому водителю раз в год, а если у него таких коэффициентов несколько, то браться в расчет будет самый низкий. Опрошенные РИА Новости страховщики уверены — водителям не стоит опасаться, что нововведения скажутся на цене полиса. Наоборот, новый подход поможет «навести порядок» и не допускать ошибок при расчете стоимости «автогражданки».
КБМ — один из коэффициентов, на который умножается базовая ставка ОСАГО, после чего и определяется итоговая стоимость полиса.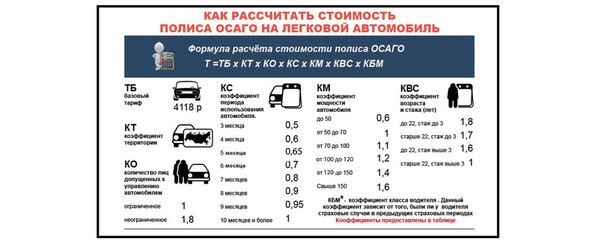 Бонус-малус зависит от истории аварийности водителя: если он часто был виновником ДТП, то коэффициент будет повышающим, если водил аккуратно — понижающим. Всего в КБМ существует 15 классов — чем хуже водит автолюбитель, тем ниже его класс. Для самого низкого из них КБМ будет равен 2,45, а для самого высокого — 0,5. Для новичков устанавливается нейтральное значение КБМ — единица.
Бонус-малус зависит от истории аварийности водителя: если он часто был виновником ДТП, то коэффициент будет повышающим, если водил аккуратно — понижающим. Всего в КБМ существует 15 классов — чем хуже водит автолюбитель, тем ниже его класс. Для самого низкого из них КБМ будет равен 2,45, а для самого высокого — 0,5. Для новичков устанавливается нейтральное значение КБМ — единица.
История вождения находится в базе данных АИС ОСАГО Российского союза автостраховщиков (РСА). Ранее КБМ рассчитывался в тот момент, когда автолюбитель приобретал новый полис. Теперь коэффициент будет рассчитываться и присваиваться раз в год — 1 апреля, вне зависимости от того, когда будет приобретен новый полис. Если у водителя действуют несколько договоров, в которых он фигурирует, по ним могут быть разные значения КБМ. Но с 1 апреля будет браться в расчет только одно из них — самое низкое.
КАК ЕЗДИШЬ, ТАК И ПЛАТИШЬ
После изменения в подходе к присвоению КБМ цена ОСАГО либо останется прежней, либо даже снизится, считают страховщики.
«Для водителей с несколькими историями аварийности будет выбран КБМ с минимальным на 31 марта 2019 года значением. Затем будет проверена статистика убытков за последние два года, не учтенных по базе АИС ОСАГО, и зафиксирован окончательный размер коэффициента бонус-малус, который и будет применяться при расчете стоимости полисов ОСАГО в следующие 12 месяцев. При такой схеме перехода на новый порядок определения КБМ мы ожидаем, что удорожания ОСАГО не произойдет», — пояснил начальник управления в СК «МАКС» Евгений Попков.
«Важное изменение — для юрлиц также будет высчитываться один КБМ. Так что ожидаем снижения количества жалоб по ОСАГО и упрощения при проведении конкурсов для юрлиц», — добавил директор дирекции «Ингосстраха» Виталий Княгиничев. По его словам, средняя стоимость ОСАГО после нововведений скорее снизится, чем наоборот.
К такому же мнению пришел руководитель управления в «Альфастраховании» Денис Макаров. «Новый порядок расчета КБМ приведет к снижению среднего размера премии по ОСАГО, поэтому автомобилистам нечего опасаться», — сказал он.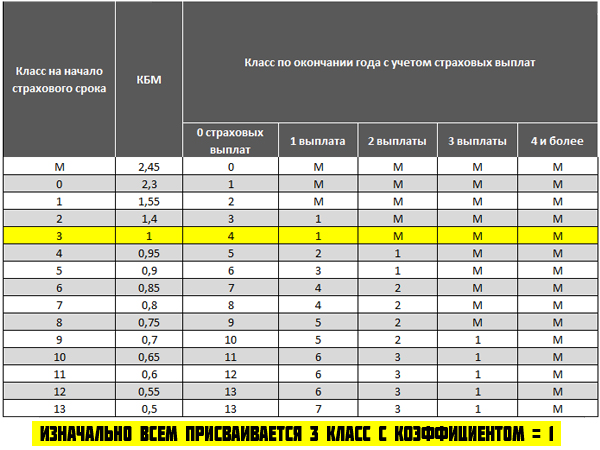
Юрист и автоэксперт Сергей Смирнов уверен, что реформа КБМ — это еще один шаг к персональному тарифу, благодаря ей начнет работать принцип: «как ездишь, так и платишь».
«Для страховых компаний такая система также выгодна. Будет проще делать расчеты стоимости полиса, а в дальнейшем предоставлять и персональные условия для аккуратных водителей. Очевидно, что аккуратные водители будут платить меньше», — пояснил он.
РЕФОРМА «ЕДИНОГО АГЕНТА» И «Е-ГАРАНТА»
Сразу после — 2 апреля — обновится и система гарантирования РСА: бумажный «Единый агент» и электронный «е-Гарант». Система «е-Гарант» была запущена в 2017 году для обеспечения бесперебойного заключения электронных договоров ОСАГО с использованием площадки РСА. «Единый агент» заработал немного раньше — в 2016 году, он был направлен на улучшение ситуации с доступностью ОСАГО в некоторых регионах. Страховщики, имеющие там филиалы, осуществляют продажи бумажных полисов ОСАГО в качестве агентов от имени всех остальных страховщиков — членов РСА.
Ранее система гарантирования предлагала страхователю только одного страховщика, исходя из номера ПТС. С апреля клиенту будет предлагаться список страховых компаний, у которых он сможет приобрести полис. При этом доля каждого страховщика в этой системе будет определятся его рыночной долей.
Как рассказали агентству в РСА, союз ожидает, что новшество повысит удовлетворенность автовладельцев, которые пользуются системами. При этом и эти изменения не повлекут роста цен на ОСАГО, уверены в РСА. Эту точку зрения поддерживает и Макаров.
«Изменения в порядке распределения бизнеса («е-Гарант» и «Единый агент») касаются внутренних процессов страховщиков и не повлияют на доступность услуги. На стоимость ОСАГО оказывают влияние только экономика и конкуренция на рынке. В условиях конкуренции за клиента качество услуг и цены становятся более привлекательными», — пояснил он.
Смирнов видит в обновлении систем очевидный плюс для водителей, поскольку им перестанут навязывать определенную страховую компанию. «Теперь любой автовладелец через сеть интернет будет выбирать определенного страховщика из предоставленного списка, а значит, мы сможем заключать договоры с той компанией, которая нам нравится», — отметил он.
«Теперь любой автовладелец через сеть интернет будет выбирать определенного страховщика из предоставленного списка, а значит, мы сможем заключать договоры с той компанией, которая нам нравится», — отметил он.
В то же время в «Ингосстрахе» уверены — изменения отрицательно скажутся на крупных игроках рынка, а также могут повлиять на цену полиса в «токсичных» регионах, но со временем и в пределах коридора. «Раньше крупные игроки легко закрывали квоту за счет собственного объема продаж. Теперь же именно на лидеров рынка вывалится основной поток, мелкие компании квоту выбирать не будут. Вырастет концентрация, а также ухудшится финансовый результат у крупных игроков», — считает Княгиничев.
Как узнать свой CBM на ОСАГО в базе данных СПС? что такое куб.м. Единая база ОСАГО (проверить политику)
Проверка КБМ ОСАГО онлайн На сайте Союза автостраховщиков вы можете проверить КБМ (соотношение бонуса и малуса). Проверяйте свои коэффициенты только на официальных сайтах, так как они дают наиболее точную информацию.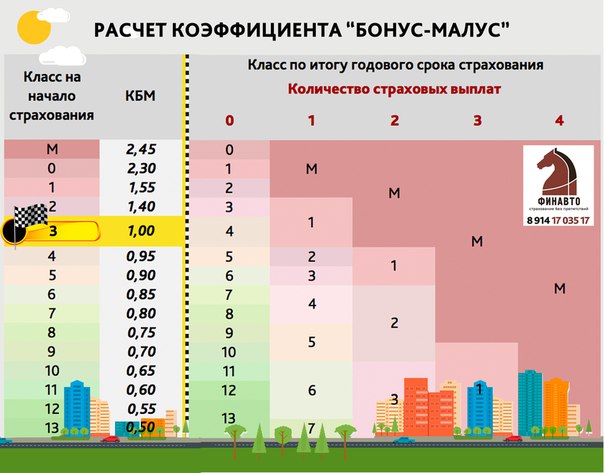 В частности, эта проверка расскажет вам, откуда взялось это значение KBM — какая страховая компания и по какому номеру полиса посчитала такое значение (номер полиса, в свою очередь, можно проверить).
В частности, эта проверка расскажет вам, откуда взялось это значение KBM — какая страховая компания и по какому номеру полиса посчитала такое значение (номер полиса, в свою очередь, можно проверить).
ВНИМАНИЕ !!! Бывает, долго загружаются окна KBM проверяет это из-за перегруженности баз на стороне PCA, просто подожди немного. Или, чтобы не ждать, сразу переходите по ссылке на официальный сайт СПС
Инструкция как проверить КБМ?
Чтобы проверить KBM, вам необходимо ввести некоторые данные в специальное окно базы данных PCA. Первое, что вам нужно будет указать, это кого вы хотите проверить КБМ, физическое или юридическое лицо.Затем вас попросят выбрать, ограничивается ли договор количеством водителей, которым разрешено управлять транспортным средством. Внимание! Проверка КБМ возможна только для граждан, зарегистрированных на территории РФ. Затем вы вводите свое стандартное имя, дату рождения, серийный номер и номер водительского удостоверения. А теперь важный момент: «Дата начала действия договора / добавления драйвера в договор» здесь нужно указать дату NEXT после окончания полиса.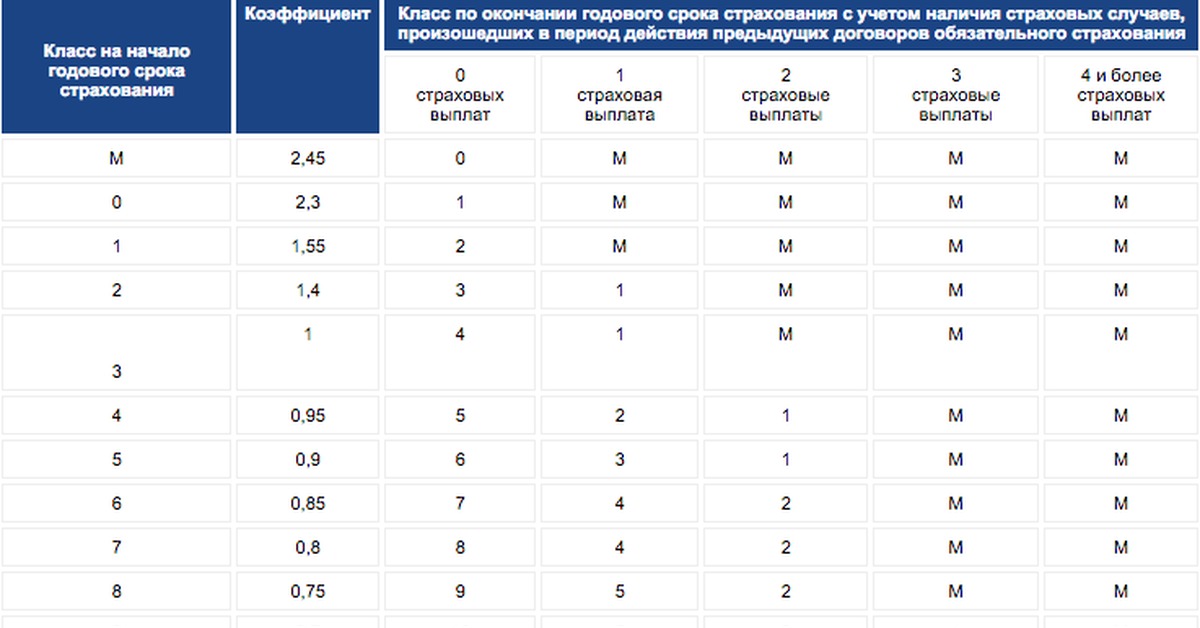 Вот и все, мы проходим простую проверку, нажав на кнопку «Я не робот», и вам будет показан результат в базе данных PCA вашей скидки KBM. Если вам не понравились результаты проверки или скидка исчезла по необъяснимой причине, можете.
Вот и все, мы проходим простую проверку, нажав на кнопку «Я не робот», и вам будет показан результат в базе данных PCA вашей скидки KBM. Если вам не понравились результаты проверки или скидка исчезла по необъяснимой причине, можете.
ВНИМАНИЕ! ЕСЛИ ВЫ НЕ ПОЛНОСТЬЮ ОТКРЫВАЕТЕ ОКНО ВХОДА ДАННЫХ ДЛЯ ПРОВЕРКИ MSC, ВЫ ПРОСТО НАЖМИТЕ СЛАЙДЕРЫ, КАК УКАЗАНО НА ИЗОБРАЖЕНИИ НИЖЕ, БУДЕТ КНОПКА ПОИСКА И ПОДТВЕРЖДЕНИЯ КОДА БЕЗОПАСНОСТИ.
Возможности проверки КБМ
- Проверить KBM Phys. и Юр. человек
- Экзамен КБМ ОСАГО сразу нескольким водителям
КБМ ОСАГО
На нашем портале проверка КБМ в базе PCA всегда останется бесплатной. Чтобы узнать КБМ ОСАГО достаточно указать ФИО, дату рождения, серию и номер в.г. Проверка MSC не займет много времени. На это стоит обратить большое внимание, так как вы можете предотвратить обман вас недобросовестными страховщиками.Проверить КБМ, а потом распечатать всю необходимую информацию можно при покупке ОСАГО
.
Проверить KBM в базе данных PCA
Проверка КБМ ОСАГО занимает не более 20 секунд. Данные отправляются напрямую в базы Союза автостраховщиков России в указанный день. Это важно, потому что, во-первых, при регистрации нового полиса в страховании КБМ будет смотреть на дату начала действия нового полиса, т.е. она изменяется на следующий день после окончания действия текущего полиса.Во-вторых, если вы вписаны в какое-то количество полисов ОСАГО, то при оформлении новой страховки смотрят коэффициент в соответствии с последним истекшим полисом. Из-за этого в разные дни имеет возможность существовать разные значения, имейте это в виду.
Каким должен быть коэффициент бонуса malus?
Информация в базе данных PCA иногда может быть неверной, то есть коэффициент MSC (также известный как «скидка») может быть больше, чем вы имеете право. Чаще всего это происходит, когда ваша предыдущая страховая компания ввела неправильные килобайты в базу данных при оформлении последнего полиса. Вы можете проверить свой KBM в таблице выше
Вы можете проверить свой KBM в таблице выше
Как еще можно узнать свой КБМ?
Также вы можете узнать свой ОСАГО на официальных сайтах страховщиков, у которых есть возможность оформить электронный полис ОСАГО. Для этого вам необходимо зарегистрироваться на сайте одного из них и при оформлении полиса можно узнать ваш MSC, но он не всегда может быть указан правильно, так как вы могли ввести человека с самый высокий MSC в вашей страховке и считается экстремальным страхованием по высокой ставке… В этом случае вам нужно будет обратиться в свою страховую компанию для восстановления вашего KBM.
Сегодня база страховщиков позволяет проверять ОСАГО разными способами: по номеру полиса, по номеру автомобиля и т.д. И наоборот — по номеру страховки, например, узнать номер автомобиля. Всего существует три варианта тестирования:
Внимание, последние недели формы проверки работают ой-ой-очень медленно, не с первого раза загружаются. Это проблема на стороне PCA. При желании можно попробовать загрузить на их сайте формы проверки отдельно: раз, два, три соответственно.
При желании можно попробовать загрузить на их сайте формы проверки отдельно: раз, два, три соответственно.
1. Проверка статуса формы по ее номеру. Проверьте бумажный или электронный полис ОСАГО по базе АИС РСА (Российский союз автостраховщиков), и срок его действия вы можете узнать ниже.
Эта форма предназначена для проверки как бумажных, так и электронных полисов серии XXX, приобретенных через Интернет! Обычно электронная страховка попадает в базу данных сразу после регистрации, но иногда из-за загруженности базы данных это может занять несколько дней.Правильный статус для действующей страховки — «у страховщика» (но если сразу после покупки статус по-прежнему «у страховщика», то это может быть нормально — агент может не успеть внести изменения в базу данных, подождите пару дней и только потом бить тревогу) … Однозначно «плохие статусы» политики ОСАГО «просрочены» (почему именно она стала недействительной, подробнее вы можете увидеть на чеке ниже) или «потеряна». Статус «напечатан производителем» означает, что такая форма даже не передавалась страховщику.
Статус «напечатан производителем» означает, что такая форма даже не передавалась страховщику.
Такая проверка не дает стопроцентной уверенности в том, что у вас действует политика (в конце концов, мошенники могли сделать «дубликат» этой формы), но она позволяет вам отклонить явные подделки и украденные формы. Но чтобы исключить «дубликаты», нужно проверить, какая машина застрахована по вашему полису …
2. Узнайте, какой автомобиль застрахован по определенной форме. Помимо государственного номера, VIN-кода или номера тела, в результатах вы можете узнать более подробный статус формы, например, почему страховка недействительна (они могли досрочно расторгнуть договор или страховой полис мог быть утерян):
3.Узнать номер полиса ОСАГО по гос номеру, VIN или номеру кузова + проверить, включен ли водитель в страховку … Эта проверка противоположная предыдущей, здесь по данным автомобиля, Вы узнаете, в какой страховой компании он застрахован, номер полиса и его тип (ограниченный или неограниченный). Проверка VIN является наиболее полной. Поиск по гос номеру осуществляется только в том случае, если эта информация была предоставлена страховщиком (они это делают не всегда).
Проверка VIN является наиболее полной. Поиск по гос номеру осуществляется только в том случае, если эта информация была предоставлена страховщиком (они это делают не всегда).
Если в страховке есть ограниченный список водителей, система предложит проверить по номеру и серии водительских прав, включен ли конкретный водитель в страховку (эта опция появляется на втором шаге после).
Если вы недавно кого-то вписали в свой полис ОСАГО или внесли другие изменения в данные, то по стандартам страховые компании обязаны внести изменения в базу данных СПС в течение 5 дней. Поэтому не пугайтесь, если по прошествии пары дней изменения еще не отобразились в базе данных AIS RSA.
Последняя проверка также полезна для проверки подержанной машины перед покупкой. Ведь наличие двух одновременно действующих полисов ОСАГО на один VIN-номер (или номерной знак) может быть «звонком», что автомобиль является «двойным».В этом случае тоже рекомендую (в данном случае это плохой знак, что машина регулярно проходит ТО в одном регионе, потом в другом).
4. Помощь автомобильного юриста по вопросам ОСАГО:
Если вы столкнулись с тем, что ваш полис поддельный, судя по базе данных, или у вас есть другие юридические вопросы, связанные с ОСАГО, то вы можете получить бесплатного адвоката. ответьте в форме ниже.
Опытные водители прекрасно понимают, что сумма, которую они должны заплатить за полис ОСАГО, зависит от их опыта и беспроблемного вождения… Цена на полис рассчитана с учетом Разберемся, как узнать свой MSC по ОСАГО.
Что такое KBM
Коэффициент служит для поощрения водителей, которые соблюдают правила и ездят без аварий. Они получают скидки при оформлении полиса. За каждый год безаварийной езды уменьшается водительский коэффициент, за счет чего платить за полис приходится меньше.
Раньше она закреплялась за конкретным автомобилем, и при продаже скидка пропадала.Однако в 2008 году были приняты изменения, согласно которым КБМ принадлежит самому водителю вне зависимости от того, на каком транспортном средстве он управляет. Скидка сохраняется, даже если водитель решит обслуживаться в другой страховой компании.
Скидка сохраняется, даже если водитель решит обслуживаться в другой страховой компании.
Однако она уменьшается или полностью исчезает и даже уходит в отрицательную зону, если после аварии водитель подает заявку на выплату. Размер скидки зависит от класса, присвоенного водителю до аварии.
Часто удобнее и выгоднее урегулировать мелкую аварию прямо на месте, не вызывая сотрудников ГАИ.Тогда, конечно, стоимость полиса для виновника ДТП не увеличится.
Как узнать свой MSC по ОСАГО
Если водитель хочет знать, какой у него MSC и как он меняется, нужно воспользоваться специальной таблицей. В общем, в первый год ему присваивается третий класс, равный отряду МСК.
Если в течение этого года не произошло ДТП, в котором он был виновником, то в следующем году он получит четвертую оценку, и MSC снизится на 5%.Но если ДТП все же произойдет, то класс будет уже вторым, а MSC увеличится до 1,4, то есть стоимость полиса увеличится на 40%.
При безаварийном вождении скидка 5% будет применяться каждый год, пока она не достигнет 50%.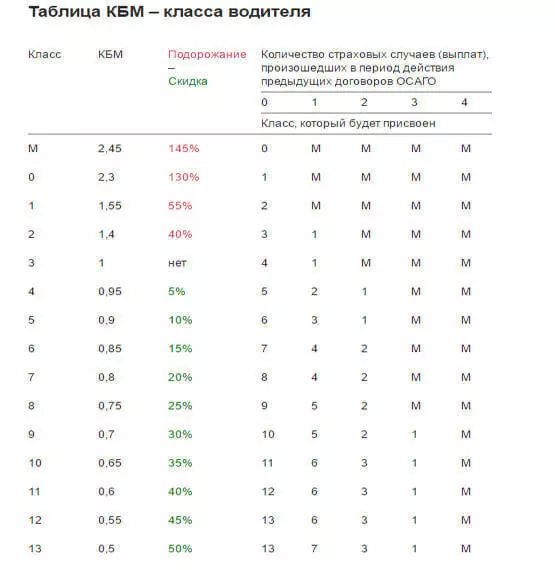
Таблица ОСАГО
Коэффициент легко определяется с помощью этой специальной таблицы, которая одинакова для всех ИС. Для этого достаточно знать класс драйвера.
Возьмем для примера третий класс.По нему в следующем столбце мы видим единицу. Это КБМ. В следующем году водитель получает четвертый класс, что соответствует коэффициенту 0,95. Вот как это выглядит дальше. В других столбцах показано, какой класс будет впоследствии присвоен в случае аварии.
Самостоятельный расчет
Еще один способ узнать свою ОСАГО по ОСАГО — это самостоятельный расчет. Рассмотрим пример с тем же водителем, который первым сел за руль. Если он три года не попадает в аварию, то на четвертый год вождения ему скидка составит 15%.Однако в случае аварии, виновником которой он становится, его класс уже не будет 7-м, что соответствует скидке 15%, а только четвертым.
Если таблица есть под рукой, то ее легко увидеть. Но и без него тоже можно рассчитать MSC.
КБМ со страховкой с несколькими водителями
Как узнать свой КБМ по ОСАГО, если на автомобиле допущено несколько человек? Все очень просто. Применяется коэффициент, имеющий наивысшее значение из всех.Например, у одного водителя MSC — 35%, а у другого — всего 15%. Тогда стоимость будет рассчитана исходя из скидки 15%.
Применяется коэффициент, имеющий наивысшее значение из всех.Например, у одного водителя MSC — 35%, а у другого — всего 15%. Тогда стоимость будет рассчитана исходя из скидки 15%.
Если один из водителей попал в аварию, виновником которой стал, а другой год проехал без аварии, то MSC повысит только водитель, виновный в аварии. Другой получит причитающуюся ему 5-процентную скидку.
Как узнать свою ОСАГО на основе базы данных PCA
PCA, или Российский союз автостраховщиков, — это организация-сообщество страховщиков.Союз помогает автовладельцам по многим вопросам. Важная роль отводится также информированию водителей. Итак, на официальном сайте много информации, представляющей практический интерес и пользу.
RSA поддерживает единую базу MSC. Выйдя на нее, вы легко узнаете свою ОСАГО по ОСАГО в СПС.
Данная информация доступна как юридическим, так и физическим лицам … Для физических лиц достаточно ввести свои водительские права. А если ОСАГО оформляется без ограничения списка водителей, то также потребуется паспорт автовладельца и ПТС.
То же самое и с КБМ. Юридическим лицам несложно сверить ОСАГО по базе данных СПС. Для этого достаточно ввести ИНН компании и Необходимые документы на автомобиль.
Можно ли исправить данные в базе данных PCA для KBM?
Допустим, можно было проверить базу ОСАГО по ОСАГО в базе данных СПС. Но здесь может выявиться другая проблема.Бывает, что на сайте система выдает такой коэффициент, не соответствующий действительности. Например, страхователь получает MSC, равный единице, в то время как он много лет управлял своей машиной без происшествий.
Причины, по которым это происходит, могут быть следующими.
По возможности данные не исправлялись, а оставались те, что были в старом документе. Для корректного отображения информации следует написать запрос в PCA с вложениями копий новой и старой идентификационной информации.Бывает, что при вводе данных допущена ошибка.
Это также можно найти, когда имя драйвера отображается сразу в нескольких политиках. Например, Иванов, который учится в 11-м классе и водит собственную машину, также может управлять автомобилем своей жены. А у последнего коэффициент всего 0,95, что соответствует 4-му классу. Таким образом, при передаче данных его коэффициент будет отображаться как 0,95.
Например, Иванов, который учится в 11-м классе и водит собственную машину, также может управлять автомобилем своей жены. А у последнего коэффициент всего 0,95, что соответствует 4-му классу. Таким образом, при передаче данных его коэффициент будет отображаться как 0,95.
И еще одна причина, по которой драйверы КБМ согласно базе AIS RSA для ОСАГО могут не появиться в базе — это банкротство ИС.
Как сэкономить на скидке
Итак, мы узнали, как узнать свой ОСАГО по ОСАГО на сайте СПС. Предположим, что ваши собственные расчеты не совпадают с цифрами на сайте. Как быть в этом случае?
В PCA вы должны написать заявление о том, что реальное значение коэффициента отличается от указанного на веб-сайте, и обосновать эту информацию. К претензии прилагаются копии страховых полисов и справка из Великобритании, подтверждающая, что поездка в течение определенного количества лет была безаварийной.
В случае ошибки политику, действие которой закончилось, не нужно отбрасывать. Ведь там отображается информация, соответствующая действительности. Нет смысла что-либо доказывать или звонить по телефону. Лучше сразу обратиться в головной офис компании, написав соответствующую жалобу. При подаче жалобы сохраните квитанцию в качестве доказательства оплаты.
Ведь там отображается информация, соответствующая действительности. Нет смысла что-либо доказывать или звонить по телефону. Лучше сразу обратиться в головной офис компании, написав соответствующую жалобу. При подаче жалобы сохраните квитанцию в качестве доказательства оплаты.
А если вы решили отнести заявку в компанию лично, то сделайте ее в двух экземплярах, чтобы на одном из них была пометка о принятии.
Если в течение двух недель ни документы, ни возмещение не были произведены, вы можете смело обращаться в вышеназванный орган и добиваться справедливости.
Итак, вопрос «как узнать свою ОСАГО по ОСАГО в ЮАР?» важно не только из простого любопытства, но и для того, чтобы быть уверенным, что расчет следующего полиса будет правильным.
Согласно действующему законодательству, каждый владелец автомобиля обязан оформить страховой полис ОСАГО. Тарифы страховых компаний утверждаются государством и не могут быть изменены страховщиками самостоятельно.
При расчете стоимости страховки учитывается большое количество факторов: регион проживания владельца, технические характеристики автомобиля, возраст и стаж водителей и так далее. Для снижения стоимости полиса был введен коэффициент бонус-малус (BMC).
Для снижения стоимости полиса был введен коэффициент бонус-малус (BMC).
Что это такое
Другими словами, это можно определить как скидку, предоставленную водителю за безаварийную езду в предыдущем страховом периоде.
Рассматриваемый параметр введен в действие в 2003 году, а активно используется страховщиками только с 2013 года.
Большинство страховых компаний используют такие термины, как:
- КМБ водителя, то есть коэффициент, присвоенный конкретному водителю;
- КМБ собственник. Такой коэффициент присваивается не конкретному водителю, а владельцу транспортного средства. В основном используется для расчета стоимости ОСАГО для транспортных средств юридических лиц;
- Расчетный КМБ — коэффициент, используемый для окончательного расчета стоимости автострахования.
Параметр может как увеличить, так и уменьшить стоимость автострахования. Минимальное значение коэффициента — 0,5, максимальное — 2,45.
Использование КБМ обусловлено несколькими факторами:
- Прежде всего, это учет индивидуальных особенностей водителя.
 Чем больше у человека опыта безаварийной эксплуатации транспортного средства, тем большую скидку предоставляет страховая компания;
Чем больше у человека опыта безаварийной эксплуатации транспортного средства, тем большую скидку предоставляет страховая компания; - снижение стоимости полиса повышает заинтересованность каждого водителя в аккуратной езде по бездорожью;
- уменьшение количества обращений водителей по страховым выплатам.Другими словами, лучше заплатить за мелкий ремонт самостоятельно, чем испортить параметр, влияющий на размер автостраховки.
MSC учет ведется Российским союзом автостраховщиков в единой базе данных (АИС РСА). Любая страховая компания обязана своевременно предоставлять информацию в базу данных о застрахованных водителях.
Неправильный ввод данных или полное игнорирование требований законодательства наказывается органами государственного надзора вплоть до отзыва лицензии на занятие определенным видом страховой деятельности.
Bonus malus не учитывается в следующих случаях:
- ОСАГО выпускается на прицепе;
- Автомобиль зарегистрирован на территории другого государства.
 При эксплуатации автотранспорта на территории РФ оформляется временная регистрация и временный полис, но КМБ не влияет на стоимость страховки; Страхование
При эксплуатации автотранспорта на территории РФ оформляется временная регистрация и временный полис, но КМБ не влияет на стоимость страховки; Страхование - оформляется на время проезда автотранспорта к месту прописки. Например, автомобиль был приобретен в одном регионе РФ, а регистрация автомобиля планируется в регионе по постоянному месту жительства.
Без ОСАГО управлять автомобилем невозможно. На время, необходимое для управления автомобилем, оформляется страховой полис с коротким сроком действия, но без учета коэффициента бонус-малус.
Определение коэффициента полезно не только страховщикам, но и непосредственно водителям, так как поможет самостоятельно рассчитать стоимость ОСАГО и не быть обманутым недобросовестными страховыми организациями.
Для чего и от чего зависит
КБМ, как было сказано ранее, используется для расчета стоимости страхового полиса ОСАГО.Чем больше у водителя опыта вождения без участия в дорожно-транспортных происшествиях, тем меньше применяется параметр.
Например, при первом получении прав КБМ = 1, а класс водителя 3. Через 1 год при отсутствии аварий коэффициент уменьшается на 5%, то есть становится равным 0,95. , а класс водителя увеличивается до 4.
Через 2 года правильной эксплуатации автомобиля КБМ = 0,9 и тд. Минимально возможное значение коэффициента — 0.5.
Если застрахованным автомобилем разрешено управлять несколькими водителями, то для расчета стоимости полиса используется меньший MSC.
Например, первый драйвер имеет коэффициент бонус-малус 0,90, а второй драйвер — 0,75. При расчете ОСАГО будет учтена так называемая расчетная MCC, которая в данном случае составляет 0,90.
Раньше коэффициент был привязан к застрахованному автомобилю, что вызывало массу негативных отзывов, так как при продаже автомобиля КБМ обнулялся.
В настоящее время параметр закреплен за конкретным водителем, то есть при смене автомобиля коэффициент продолжает работать на заранее определенном уровне.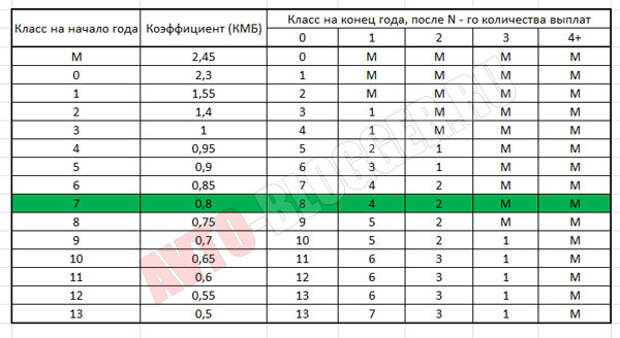
То же правило применяется при смене страховой компании. При замене страховщика размер бонуса должен оставаться неизменным.
Где посмотреть
Как самостоятельно узнать скидку по ОСАГО? Для этого нужно отправить запрос в единую базу PCA или рассчитать коэффициент самостоятельно, используя таблицу.
Например, у водителя в начале страхового полиса 3 класс и КБМ = 1. В течение года человек не попадает в ДТП, поэтому по окончании периода страхования ему присваивается 4 класс. и MSC станет равным 0,95 (именно эти данные будут учтены при продлении автострахования).
В течение следующего года водитель становится виновником 2 ДТП и дважды обращается за страховой выплатой. По истечении срока действия страхового полиса лицу присваивается класс 2 и бонус-малус увеличивается до 1.4.
Если автострахование оформлено с условием допуска к управлению неограниченным количеством людей (как правило, такое страхование требуется для юридического лица, находящегося в собственности транспортного средства), то указанная таблица также может быть использована для определения бонуса — коэффициент малуса.
Однако в этой ситуации КМБ назначается не конкретному водителю, а самому транспортному средству.
Бывают ситуации, когда предыдущая страховка оформлялась на неограниченное количество водителей и КМБ владельца принималась к расчету, а следующая ОСАГО приобреталась на определенное количество водителей.
В этой ситуации КМБ владельца приравнивается к КМБ драйвера, то есть при расчете нового значения полиса будет учитываться коэффициент, принадлежащий владельцу.
Экзамен
Приведенная выше таблица универсальна для всех случаев, однако, если человек длительное время пользуется автомобилем, то расчеты могут затянуться. Не исключены ошибки.
Для проверки коэффициента бонус-малус в PCA потребуются следующие данные:
- ФИО водителя;
- дата рождения проверяемого;
- дата, на которую вы хотите проверить.Например, действие ОСАГО заканчивается 02.12.2015, следовательно, необходимо узнать бонус-малус на 03.
 12.2015, то есть в начале следующей политики;
12.2015, то есть в начале следующей политики; - серия и номер водительского удостоверения проверяемого лица. Эта информация является обязательной, так как людей с одинаковыми инициалами и датой рождения может быть несколько, а документ даст возможность указать личность гражданина.
На некоторых сайтах помимо данных водительских прав необходимо вводить серию и номер действующего страхового полиса.Эта информация также необходима для повышения надежности предоставляемой информации.
Как проверить права ОСАГО на ОСАГО
Стандартная форма запроса в СПС выглядит следующим образом:
Обработка онлайн-запроса занимает не более 1 минуты (обычно 15–20 секунд).
В результате проверки вы можете получить следующие сообщения:
- коэффициент не найден. Водителю присвоен класс 3 и КБМ = 1.При получении такого сообщения рекомендуется внимательно проверить введенные данные. Велика вероятность, что при наборе текста произошла ошибка (опечатка).
 После проверки и исправления запрос может быть отправлен повторно;
После проверки и исправления запрос может быть отправлен повторно;
По политике
Если при проверке дополнительно ввести реквизиты страхового полиса, то помимо коэффициента MSC можно узнать срок действия документа и другие важные факторы.
Результат проверки будет представлен в двух таблицах:
Это сообщение означает, что:
- водитель Андрей Александрович (фамилия скрыта в целях конфиденциальности) по состоянию на 20.09.2015 имеет 13 класс;
- КБМ = 0.55;
- действующий полис ОСАГО (серия и номер документа) приобретен у Уралсиба;
- срок действия страхового полиса 17.08.2015;
- отсутствие страховых убытков на момент осмотра.
Часто возникают ситуации, когда коэффициент, определяемый автоматической базой, не соответствует действительности.
В этом случае необходимо выполнить следующие действия:
- направить в региональное отделение PCA письменную жалобу с приложением копий страховых полисов за предыдущие периоды;
- дождаться ответа, в котором подробно будет указана законность указанного коэффициента или информация об ошибке;
- если ошибка действительно обнаружена, то СПС самостоятельно устранит недостаток в работе страховой компании;
- перевыпуск ОСАГО по новому тарифу.
 Если есть письменный ответ от союза автостраховщиков и исправлена ошибка в базе данных, проблем с переоформлением автостраховки нет.
Если есть письменный ответ от союза автостраховщиков и исправлена ошибка в базе данных, проблем с переоформлением автостраховки нет.
Как посмотреть коэффициент для юридических лиц
Проверка коэффициента бонус-малус требуется не только физическим лицам, но и организациям. Для онлайн-исследований целесообразнее использовать сайт PCA.
Чтобы получить данные о шансах, вам необходимо ввести следующую информацию:
- ИНН организации, владеющей транспортным средством;
- VIN номер автомобиля; Номерной знак
- , выдаваемый при регистрации;
- дата начала действия договора страхования.
Результаты запроса будут аналогичны результатам проверки для физических лиц.
Коэффициент «бонус-малус» позволяет водителям и автовладельцам получить значительную скидку при оформлении полиса обязательного страхования.
При этом страховые компании могут вести точную статистику страховых случаев и обращений граждан. Использование коэффициента в системе расчетов контролируется государственными органами.
Использование коэффициента в системе расчетов контролируется государственными органами.
Если страховщик не использует КМБ при определении стоимости страхового полиса, то компания может быть лишена лицензии на страховую деятельность в сфере обязательного страхования, что отрицательно скажется на прибыльности организации.
Видео: ОСАГО. Проверка КБМ. Расчет скидки за безубыточную езду.
Узнайте, во сколько вам обойдется электронный полис ОСАГО и в каких страховых компаниях вы можете его приобрести в вашем регионе:
Коэффициент «Бонус — Малус», называемый MSC, является важным элементом формирования стоимости ОСАГО, позволяя автовладельцам претендовать на серьезную скидку или, наоборот, получать повышенную стоимость полиса.Этот коэффициент обновляется ежегодно, и при отсутствии аварий за отчетный период увеличивает размер скидки на следующий год.
2 клика и вы узнаете
Проверка KBM онлайн:
Таблица MSC на 2019 год
На период до конца 2019 года в России действует шкала (таблица MSC), которая предусматривает варьирование этого коэффициента в пределах от 0,5 до 2,45 для стойких правонарушителей, которые несколько раз в год становились виновниками ДТП. Вы можете ознакомиться с данными в таблице в таблице ниже.
Вы можете ознакомиться с данными в таблице в таблице ниже.
Система MSC предусматривает, что изначально при первом страховании клиент страховой компании получает базовый уровень третьего класса, при котором коэффициент равен 1. Соответствующая информация заносится в базу данных PCA. По истечении срока действия полиса класс водителя меняется в ту или иную сторону. При отсутствии аварий коэффициент становится 0,95. Если ДТП были, то коэффициент увеличивается в зависимости от количества совершенных ДТП с одновременным понижением класса водителя.
Перед покупкой ОСАГО желательно проверить КБМ, чтобы узнать размер скидки, на которую можно подать заявление в страховой кассе.
Расчет по таблице
Использовать таблицу KBM для определения стоимости ОСАГО достаточно просто. Действия требуются последовательно.
- Расчет начинается со строки с коэффициентом 1.
- Для безаварийного года необходимо спуститься в таблице на одну строчку вниз;
- При наличии тревог требуется подняться на количество строк, равное количеству аварийных ситуаций;
- Пропуск одного года присутствия в страховом полисе автоматически переводит водителя на базовый уровень с коэффициентом 1;
- Если страховка бессрочная, изменение коэффициента производится исключительно владельцем транспортного средства.

Следует отметить, что таким способом можно получить только расчетные данные. На самом деле размер скидки может оказаться меньше, например, из-за того, что страховщики не внесли в базу PCA соответствующую информацию о безаварийном вождении клиента. В результате MSC можно проверить исключительно на официальном сайте Союза страховщиков, причем в режиме онлайн.
Практика показывает, что страховщики к подобным случаям прибегают регулярно.Отдельному клиенту может показаться, что это не более чем случайность, но на самом деле это законченная система, позволяющая страховщикам сэкономить значительные суммы.
Проверить KBM в базе данных PCA
Следует отметить, что пару лет назад каждая страховая компания использовала собственный архив КБМ, что позволяло автовладельцам в случае возникновения ЧС просто переехать в другой офис, получая базовый уровень вместо повышенного коэффициента.
Сегодня такая уловка невозможна, так как вся информация занесена в единую для всех страховщиков базу данных, доступ к которой доступен через официальный сайт ассоциации российских представителей страхового рынка.
При этом доступ к системе открыт, что позволяет любому автомобилисту проверить КБМ онлайн в течение нескольких минут. Официальный сайт СПС по проверке КБМ — https://dkbm-web.autoins.ru/dkbm-web-1.0/kbm.htm
При заполнении заявки необходимо указать полное имя водителя, для которого проводится проверка, а также номер его водительских прав (буквы серии вводятся латиницей). Далее остается только выбрать предполагаемую дату, в момент которой вы хотите определить коэффициент, а затем активировать систему, нажав кнопку «Поиск».
Полученный результат необходимо сравнить с вашими теоретическими расчетами. Если нет неточностей, значит, нет и проблем. Если в базе PCA есть более скромный коэффициент, то для восстановления справедливости придется обратиться в страховую компанию, а это займет некоторое время.
Восстановление коэффициента в базе PCA
После того, как удалось проверить КБМ и выявить неточности, необходимо приступить к поиску ошибки.![]() Для этого вам потребуется проанализировать все предыдущие страховые полисы ОСАГО. Учитывая, что сам коэффициент в документе не указан, необходимо будет самостоятельно рассчитать стоимость страховки, рассчитав значение коэффициента.
Для этого вам потребуется проанализировать все предыдущие страховые полисы ОСАГО. Учитывая, что сам коэффициент в документе не указан, необходимо будет самостоятельно рассчитать стоимость страховки, рассчитав значение коэффициента.
Надо признать, что ошибку найти непросто. Намного удобнее проводить ежегодную проверку затрат, чтобы выявить отклонения уже в первый год, чем накапливать проблему в течение нескольких лет, смешивая ошибочные данные с правильно рассчитанными периодами.
После выявления ошибки нужно идти в офис страховщика. Решить этот вопрос онлайн через официальный сайт компании не удастся, поэтому вам нужно будет посетить одно из ближайших отделений.
Практика показывает, что в общей сложности на исправление ошибки уйдет около двух-трех дней.
Если неточность при вводе данных в базу данных PCA была допущена, например, пять лет назад, вам нужно будет обратиться в тот самый офис, в котором была допущена ошибка.Учитывая возраст, необходимо будет поднять архивы, что потребует дополнительного времени.
Сразу отметим, что сам СПС не вносит никаких изменений в коэффициенты MSC для расчета ОСАГО, поэтому обращения в организацию не имеют практического смысла и результата не дадут.
Также необходимо отметить случай, когда обнаруженная ошибка не может быть устранена. Это происходит в ситуации, когда компания, совершившая ошибочный ввод (не ввод) данных в базу данных PCA, по какой-либо причине перестала существовать.В такой ситуации никто другой вносить изменения не может, даже если ошибка «видна невооруженным глазом». Переходить прямо на официальный сайт Союза страховщиков в такой ситуации бесполезно.
Как не потерять скидку
Сегодня КБМ — один из немногих инструментов, позволяющих снизить стоимость ОСАГО для водителей. При этом даже одна чрезвычайная ситуация самым серьезным образом сказывается на итоговой стоимости страховки.
Следует иметь в виду, что после наличия страхового случая, в котором страхователь выступил виновником, происходит снижение класса водителя и увеличение коэффициента «Бонус-Малус». При этом это событие отразится на стоимости страховки не в течение одного года, а в течение следующих шести лет. Поэтому водителям желательно принять меры по сохранению существующей MSC.
При этом это событие отразится на стоимости страховки не в течение одного года, а в течение следующих шести лет. Поэтому водителям желательно принять меры по сохранению существующей MSC.
Расчеты показывают, что водителям с десятилетним стажем безаварийной вождения и коэффициентом MSC 0,5 (минимально возможный) даже при управлении отечественной классикой с мощностью двигателя 75 «лошадей» придется заплатить 2,7 тыс. рублей дороже за полис.и за шесть лет размер переплаты составит около 9,5 тыс. руб.
Если речь идет о более дорогих автомобилях с двигателями повышенной мощности (более 100 л.с.), то сумма переплаты будет еще более значительной. Самостоятельно такие расчеты можно провести сразу для всех страховых компаний на нашем сайте, используя для этого.
Как не потерять накопленные бонусы. Единственный способ — договориться на месте. Этой возможностью желательно воспользоваться при незначительной аварии, когда стоимость возмещения поцарапанного бампера или крыла составляет несколько тысяч рублей, а затраты на повышенную стоимость страховки будут значительно выше. Если повреждение автомобилей серьезное, то вам придется оформить полноценный страховой случай, после чего изменения в базе СПС будут внесены в обязательном порядке.
Если повреждение автомобилей серьезное, то вам придется оформить полноценный страховой случай, после чего изменения в базе СПС будут внесены в обязательном порядке.
Подводя итоги, следует отметить, что для автовладельцев КБМ выступает чуть ли не единственным способом удешевления ОСАГО, причем очень существенно. Учитывая то, что страховщики не регулярно вносят данные в базу PCA, необходимо регулярно проверять KBM на официальном сайте ассоциации.отечественные страховщики, защищающие себя от возможных дополнительных расходов при получении полиса.
Какой бонус малус. Снижение куб.м.
С 1 января 2017 года Российский союз автостраховщиков (РСА) совместно с ЦБ РФ вводит новую систему расчета скидок и надбавок для окончательного расчета стоимости полиса ОСАГО.
Новый, который будет представлен в 2017 году, будет в первую очередь привязан к водителю, а не к машине.Напомним, что в настоящий момент на территории России действует система коэффициентов бонус-малус, которая привязана к автомобилю и водителю. В результате, по данным ОГА, около 20% водителей неоправданно переплачивают по полисам обязательного страхования гражданской ответственности.
В результате, по данным ОГА, около 20% водителей неоправданно переплачивают по полисам обязательного страхования гражданской ответственности.
Например, у ответственного и аккуратного водителя. Но это не значит, что общая стоимость полиса ОСАГО будет уменьшена на этот коэффициент при составлении договора страхования. Так как на данный момент полис ОСАГО привязан к транспортному средству, если в полис вписывается водитель с хорошей или безаварийной ездой в полис владельца другого автомобиля, попавшего в аварию по своей вине, то максимальный коэффициент осторожного водителя будет уменьшено.
С 1 января 2017 года планируется отвязать полис ОСАГО от автомобиля и привязать его к самому водителю. То есть для каждого водителя будет рассчитан индивидуальный коэффициент бонус-малус (BMR), который не изменится из-за аварийности другого водителя и автомобиля.
Классы потерь для каждого драйвера (коэффициенты КБМ)
С нового года Союз автостраховщиков России вводит 14 индивидуальных классов для водителей (от убыточного класса «М» до класса 13).
Например, класс потерь «M» имеет коэффициент 2,45. То есть, если водитель часто садится, нарушая правила дорожного движения, то ему может быть присвоен класс убыточности из-за частых аварий с коэффициентом 2,45. Полис обойдется в таких драйверах почти в 2,5 раза дороже.
Сегодня эти убыточные классы привязаны к автомобилю, который водит водитель. Напомним, в системе обязательного страхования гражданской ответственности при управлении автомобилем всем водителям был присвоен класс №1.Далее за безаварийное вождение с водителя взимается скидка в размере 5 процентов. То есть каждый год коэффициент бонусного малуса снижается на 0,05 процента. Таким образом, максимальная скидка за 10 лет безаварийной езды составляет 50 процентов (коэффициент 0,50).
Если водитель независимо от накопленной скидки, то водитель получает увеличивающуюся премию на следующий период страхования за счет коэффициента 1,55. К сожалению, чтобы вернуть коэффициент бонус-малус к 1.0, надо как минимум 2 года ездить без аварий.
В настоящее время. Например, нередки случаи, когда водитель, будучи владельцем автомобиля, страхует свою ответственность, приобретая полис на свой автомобиль, а также вносится в полисы других владельцев транспортных средств. В результате один и тот же драйвер может иметь разные коэффициенты MSC. Это напрямую зависит от того, сколько водителей вписано в тот или иной полис и какой тип транспортного средства у них и их автомобилей.
Но с 1 января 2017 года планируется, что у каждого водителя будет свой личный ОСАГО, который будет меняться раз в год 1 января 2017 года.
Напомним, теперь коэффициент «бонус-малус» меняется после заключения договора страхования на новый срок. Отвязав машину от водителя,. Кроме того, с нового года страховые компании лишатся возможности самостоятельно рассчитывать коэффициент бонус-малус. На данный момент RSA готовит электронную онлайн-систему, которая будет рассчитывать индивидуальный коэффициент MSC для каждого водителя и передавать его по запросу в страховую компанию для заключения договора страхования.
Передача права расчета MSC Российскому союзу автостраховщиков поможет избежать злоупотреблений со стороны страховых компаний при заключении договоров страхования. Внедрение единой базы для расчета ОСАГО на сервере СПС полностью остановит злоупотребления при расчете стоимости полисов ОСАГО страховыми компаниями.
Насколько вырастет скидка по полису ОСАГО с 1 января 2017 года?
Согласно нововведению, с 1 января 2017 года коэффициент MSC будет рассчитываться индивидуально для каждого водителя без учета влияния автомобиля.
То есть, если водитель включен в чужую страховку, то будет рассчитываться не средний коэффициент по двум страховкам, а более справедливый. То есть, если у водителя коэффициент 0,5, то если он вписан в страховой полис другого автовладельца, то водитель с максимальной скидкой не потеряет коэффициент и.
По данным RSA, около 20 процентов водителей получат скидку от 2 до 15 процентов с 1 января благодаря новой методике расчета окончательной стоимости полиса ОСАГО.
Подорожает ли полис ОСАГО без ограничения количества водителей?
К сожалению, новая система расчета коэффициента бонус-малус с 1 января 2017 года приведет к тому, что в связи с отменой привязки стоимости полиса с автомобиля стоимость полиса ОСАГО без ограничения значительно увеличится допуск водителей к вождению. Напомним, что сегодня, не ограничивая количество водителей, он рассчитывается с использованием коэффициента MSC 1.80.
В итоге многие водители, неоднократно попадая в ДТП по своей вине, понимая, что им грозит опасность расчета стоимости полиса с коэффициентом 2,45 при заключении договора страхования на новый период, просто приобретают политика без ограничения допуска водителей к управлению транспортным средством. Это значительно дешевле, чем рассчитывать полис с коэффициентом 2,45. Чтобы положить конец этой практике, 1 января 2017 года коэффициент MSC равен 2.45 вводится для всех политик ОСАГО без ограничения допуска водителей. Это, конечно, огорчит многих водителей, которые в последние годы приобрели полисы без ограничения количества водителей. Подорожание такого полиса ОСАГО составит 13,6 процента.
Подорожание такого полиса ОСАГО составит 13,6 процента.
Будет ли переходный период после введения новой системы расчета коэффициента бонус-малус?
Да, Союз автостраховщиков России устанавливает, что после запуска новой системы расчета коэффициента MSC будет введен льготный период.Например, для тех водителей, которые не входят в один полис ОСАГО и имеют несколько типов коэффициентов бонус-малус, он будет установлен (напомним, что на данный момент в 2016 году страховые компании рассчитывают средний коэффициент бонус-малус).
Так что для таких драйверов стоимость полиса ОСАГО в 2017 году может снизиться.
Насколько вырастет стоимость полиса для юридических лиц и таксистов?
С 2017 года все юридические лица начнут платить по средней ставке.Ведь сегодня все юридические компании покупают полис ОСАГО, стоимость которого рассчитывается индивидуально для каждой машины. Но с 01.1.17 для юридических лиц среднее значение MSC будет рассчитываться для всего парка, принадлежащего юридическим лицам.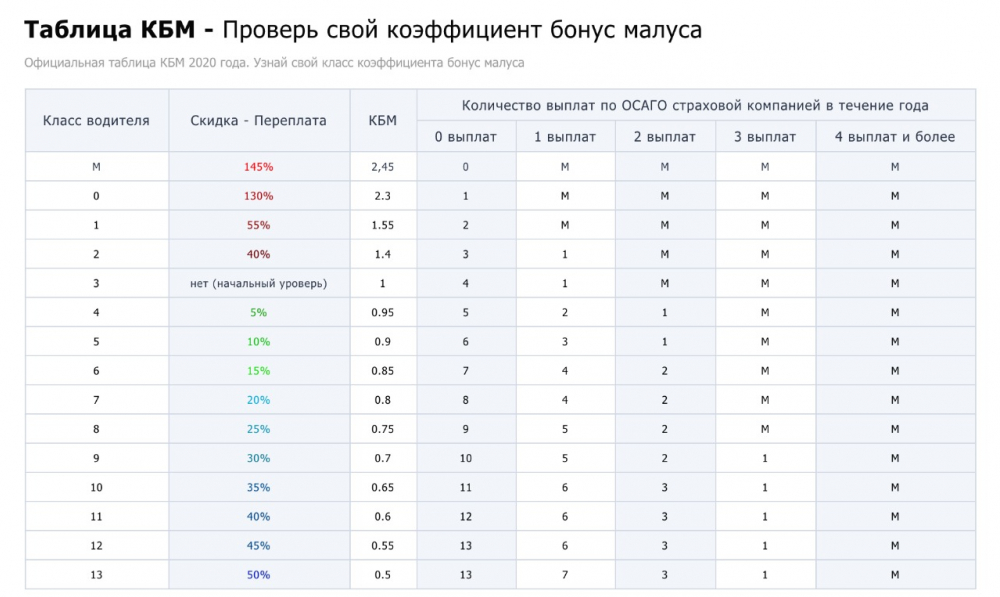 лицо. Для тех компаний, которые имеют большой автопарк, это обязательно приведет к значительному увеличению стоимости годового страхования ответственности водителей транспортных средств.
лицо. Для тех компаний, которые имеют большой автопарк, это обязательно приведет к значительному увеличению стоимости годового страхования ответственности водителей транспортных средств.
Особенно не повезло большим таксопаркам, где машины часто являются виноватыми водителями.Ведь с нового года, если хотя бы один водитель попадет в ДТП, то в следующем, календарном периоде среднее значение MSC для юридического лица (а значит, для всего автопарка, принадлежащего компании) значительно вырастет. .
Как вырастет стоимость полиса ОСАГО, если в него войдет водитель, который по своей вине в прошлом попал в аварию?
Согласно новым правилам, с 1 января 2017 года, если владелец автомобиля вводит в полис нескольких водителей, то расчет MSC будет рассчитываться для водителя, у которого наихудший коэффициент MSC.Поэтому рекомендуем каждому автовладельцу при составлении полиса обращать пристальное внимание на то, кого он вводит в полис ОСАГО, ведь если ввести водителя с большим коэффициентом МТП из-за его аварийности, то общая стоимость Полис ОСАГО может быть намного выше.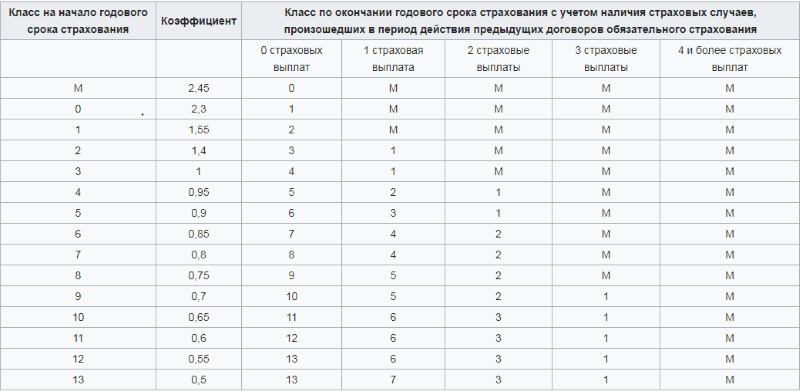
Любой начинающий водитель после получения водительских прав считается потенциально опасным водителем, так как у него нет водительского стажа, а если его возраст меньше 23 лет, то вдвойне. Поэтому при расчете стоимости полиса ОСАГО с таким водителем он будет примерно в 2 раза дороже, чем с водителем, стаж которого более 3 лет и возраст более 23 лет.Разберемся, что же такое все-таки КБМ? KBM — коэффициент «бонус-малус» — коэффициент, увеличивающий или уменьшающий стоимость полиса ОСАГО, то есть определяет скидку. Многие водители вообще не знают, что им полагается скидка на безаварийное вождение и стаж вождения. Стандарт MSC 1 — многие агенты и страховые компании рассчитывают исходя из этого коэффициента. По закону, если водитель уехал на год без происшествий, то страховая компания, в которой это лицо было застраховано, должна предоставить данные о нем в Российский союз автостраховщиков (РСА), а при заключении следующего полиса ОСАГО — его ОСАГО. должна быть на 5% ниже стоимости. И так каждый год. Максимальная скидка 50%. То есть нужно уехать на 10 лет без происшествий. И самое главное, убедитесь, что страховая компания предоставила PCA данные о вашем безаварийном опыте. Основные причины, по которым MSC не зачисляется:
И так каждый год. Максимальная скидка 50%. То есть нужно уехать на 10 лет без происшествий. И самое главное, убедитесь, что страховая компания предоставила PCA данные о вашем безаварийном опыте. Основные причины, по которым MSC не зачисляется:
Первая причина — поменять водительские права. Следует понимать, что страховая компания передает данные обо всех водителях и страховщиках в Российский союз автостраховщиков (РСА). И если, например, произошла смена прав из-за смены фамилии для девушек, утери, истечения срока действия, то данные из СПС по тем или иным причинам могут не загрузиться, так что можно честно оставить в течение 10 лет без происшествий, а затем измените свои права и обнаружите, что после изменения прав вы потеряли скидку 50%, а ваш MSC стал равным 1.
Вторая причина могут быть ошибки, которые страховые компании могут допустить при составлении полиса, тогда окажется, что вы потеряете страховой год, поэтому все ваши скидки будут уничтожены, так как одно из условий предоставления скидки является непрерывным страхование и теперь вы снова потеряли скидку.
Третья причина, и это основная причина высокого BMR, — это несчастные случаи. Если вы попали в аварию, то MSC увеличивается, это как бы санкции, которые страховые компании применяют за аварии, произошедшие по вашей вине.Здесь стоит отметить, что несчастные случаи, в которых вы не виноваты, никоим образом не влияют на ваш MSC, и по окончании периода страхования вы получите скидку, как если бы аварии не было.
Следует отметить, что в зависимости от значения MSC драйверу назначается определенный класс. То есть, если вы страхуете первый год, то ваш класс — 3, а затем, в зависимости от того, попали вы в аварию или нет, ваш класс соответственно увеличивается или уменьшается.
2.Как опустить MSC
Заявка на сокращение MSC
Перед отправкой проверьте правильность заполнения контактных данных.
Выгодно ли опускать MSC
Чтобы оценить, насколько выгодно понизить MSC, давайте рассмотрим пример. Допустим, у вас 2-й класс ОСАГО, то есть сам коэффициент 1,4 (например, вы попали в аварию и вам увеличили коэффициент) и ваша стоимость страховки ОСАГО составила 15000 рублей. Тогда вы обратились в нашу компанию, и наши сотрудники снизили ваш MSC всего на 1 класс и теперь значение коэффициента 1, то новая стоимость страховки будет 10 715 рублей! То есть сэкономили 4285 рублей, согласитесь, деньги не маленькие. Причем это значение MSC сохраняется за вами, то есть в следующем году стоимость страховки с учетом безаварийного вождения будет такой же или меньше!
Тогда вы обратились в нашу компанию, и наши сотрудники снизили ваш MSC всего на 1 класс и теперь значение коэффициента 1, то новая стоимость страховки будет 10 715 рублей! То есть сэкономили 4285 рублей, согласитесь, деньги не маленькие. Причем это значение MSC сохраняется за вами, то есть в следующем году стоимость страховки с учетом безаварийного вождения будет такой же или меньше!
Думаю, вы убеждены, что снижение MSC выгодно.
Гарантированный результат
Как мы можем проверить нашу работу? — очень просто есть много сервисов по проверке KBM в базе PCA.После завершения процедуры перехода на более раннюю версию MSC, которая занимает от 1 до 3 рабочих дней, вы проверите свой MSC в базе данных и убедитесь, что он действительно упал! Мы всегда за клиента и дорожим своей репутацией!
3. Что дает низкий MBR
Low MSC дает скидку на стоимость ОСАГО в любом регионе России и любой страховой компании. Поэтому необходимо следить за тем, чтобы страховщики всегда учитывали ваш MSC и вашу скидку. Вы можете увидеть значения KBM и соответствующие им классы в таблице ниже. Вы также можете использовать эту таблицу, чтобы рассчитать количество лет, в течение которых вам нужно получить конкретную скидку. Но зачем ждать? Когда мы сможем снизить MSC в нашей компании.
Вы можете увидеть значения KBM и соответствующие им классы в таблице ниже. Вы также можете использовать эту таблицу, чтобы рассчитать количество лет, в течение которых вам нужно получить конкретную скидку. Но зачем ждать? Когда мы сможем снизить MSC в нашей компании.
| Класс на начало годового периода страхования | Коэффициент | Класс на конец годового периода страхования с учетом наличия страховых случаев, произошедших в период действия предыдущего договора ОСАГО. | ||||
|---|---|---|---|---|---|---|
| 0 Страховые выплаты | 1 Страховая выплата | 2 Страховые выплаты | 3 Страховые выплаты | 4 и более Страховые выплаты | ||
| M | 2,45 | 0 | M | M | M | M |
| 0 | 2,3 | 1 | M | M | M | M |
| 1 | 1. 55 55 | 2 | M | M | M | M |
| 2 | 1,4 | 3 | 1 | M | M | M |
| 3 | 1 | 4 | 1 | M | M | M |
| 4 | 0,95 | 5 | 2 | 1 | M | M |
| 5 | 0.9 | 6 | 3 | 1 | M | M |
| 6 | 0,85 | 7 | 4 | 2 | M | M |
| 7 | 0,8 | 8 | 4 | 2 | M | M |
| 8 | 0,75 | 9 | 5 | 2 | M | M |
| 9 | 0.7 | 10 | 5 | 2 | 1 | M |
| 10 | 0,65 | 11 | 6 | 3 | 1 | M |
| 11 | 0,6 | 12 | 6 | 3 | 1 | M |
| 12 | 0,55 | 13 | 6 | 3 | 1 | M |
| 13 | 0.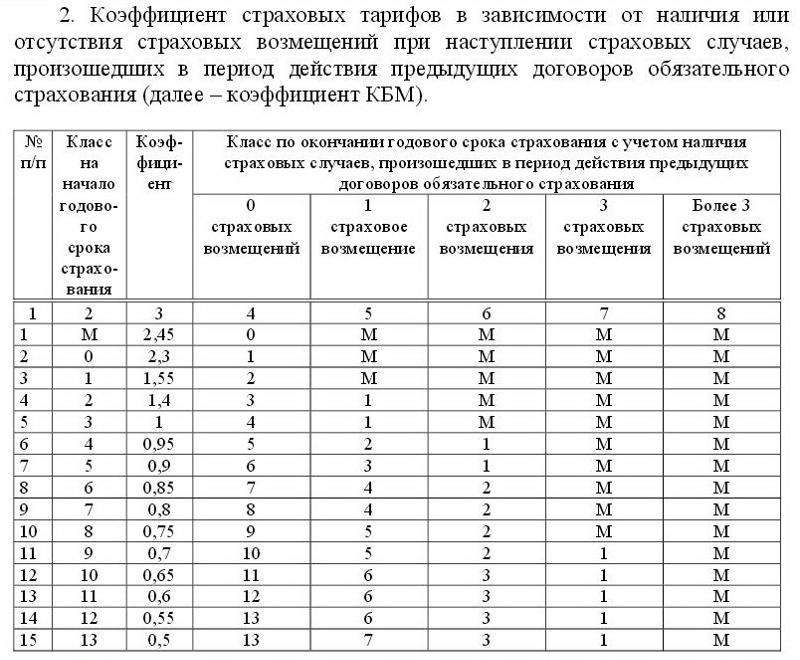 5 5 | 13 | 7 | 3 | 1 | M |
4. Спуск MSC после аварии
Очень вероятно, что за рулем вы рано или поздно попадете в аварию, виновником которой будете вы. Это вполне нормально, и я думаю, что многие из нас прошли через это. Если вы уже пережили этот неприятный момент, то знаете, что страховые компании вводят санкции после ДТП и в следующий страховой период стоимость страховки увеличивается.Это связано с увеличением MBM. Однако мало кто знает, что даже в этом случае можно снизить стоимость страховки. Мы снижаем коэффициент MSC даже после аварии. Вы можете проверить это, заполнив заявку выше.
5. Цены на скидки MSC
Стоимость снижения MSC в нашей компании зависит от того, сколько классов вам нужно для понижения MSC. Ниже представлена таблица, которая поможет вам приблизительно оценить стоимость услуги. В тех случаях, когда после аварии требуется спустить MSC, расчет выполняется индивидуально.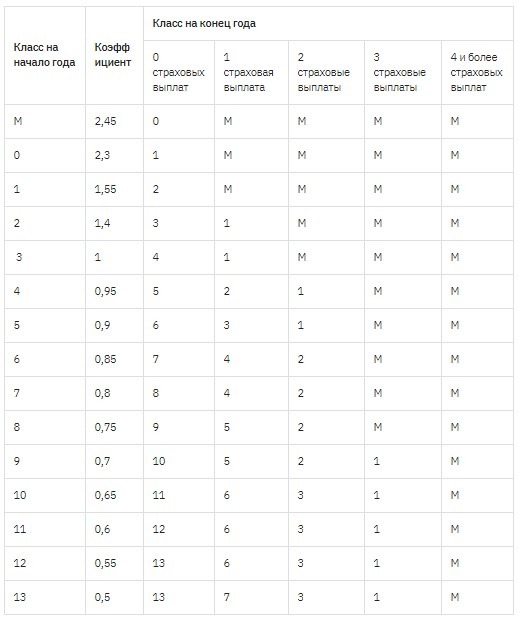
В настоящее время практически все автовладельцы знают, что при расчете ОСАГО используется так называемый коэффициент бонус-малус («бонус-малус» с латыни «хорошо-плохо») или Кбм. Некоторые называют это просто «скидкой», забывая, что КБМ учитывает не только безубыточность (бонус), но и наличие выплат по вине страхователя (малус — штраф за неаккуратное вождение). Также при определении Kbm используется термин «класс страхователя».
Кбм для каждого водителя является индивидуальной величиной и зависит от его страховой истории.Для наглядности приведем таблицу, которая регулирует определение КБМ и одинакова для всех страховых компаний. Он составлен таким образом, что зная класс каждого водителя в заключении, можно в зависимости от количества ДТП, произошедших по его вине в течение года, определить, какие килобайты он получит при страховании на следующий год. .
Таблица 1. Бонусный класс Malus.
таблица прокручивается вправо| Начальный класс KBM (по предыдущему контракту) | MSC value | MSC class по новому контракту по истечении предыдущего контракта, после | ||||
|---|---|---|---|---|---|---|
| 0 страховых выплат | 1 страховая выплата | 2 страховых выплаты | 3 страховых выплаты | 4 и более страховых выплаты | ||
Когда водитель впервые заключает договор ОСАГО, ему присваивается класс 3 (Кбм = 1). Затем на каждый безаварийный год ему предоставляется скидка 5%, и его класс повышается. Если по его вине происходят аварии, то «класс» уменьшается, а Kbm, соответственно, увеличивается.
Затем на каждый безаварийный год ему предоставляется скидка 5%, и его класс повышается. Если по его вине происходят аварии, то «класс» уменьшается, а Kbm, соответственно, увеличивается.
- У страхователя Кбм = 0,85 (6 класс, скидка 15%). По его вине произошло 1 ДТП, пострадавшему выплачено вознаграждение. В следующем году при заключении договора ОСАГО у него будет 4 класс и Кбм = 0,95 (скидка 5%).
- Начинающий водитель с Кбм = 1 стал виновником ДТП в первый год езды.На второй год страхования вместо скидки 5% он получает увеличивающийся Кбм = 1,55. А если он снова попадет в ДТП по собственной вине, на третий год страхования полис ему будет рассчитан с Кбм = 2,45.
Из истории КБМ
С момента введения обязательного автострахования в 2003 г. и вплоть до 2008 г. класс застрахованных «привязан» исключительно к транспортному средству. То есть, когда водитель приобрел новую машину и пришел оформлять полис ОСАГО, то автоматически терял все свои скидки. Ситуация оказалась абсурдной: понятия «страховая история» не существовало, а КБМ не выполнял свою главную функцию — поощрять осторожное вождение и стимулировать безаварийную работу «бонусами». В марте 2008 года опыт других стран все же был учтен, и система «бонус-малус» кардинально изменилась. С этого момента класс стали назначать каждому водителю в индивидуальном порядке, сохраняя его при покупке другого автомобиля. И теперь, даже если водитель, ранее входивший в чужой полис, впервые становится автовладельцем, он имеет полное право рассчитывать на уже «заработанную» скидку.
Ситуация оказалась абсурдной: понятия «страховая история» не существовало, а КБМ не выполнял свою главную функцию — поощрять осторожное вождение и стимулировать безаварийную работу «бонусами». В марте 2008 года опыт других стран все же был учтен, и система «бонус-малус» кардинально изменилась. С этого момента класс стали назначать каждому водителю в индивидуальном порядке, сохраняя его при покупке другого автомобиля. И теперь, даже если водитель, ранее входивший в чужой полис, впервые становится автовладельцем, он имеет полное право рассчитывать на уже «заработанную» скидку.
Как определить Кбм, если в полис ОСАГО прописано несколько водителей или оформлена страховка «без ограничения количества лиц, которым разрешено управлять автомобилем»?
Если в полис вписывается несколько человек, Кбм для расчета его стоимости берется по драйверу, у которого Кбм максимально. Поэтому, когда в компанию солидных и опытных мастеров вождения попадает малоопытный водитель, нужно быть готовым к тому, что страховка значительно подорожает.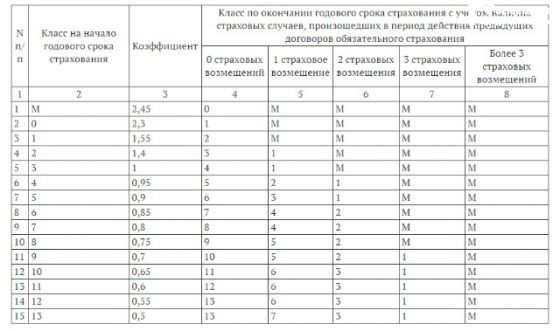 Мало кто понимает и еще один важный момент … В случае аварии Kbm увеличивается только у того, кто вел машину в момент аварии, и был признан виновным инспекторами ГИБДД. Остальные водители, включенные в страховку, надежно сохраняют свои скидки. И если в следующем году виновник не будет включен в полис, общая скидка по нему будет, как ожидается, на 5% больше.
Мало кто понимает и еще один важный момент … В случае аварии Kbm увеличивается только у того, кто вел машину в момент аварии, и был признан виновным инспекторами ГИБДД. Остальные водители, включенные в страховку, надежно сохраняют свои скидки. И если в следующем году виновник не будет включен в полис, общая скидка по нему будет, как ожидается, на 5% больше.
Если страхователь заключает договор при условии, что водителям разрешено управлять автомобилем, KBM определяется владельцем транспортного средства.При этом неважно, кто хозяин, это также может быть бабушка в деревне, которая в своей жизни не управляла рулем. Просто с «неограниченной» политикой CTP вы не будете «привязываться» ни к кому, кроме владельца, для определения Cbm. Страхователь не в счет, потому что страхователь — это лицо, которое платит страховой компании и определяет условия страхования.
Проблемы КБМ
Когда были внесены изменения в Закон об обязательном ОСАГО по МТМ, сначала казалось, что ОСТ в России стало цивилизованнее: добросовестность за рулем поощряется, недисциплинированность карается рублем.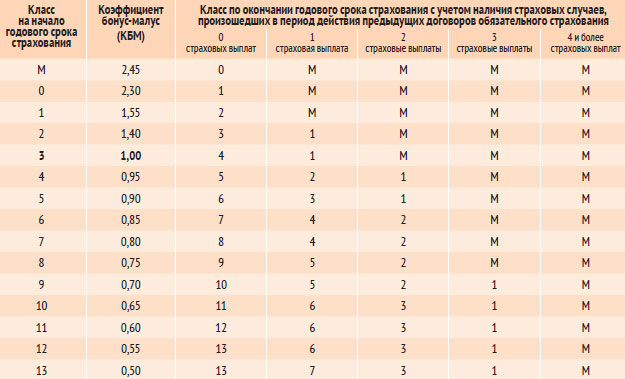 Все честно. Но оказалось, что реальность далека от совершенства.
Все честно. Но оказалось, что реальность далека от совершенства.
По идее все отлично смотрится. Любой автовладелец может хотя бы приблизительно определить свой Кбм, исходя из собственного опыта ОСАГО: количество лет страхования, количество страховых случаев и приведенная выше таблица. А как насчет сотрудников компании, страховых агентов и брокеров? Идеальным для определения Kbm может быть только ситуация, когда водитель застрахован все годы (или хотя бы несколько последних лет) в одной и той же компании, и какая-либо информация о нем есть в базе данных.Если человек приехал из другой Великобритании, проблемы возникают с KBM.
С одной стороны, все просто — по предыдущей политике всегда можно рассчитать прошлогоднюю скидку и добавить еще 5%. Но где гарантия, что в предыдущей компании не было выплат за водителя? Поверить ему на слово? Не серьезно. Пока страховые компании хранят в секрете данные о своих страхователях и упорно отказываются создавать единую базу данных, путаница с KBM будет продолжаться. Даже злонамеренный нарушитель правил дорожного движения, то и дело доставляющий на дороге неприятности, ничего не стоит каждый год бегать из одной компании в другую и честным взглядом требовать очередную скидку на безаварийную работу.
Даже злонамеренный нарушитель правил дорожного движения, то и дело доставляющий на дороге неприятности, ничего не стоит каждый год бегать из одной компании в другую и честным взглядом требовать очередную скидку на безаварийную работу.
Описанная ситуация, конечно, крайность, но скрывать парочку оплаты труда никому сегодня нельзя. К счастью, страховщиков в ОСАГО по-прежнему слишком много, хотя с рынка автострахования ежегодно уходят десятки компаний.И бывает, что автовладелец готов подать справку о безубыточности, справедливо претендуя на скидку, но, увы, его страховая компания лишилась лицензии. Другой застрахованный даже не интересуется никакими «бонус-малусами», каждый год покупает новую машину и страхуется в автосалоне, как будто впервые, ни на что не претендуя.
Другой распространенный случай — когда в полис вводится водитель со стажем, скажем, 6 лет, и общая страховая скидка составляет 40%. Что ж, очевидно, что человеку с таким опытом скидка 40% не может быть, максимум — 25%.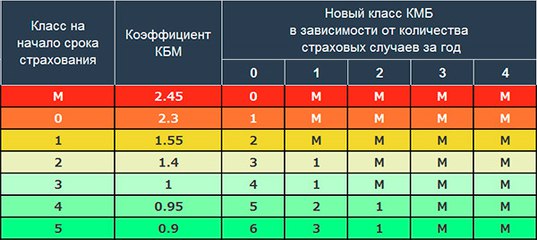 Но очень мало страхователей с классом 1 или самым низким — М, хотя на наших улицах много аварий. И все эти факты в совокупности называются беспорядком.
Но очень мало страхователей с классом 1 или самым низким — М, хотя на наших улицах много аварий. И все эти факты в совокупности называются беспорядком.
Однако в настоящее время серьезные страховые компании стали более жестко относиться к «посторонним» из застрахованных. Некоторые требуют, чтобы вы принесли справку от предыдущей компании о том, что год был безаварийным, другие предоставляют скидку только в том случае, если страхователь дополнительно выдает DSAGO, третьи предлагают другие меры.Если клиент не собирается идти за сертификатом, не хочет обязательного ДСАГО, не соглашается застраховать без скидки, ему просто говорят «до свидания». Но такую политику проводят крупные компании. Мелкие страховщики, которые полагаются исключительно на ОСАГО (а в будущем, как правило, разорятся), готовы схватить кого угодно, а потому усиленно заманивают к себе клиентов максимальными скидками.
Следует также отметить, что причина отказа от повышения коэффициентов по возможности кроется не только в привычке России к жульничеству. Если бы страхование ОСАГО в нашей стране «работало» полноценно, без сбоев, задержек и постоянного занижения выплат, у страхователей не было бы причин неуважительно относиться к страховщикам.
Если бы страхование ОСАГО в нашей стране «работало» полноценно, без сбоев, задержек и постоянного занижения выплат, у страхователей не было бы причин неуважительно относиться к страховщикам.
На хранении
Из вышеизложенного очевидно, что система «бонус-малус» в нашей стране практически не выполняет поставленную перед ней Правительством задачу — более объективно оценить степень риска и страховой тариф для ОСАГО. Человеческий фактор остается главным критерием определения Кбм для каждого конкретного водителя.Один клиент убедителен до невозможности, другой похож на мошенника. Одни агенты выдают скидки с поводом или без, просто для того, чтобы подстраховаться и получить комиссию, другие, наоборот, делают вид, что концепции CBM вообще не существует, и интенсивно «ловят» клиентов, которые о ней не подозревают. И т. Д.
В настоящее время решение о создании единой базы данных по ОСАГО окончательно принято законом, и к концу 2012 года страховые компании должны ввести единую базовую информацию обо всех своих клиентах.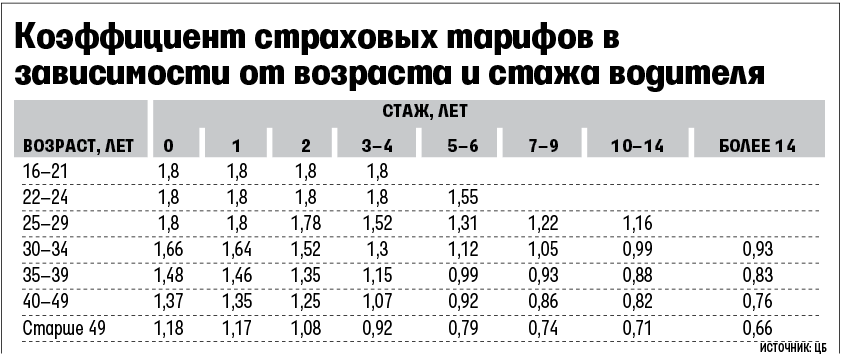 Если это будет реализовано, и с 2013 года заработает общая для всех страховщиков база. Возможно, тогда проблемы с определением КБМ навсегда уйдут в прошлое.
Если это будет реализовано, и с 2013 года заработает общая для всех страховщиков база. Возможно, тогда проблемы с определением КБМ навсегда уйдут в прошлое.
Сейчас на рынке обязательного автострахования среди жителей ОСАГО просто «творится ад». Если в 2007-2009 годах, насколько я помню, застраховаться было легко и просто, то теперь ЭТО ПРОСТО НЕВЕРОЯТНО ТРУДНО! Конечно, государство пытается навести порядок, покупая электронный полис, но он работает, как выясняется, не во всех компаниях, хотя, похоже, с 2017 года все будут обязаны.Но для того, чтобы застраховаться на обычного рядового водителя, необходимо обязательно знать класс своего водителя или, как его называют страховщики, его коэффициент бонус-малус (сокращенно KBM). Но с этим у 90% водителей большая проблема! Хотя вроде все элементарно! НО я решил рассказать, как собственно рассчитать самому. Информация очень полезная, так что читайте, добавляйте в закладки …
Собственно то, что меня бесит больше всего. У меня была страховка ОСАГО в компании ЖАСО, в этой организации я был застрахован очень долго — безаварийный стаж, около 9 лет! Продление полиса в этой компании для таких водителей, как я, заняло максимум полчаса. То есть подъехал и еще год оформился, быстро и удобно. Но вся проблема в том, что с 2016 года компания перестала заниматься страхованием специально для ОСАГО, а все дела передала СОГАЗу. Решила позвонить туда, на что мне сказали — сегодня не успеешь (звонила в 13.00), приходи утром до открытия за час, тогда возможно можно застраховать этот день! БЛЯДЬ! Очереди вроде просто огромные — ДВА ДНЯ ОСТАЛИСЬ ЛЮДИ! А самое обидное есть практически в любой организации, куда бы ни звонили.Слежу за рынком весь день
То есть подъехал и еще год оформился, быстро и удобно. Но вся проблема в том, что с 2016 года компания перестала заниматься страхованием специально для ОСАГО, а все дела передала СОГАЗу. Решила позвонить туда, на что мне сказали — сегодня не успеешь (звонила в 13.00), приходи утром до открытия за час, тогда возможно можно застраховать этот день! БЛЯДЬ! Очереди вроде просто огромные — ДВА ДНЯ ОСТАЛИСЬ ЛЮДИ! А самое обидное есть практически в любой организации, куда бы ни звонили.Слежу за рынком весь день
«Ладно» — подумал я, теперь стали применять электронный полис ОСАГО. Я прогрессивный человек, имеющий Интернет на «ВАС», считаю, что это легко и просто застраховать. Но этого не произошло, почти все компании только продлевают ОСАГО через официальные сайты, но вопрос стоит о заказе нового, для нового человека — ЭТО НЕ! Просто жесть какая-то. Обидно до глубины души.
Поэтому у меня возник такой вопрос — государство удвоило цены на ОСАГО, а на деле стало еще хуже. Раньше с 2008 по 2009 год проблем со страховкой не было! Пришел и через полчаса у вас в руках полис! Что изменилось ЭТО? Скажите, пожалуйста, почему в законе нет статьи, которая бы излагала линии политики, например, не более 30 минут или в обязательном порядке через Интернет. Оказывается, это очередная ГАИ, где можно часами ждать инспекторов на место ДТП !!! Вроде особо усложняется элементарная процедура, ГДЕ КОНТРОЛЬ ПИТАНИЯ ???
Раньше с 2008 по 2009 год проблем со страховкой не было! Пришел и через полчаса у вас в руках полис! Что изменилось ЭТО? Скажите, пожалуйста, почему в законе нет статьи, которая бы излагала линии политики, например, не более 30 минут или в обязательном порядке через Интернет. Оказывается, это очередная ГАИ, где можно часами ждать инспекторов на место ДТП !!! Вроде особо усложняется элементарная процедура, ГДЕ КОНТРОЛЬ ПИТАНИЯ ???
Ладно, думаю с 1 января 2017 года ПРОДАЖИ ЧЕРЕЗ ИНТЕРНЕТ ДЕЙСТВИТЕЛЬНО СТАРТУТ! То есть, как я вижу, зашла на сайт, заполнила форму на сайте, расплатилась картой или электронными деньгами и распечатала полис дома! Если вас остановил инспектор ГИБДД, то проверьте на базе «РСА» и, если подделки нет, идите дальше.Я ДУМАЮ, ЛЮДИ ПРОСТО СКАЖУТ СПАСИБО И ОСТАВЛЯЮТ ЭТИ НЕОБХОДИМЫЕ ОГРОМНЫЕ ХОДЫ!
А пока на сайтах компаний НОРМАЛЬНЫХ калькуляторов нет, давайте воспользуемся калькулятором на сайте СПС, это все равно контролирующая организация.
Как рассчитать ОСАГО? На самом деле все просто, заходим на сайт СПС и видим надпись «Калькулятор ОСАГО».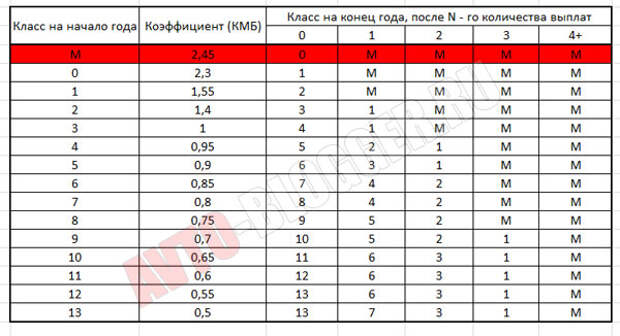 Проезжаем и видим много несложных полей. Например:
Проезжаем и видим много несложных полей. Например:
- Автовладелец
- Тип автомобиля
- Мощность двигателя
- Срок действия договора
- Срок использования
- Класс водителя
- Немного о районе и городе
- Дополнительная информация о драйверах, если двое или трое то въезжают все
На самом деле ниже указана сумма, которую нужно заплатить.НО ПОМНИТЕ, ЭТО РЕКОМЕНДУЕМАЯ БАЗОВАЯ СУММА, ЭТО СТРАХОВАЯ КОМПАНИЯ МОЖЕТ УВЕЛИЧИТЬ СВОЙ ПРОЦЕНТ!
Можно даже распечатать расчет и обратиться с ним в страховую компанию, но есть непонятный момент — ЭТО «КЛАСС ВОДИТЕЛЯ». Что это и где взять? Давайте разберемся
Класс драйвера MTPL на сайте PCA или KBM Рассчитать этот класс драйвера несложно! И если говорить правильно, это — Коэффициент «Бонус-Малус» . … Почему это так называется? Да все просто — если год катаетесь без аварий, то вам дается «Бонус» — скидка 5% на следующий год, а если попадете в аварию (или две-три), то вас накажут. повышение страхового коэффициента (это понятно «Малусу»).
повышение страхового коэффициента (это понятно «Малусу»).
Теперь понеслась полезная информация для тех, кто не понимает, как ее рассчитать, смотрим на эту табличку MSC.
В нем всего 15 уровней, начиная с «М», далее от «0» до «13» включительно.
Собственно, если вы начинающий водитель — только что сдали лицензию, то максимальный MSC у вас подойдет, это нулевой уровень , коэффициент для вас будет 2.3! Подумайте только, то есть если тариф на вашу машину, например, 4000 рублей, то вам нужно будет заплатить 4000 Х 2,3 = 9200 рублей.
Ездили год, без аварий, вам присвоен класс водителя «1». А если посмотреть в таблицу, то КБМ будет равно — 1.55
Третий год безотказной работы — водительский класс «3», КБМ — 1
Если соблюдать правила и 15 лет ездить без аварий, то максимальный класс водителя «13», возможна скидка 50%! То есть ваш KBM равен 0,5. Так что если базовая ставка на вашу машину, например, 4000 рублей, вы заплатите всего 2000 рублей, это не плохо?
Так рассчитывается класс драйвера, который характеризуется MSC. Но что, если вы попали в аварию по вашей вине?
Но что, если вы попали в аварию по вашей вине?
Здесь тоже все просто, снова смотрим в таблицу, есть как повышающие, так и понижающие коэффициенты.
Предположим, вы дисциплинированный водитель с 8-летним стажем, ваш класс водителя — «7» (ведь есть еще и нулевой уровень), а это значит, что ваш MSC — 0,8
Ну так бывает, вы попали в одну аварию, и по вашей вине, то есть страховая компания заплатила деньги за поврежденный автомобиль, неважно, сильно ли он был поврежден или просто «поцарапан бампер», то в следующем год у вас будет возрастающий MSC из таблицы, это четвертый столбец (одна выплата) — вам присуждается класс водителя «4».Если вы совершили два несчастных случая в год, то пятая колонка — класс «2», но если их три или более, назначается штраф MSC, класс «M».
Что такое класс «М» — это показатель штрафа, обычно так страховщики обозначают проблемных водителей, тех, кто постоянно наезжает на их автомобили. Как видите, у него самый большой коэффициент — 2,45
Как видите, у него самый большой коэффициент — 2,45
От себя скажу начинающим водителям (нулевой класс), что очень сложно выйти из этого уровня, то есть, пока вы не научитесь водить, велика вероятность того, что вы столкнетесь с машиной и попадете в штрафной площади «М» класса.Поэтому осторожность и еще раз осторожность.
Перевод в другую компанию и КМБМногие люди при переходе из одной компании в другую переживают за свою скидку, правильнее сказать за свой класс или показатель КМБ. Однако здесь не о чем беспокоиться. Когда вы уйдете, ваша бывшая компания должна указать вам ваш индекс массы тела. Если они сопротивляются и говорят, что это якобы секретная информация, то вы можете узнать у представителей РСА (Союза автостраховщиков России), ведь теперь там должна храниться вся ваша страховая история.
Следовательно, страхование при переходе в другую компанию должно начинаться именно с показателя на конец прошлого года. Допустим, вы ушли с оценкой «5», поэтому вам нужно начать с нее.
Кстати, сейчас многие страховые полисы указывают ваш MSC в конце периода, это тоже информация для нового страховщика.
Так, для справки, закон об ОСАГО начал действовать с 1 июля 2003 года, поэтому те, кто застрахованы с этого года и являются безаварийными водителями, легко уже накопили скидку 50%.
Правда, только ваших слов страховой компании не хватит, вам понадобится бумажное подтверждение, здесь либо бывшая компания, либо старый полис ОСАГО (с пометками), либо информация от СПС.
Сейчас смотрим небольшой пояснительный ролик.
KBM — это аббревиатура, обозначающая «соотношение бонуса к малому» … Это значение используется страховщиками для определения ставки полиса ответственности транспортного средства.
КБМ: что такое и как определяется
Этот коэффициент обозначает присвоенный ему класс водителя для безаварийной или экстренной езды.В зависимости от того, как человек водит, у него будет такая КБМ.
Что такое бонусный малус? Когда человек впервые начинает страховать себя по ОСАГО, то у него 3 класс, и значение БМ будет равно единице. На каждый год безаварийной езды, при условии, что человек заключен договор страхования в качестве водителя, его класс увеличивается, а коэффициент уменьшается. То есть через год беспроблемной езды у него будет 4 класс, а MSC, который будет использоваться для расчета, будет равен 0.95.
Следовательно, водитель может накопить пятидесятипроцентную скидку на обязательное страхование автогражданской ответственности. С такой скидкой его класс будет 13. Данные о драйверах есть в СПС. КБМ можно посмотреть на официальном сайте. Следует знать, что MSC водителя определяется договором ОСАГО, который закончился последним.
Из чего состоит учетная ставка?
У многих возникает вопрос, почему стоимость договора ОСАГО может отличаться.На самом деле, есть много факторов, которые влияют на размер полиса. На расчет влияет не только MSC. Что такое страховая премия и из чего она состоит, будет рассказано ниже.
Что такое страховая премия и из чего она состоит, будет рассказано ниже.
Прежде всего, при расчете страховки берется базовый коэффициент. Он может быть разным, в зависимости от типа транспортного средства и его владельца. Например, для легковых автомобилей базовая ставка категории В составит от 3 432 руб. до 4 118 руб. Как правило, страховые компании используют базовую ставку 4 118 рублей.для физических лиц. А для юридических лиц базовая ставка по категории В — 3087 руб.
Следует помнить, что базовые ставки различны для всех типов автомобилей или других транспортных средств. Также имеет значение, кто является владельцем — юридическое или физическое лицо. Далее начинают накручиваться коэффициенты к базовому тарифу — их несколько.
Коэффициенты ОСАГО
Перечислим возможные коэффициенты:
- КН — коэффициент нарушений.Как правило, при выдаче полиса ОСАГО используется редко. Это делается только в отношении водителей, допустивших грубые нарушения.

- КВС — ценность возраста людей и их опыта, которая будет включена в список допущенных к управлению. Здесь указаны коэффициенты умножения.
- CT — территориальный коэффициент использования автомобиля или другого транспортного средства. Для применения СТ страховщики руководствуются свидетельством о регистрации. В каком регионе зарегистрировано транспортное средство, такой территориальный коэффициент будет использоваться для расчета стоимости договора гражданско-правовой ответственности.
- KP — периодический коэффициент. Минимальный срок — три месяца. Но есть нюанс при расчете страховки. Он заключается в том, что если человек хочет оформить полис со сроком действия 3 месяца, то он оплатит пятьдесят процентов его стоимости. При подписании контракта сроком на полгода он должен заплатить 70% от полной суммы. При продлении срока страхования человек оплачивает оставшуюся часть до полной стоимости полиса.
- КО — этот коэффициент обозначает количество людей, которым может быть разрешено управлять автомобилем или другим транспортным средством.
 Есть два варианта оформления договора: с ограниченным количеством водителей или без ограничений.
Есть два варианта оформления договора: с ограниченным количеством водителей или без ограничений. - КС — временный коэффициент. Значение этого коэффициента равно 1, если срок полиса составляет один год. Минимальный COP может составлять 0,2 при условии подписания контракта до 15 дней. Этот вид полиса выдается, когда автомобиль перемещается с одного места на другое.
- КБМ (что такое бонусный малус, о котором говорилось выше). Его минимальное значение может быть 0,5, а максимальное — 2,45. Все данные о драйверах передаются в PCA.КБМ можно запросить как у страховщика, так и на официальном сайте СПС.
- KM — коэффициент мощности. Этот коэффициент применяется к машинам категории B.
Исходя из вышесказанного понятно, из чего состоит тариф ОСАГО. Например, вы можете рассчитать стоимость автомобиля. Например, автомобиль категории В, владелец прописан в Челябинске, мощность 140 лошадиных сил, допущенный к управлению MSC — 0,7. Тогда стоимость страховки будет 4118х2. 1х1,4х0,7 = 8474,84 руб.
1х1,4х0,7 = 8474,84 руб.
Какой MSC будет учитываться при расчете стоимости страховки, если к работе будет разрешено несколько человек с разными MSC
Часто бывает, что в страховой полис нужно вписать несколько водителей с разными коэффициентами бонус-малус. В этом случае страховщик должен проверить каждый драйвер по базе данных PCM. MSC запрашивается для каждого водителя и определяется значение этого коэффициента.
При расчете страховой премии берется наименьший MSC.То есть, если у одного из драйверов КБМ 0,5, а у другого 0,9, то при расчете берется бонусный малус 0,9. Водители должны знать, что они могут просмотреть свою скидку самостоятельно с помощью службы PCA. Узнать там КБМ довольно просто.
Как самому посмотреть КБМ
Повторим еще раз, как проверить КБМ на плате. В настоящее время все страховщики отправляют туда информацию о водителях. Таким образом, вы можете увидеть базу данных KBM. У каждой страховой компании своя.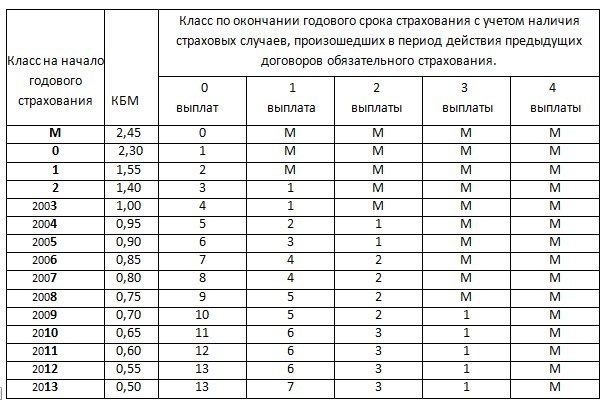 Но поскольку все данные передаются в объединение автостраховщиков, вы можете узнать KBM в базе данных PCA.
Но поскольку все данные передаются в объединение автостраховщиков, вы можете узнать KBM в базе данных PCA.
Для того, чтобы узнать именной коэффициент водителя, которого планируется включить в список лиц, управляющих автомобилем, необходимо знать его данные. Вы также должны знать, с какой даты будет действовать полис. Для этого вам необходимо:
- Перейти на официальную страницу союза автостраховщиков.
- Далее находим вкладку «ОСАГО».
- Выберите строку, в которой написано «Информация для определения KBM».
- После этого перед человеком откроется форма, которую необходимо заполнить с использованием имеющихся данных. В него заносятся фамилия, имя, отчество и дата рождения водителя. Указываются серия и номер водительского удостоверения. Вам также необходимо ввести дату начала контракта.
- Чтобы определить значение KBM, сайт запрашивает ввод секретного кода с картинки. И после того, как все данные введены, отправляется запрос.
Формирование запроса обычно занимает несколько секунд. После этого система выдает MSC водителя и информацию о последнем истекшем полисе, а именно, какой страховой компании он принадлежит.
После этого система выдает MSC водителя и информацию о последнем истекшем полисе, а именно, какой страховой компании он принадлежит.
Если вы планируете ввести несколько водителей, то вам нужно будет заполнить форму на каждого человека. В случае, когда планируется сделать неограниченный круг людей, которые смогут управлять машиной, КБМ будет определяется владельцем. Для этого вам понадобятся его фамилия, имя, отчество, дата рождения, серия и номер паспорта, а также идентификационный номер автомобиля.Если все данные есть, то можно переходить к заполнению формы:
- Перед вводом данных выберите вкладку «Неограниченное количество драйверов» (по умолчанию форма ввода содержит ограниченное количество драйверов).
- После заполнения всех полей система запросит проверочный код.
- При его вводе начнется формирование запроса, после чего будет возвращен результат. Также будет отображаться стоимость MSC и информация о последнем контракте, а именно о том, в какой компании он был заключен.

Надо сказать, что существует множество сторонних сайтов, которые предоставляют информацию о KBM. Представленные на них формы схожи по заполнению и требуют знания одинаковых данных о водителях или владельце. Как правило, аналогичную услугу предоставляют сайты страховых компаний. Если у человека есть сомнения в правильности своего MSC, то он может обратиться за разъяснением в страховую компанию, где у него есть действующий договор. В случае, если получить информацию по телефону невозможно, вы можете подать письменный запрос.
Как меняется MSC при наступлении страхового случая
Если водитель в течение года ездил без происшествий, то его MSC уменьшится на 5%. ОСАГО на следующий год на такую же машину, следовательно, будет стоить на 5% меньше. Это при условии, что остальные тарифы не изменятся. Если наступил страховой случай, то лицо, ответственное за несчастный случай, увеличит MSC при продлении еще на один год страхования.
Например, допустимый драйвер в политике ОСАГО имеет CBM равный 0. 8, а после наступления страхового случая по его вине CBM составит 0,9. Вы также должны знать, что коэффициент увеличивается в зависимости от несчастных случаев, в которых человек был виновником. А максимальный MSC — 2,45.
8, а после наступления страхового случая по его вине CBM составит 0,9. Вы также должны знать, что коэффициент увеличивается в зависимости от несчастных случаев, в которых человек был виновником. А максимальный MSC — 2,45.
Максимальная стоимость ОСАГО
В некоторых источниках есть информация, что полис ОСАГО может стоить 40 000 рублей. при определенных условиях. На самом деле это не совсем так. Есть правило, что стоимость полиса не должна превышать 25000 рублей. А в случае, когда у человека есть повышающие коэффициенты, делающие страхование дорогим, используется другой алгоритм расчета полиса, при котором его стоимость не будет превышать названную сумму.
Какой MSC используется в политике с неограниченным кругом управленцев
Если политика выдается с ограниченным списком драйверов, то для расчета берется наименьший MSC из всех включенных в политику. При неограниченном количестве лиц применяется собственником. Проверить КБМ по собственнику можно, заполнив на сайте Союза автостраховщиков специальную таблицу, куда заносятся ФИО собственника и его паспортные данные. Затем отправляется запрос и проверяется MSC.В этом случае он определяется так же, как и в кругу лиц, которым разрешено управлять автомобилем. То есть за каждый год безаварийной поездки его владелец накапливает скидку.
Затем отправляется запрос и проверяется MSC.В этом случае он определяется так же, как и в кругу лиц, которым разрешено управлять автомобилем. То есть за каждый год безаварийной поездки его владелец накапливает скидку.
Может ли скидка КБМ потеряться?
Вы должны знать, что существует вероятность того, что класс MSC, накопленный за эти годы, может быть сброшен до нуля. Это возможно, если водитель не был включен ни в один страховой полис более года. Поэтому, если у человека нет транспортного средства более года, рекомендуется, чтобы он / она вступили в страховой полис родственников или друзей, чтобы сохранить скидку Bonus-Malus.Если драйвер не помнит, входил ли он в какую-либо политику, он может перейти на сайт PCA. Проверить КБМ там довольно просто.
Как рассчитать ОСАГО самостоятельно
Также на сайте СПС вы можете рассчитать политику ОСАГО. Для этого вам необходимо подготовить документы, которые понадобятся для расчета:
- документ, удостоверяющий личность собственника с пропиской;
- свидетельство или паспорт автомобиля или другого транспортного средства;
- Права тех, кто будет управлять транспортным средством.

Далее нужно перейти в раздел ОСАГО и найти форму для расчета полиса. Перед тем, как приступить к его заполнению, нужно посмотреть MSC всех, кто будет включен в полис. Эта информация понадобится вам для точного расчета стоимости полиса. Вы также должны увидеть возраст водителей и их опыт. После того, как все данные будут получены, можно переходить к заполнению формы. Сумму страховки он выдаст автоматически.Подобные калькуляторы можно найти на сайтах страховых компаний.
Требования к прохождению технического осмотра при заключении ОСАГО
Автовладельцам необходимо знать, что для заключения договора страхования автомобиль должен быть осмотрен. Для разных типов автомобилей существуют свои стандарты поведения. Страховщикам важно, чтобы технический осмотр действовал на момент заключения договора. Таким образом, даже если до окончания предыдущего ТО осталось несколько дней, владелец транспортного средства может заключить ОСАГО со страховой компанией.
Сертификат безубыточности ОСАГО.
 Как восстановить мб в базе рц и получить скидку на страховой полис цп
Как восстановить мб в базе рц и получить скидку на страховой полис цпПри заключении договора каждый автомобилист может рассчитывать на скидку за беспроблемное вождение. Однако на практике накопленная скидка исчезает, и водители начинают задумываться о том, как восстановить скидку ОСАГО за безаварийную езду.
При оформлении договора страхования всех водителей беспокоит размер накопленной скидки.Это неудивительно, ведь именно благодаря скидке можно существенно сэкономить и приобрести обязательную форму защиты по привлекательной цене. Согласно закону, каждый владелец транспортного средства, не попавший в аварию в течение года, может получить скидку по договору ОСАГО. За каждый год без происшествий начисляется накопительный бонус в размере 5%. Размер бонуса может увеличиваться ежегодно. Что касается максимального лимита, то в рамках закона скидка не может превышать 50% от базовой стоимости обязательной защиты.Получается, что максимальную скидку сможет заработать водитель, который 13 лет водит «железного друга» без аварий. На практике таких драйверов очень много.
На практике таких драйверов очень много.
Рассчитать стоимость ОСАГО онлайн на сайте «Ингосстраха»
Рассчитать стоимость ОСАГО онлайн на сайте Росгосстраха
Рассчитать стоимость ОСАГО на сайте «Ренессанс Страхование»
Рассчитать стоимость ОСАГО на сайте Тинькофф Страхование
Значения МБМ
Многие водители даже не знают, что такое КБМ в страховке ОСАГО.На самом деле все довольно просто и переводится этот термин как коэффициент бонусного малуса. Для ее определения создана специальная таблица, в которой показано, как увеличивается размер скидки, если виновником аварии не является водитель.
Также следует учитывать, что КБМ — это не только скидка по договору, но и умножающий коэффициент, который применяется к водителям, ставшим виновниками ДТП. Именно этот коэффициент учитывается при расчете страховой премии в отношении каждого участника движения.При этом необходимо учитывать, что если договором предусмотрено несколько водителей, при расчете стоимости учитывается минимальный коэффициент, который имеет водитель.
Как узнать и проверить свой КБМ?
Есть два способа проверить KBM драйвером:
- по таблице КБМ
- на одной базе данных PCA
Проверка по таблице
Сразу отметим, что данный метод определения бонуса применялся страховыми агентами и менеджерами.Вы можете скачать таблицу на портале PCA или в свободном доступе во всемирной паутине.
Вся таблица разделена на три части:
- класс
- по договору ОСАГО Коэффициент
- , учитываемый при расчете
- количество аварий
При первой страховке каждому водителю присваивается 3-й класс вождения. Если по прошествии года аварий не было, то в строке текущего бонуса нужно увидеть новый коэффициент, зависящий от количества выплат.Например, со страховкой был 3 класс вождения. Убытков в течение года не было, поэтому клиенту присвоен 4 класс, что соответствует коэффициенту 0,95, что означает скидку 5%.
Если клиент попал в аварию после первой поездки по воде, страховщики применили бы 1 класс вождения с повышающим коэффициентом 1,55. Недостатком этого метода проверки является то, что не все автомобилисты знают свой бонус, который применялся при составлении договора.
Недостатком этого метода проверки является то, что не все автомобилисты знают свой бонус, который применялся при составлении договора.
Проверка по одной базе данных PCA
Этот метод проверки был очень популярен с момента его появления. Все, что нужно сделать клиенту — это зайти на официальный сайт PCA и воспользоваться автоматической проверкой в разделе «ОСАГО».
Для получения информации о текущем классе необходимо указать:
- фамилия, имя и отчество
- дата рождения
- данные водительского удостоверения
- дата, на которую необходимо узнать размер KBM
Как только все данные будут указаны правильно, появится подробный отчет, в котором будет отражена скидка водителя на дату запроса.
Любой желающий может воспользоваться проверкой PCA бесплатно в любое удобное для себя время.
Сертификат безаварийного вождения
Информацию о наличии или отсутствии страховых выплат на бланке ОСАГО можно запросить в виде справки в страховой компании. При этом следует учитывать, что страховщик может оформить справку только по письменному запросу:
При этом следует учитывать, что страховщик может оформить справку только по письменному запросу:
- по действующему ОСАГО
- по просроченному полису
Информация предоставляется в течение 5 рабочих дней с момента обращения клиента в компанию.Эталонный образец утверждается на законодательном уровне. Этот документ содержит такую информацию, как:
- ФИО страхователя и собственника по договору
- срок действия ОСАГО
- КБМ на каждого водителя, которому разрешено водить
- данные автомобиля
- наличие или отсутствие страховых выплат
Стоит отметить, что сертификат требовался несколько лет назад. Как только появилась единая база данных PCA, все страховщики начали самостоятельно запрашивать информацию.Благодаря базе данных страховщики могут получить достоверную информацию за считанные минуты.
Как восстановить КБМ
На практике многие автолюбители задаются вопросом: можно ли вернуть скидку, и если да, то как это сделать? На самом деле существует несколько вариантов возврата заработанного бонуса.
Как восстановить КБМ:
| В офисе страховщика | Самый простой вариант восстановления. Для возврата скидки необходимо:
|
| На официальном сайте страховщика | Не каждый может пойти в офис лично.Специально для таких клиентов на официальном сайте страховой компании есть контактная форма. Для возврата КБМ необходимо:
|
| На портале PCA | Самый проверенный способ — зайти на портал PCA. Необходимо:
|
- Повреждение здоровья или жизни других лиц.

- Повреждение или уничтожение чужого имущества в результате несчастного случая.
Ссылка! По нормам указанного закона потерпевшим считается лицо, которому был причинен вред в результате несчастного случая. При этом в категорию пострадавших попадают водитель, поврежденный автомобиль, пешеходы, а также пассажиры.
Что такое поселение?
Под урегулированием убытков по страхованию ОСАГО понимается процесс возмещения ущерба, причиненного имуществу, здоровью или жизни потерпевших в результате несчастного случая.При этом возмещению подлежат только убытки, понесенные невиновной стороной … В отношении виновника происшествия компенсация убытков по ОСАГО не производится.
Чтобы обезопасить свой автомобиль от нештатных ситуаций на дороге, рекомендуется приобрести полис КАСКО. О том, чем он отличается от ОСАГО, читайте.
Следует отметить, что на законодательном уровне установлен максимальный размер компенсации за понесенные убытки. Так, в соответствии со статьей 7 Закона «Об ОСАГО» максимальная сумма составляет :
Так, в соответствии со статьей 7 Закона «Об ОСАГО» максимальная сумма составляет :
- 400 000 рублей — если пострадало имущество потерпевшего.
- 500 000 рублей — при причинении вреда здоровью или жизни других лиц. В этом случае выплаты производятся в пользу каждой потерпевшей.
Сегодня автовладелец имеет возможность расширить лимит страховых выплат, оформив полис … Данный вид страхования предоставляет страхователю возможность самостоятельно устанавливать максимальный размер страховой выплаты. При этом он вступит в силу только в том случае, если основной компенсации не хватит для полной компенсации причиненных убытков.
Свидетельство о безубыточности
Как известно, каждому автовладельцу, имеющему полис ОСАГО, назначается полис, который используется за счет автострахования.
Итак, водителю, впервые подающему заявку на авто, присваивается Kbm = 1 (скидка = 0%). При этом на каждый год безаварийной езды предоставляется скидка 5%, то есть на второй год езды Кбм будет равен 0,95. Максимальная скидка для ОСАГО составляет 50% … Для ее получения ни в коем случае нельзя допускать аварии по своей вине в течение 10 лет.
Максимальная скидка для ОСАГО составляет 50% … Для ее получения ни в коем случае нельзя допускать аварии по своей вине в течение 10 лет.
Таким образом, каждый водитель должен ознакомиться с механизмом действия полиса ОСАГО, чтобы при наступлении страхового случая он точно знал, когда и какие убытки придется возместить страховщику.
Также необходимо знать о специальной справке, так как, имея этот документ, водитель может потребовать от страховой компании причитающуюся ему скидку.
Купил полис дважды. Что делать?
Для расторжения договора необходимо обратиться в ближайший офис продаж, написать заявление на возврат денежных средств.Укажите в причине расторжения: «двойное страхование». Возврат осуществляется за вычетом операционных расходов.
Как проверить подлинность электронного полиса ОСАГО?Подлинность полиса ОСАГО можно проверить на сайте СПС (Российского союза страховщиков): https://dkbm-web.autoins.ru/dkbm-web-1.0/bsostate.htm
Как оформить электронный полис ОСАГО? С 1 января 2017 года каждый водитель, достигший 18-летнего возраста, может оформить электронный полис ОСАГО на сайте страховой компании. Если владельцу транспортного средства меньше 18 лет, необходимо обратиться в офис продаж.
Если владельцу транспортного средства меньше 18 лет, необходимо обратиться в офис продаж.
Полезные публикации об электронном ОСАГО можно найти на сайтах ЦБ России и «Клуба журналистов»:
- С нового года вы можете приобрести полис ОСАГО в виде электронного документа.
Тарифы ОСАГО определяются в соответствии с распоряжением ЦБ РФ №3384-У от 19 сентября 2014 года и приказ ПАО СК «Росгосстрах» «Об утверждении базового страхового тарифа», действующий на момент заключения договора. Тарифы, применяемые при заключении договора ОСАГО в электронной форме, не отличаются от тарифов, применяемых при оформлении бумажных полисов в офисе страховой компании или у агента. Если стоимость полиса была другой, возможно, в расчете были указаны другие данные.
Нужна ли мне диагностическая карта (техосмотр, ТО) для оформления электронного ОСАГО? Диагностическая карта необходима для легковых автомобилей, не являющихся такси, старше 3 лет. Если ваш автомобиль старше трех лет и у вас нет диагностической карты, действующей на день заключения договора, то для заключения договора ОСАГО вам сначала необходимо пройти техосмотр. Обратите внимание, что три года исчисляются с 1 января года выпуска транспортного средства, независимо от даты покупки или даты выдачи титула.
Если ваш автомобиль старше трех лет и у вас нет диагностической карты, действующей на день заключения договора, то для заключения договора ОСАГО вам сначала необходимо пройти техосмотр. Обратите внимание, что три года исчисляются с 1 января года выпуска транспортного средства, независимо от даты покупки или даты выдачи титула.
Запрос данных о наличии действующей диагностической карты происходит автоматически на основании введенной информации о транспортном средстве, отдельно указывать ее номер не требуется.
Если диагностическая карта не найдена, это может быть связано с ошибками в данных вашего автомобиля. Мы рекомендуем вам внимательно сверить введенные данные автомобиля с данными в вашей диагностической карте.
Страховая история, скидка на безаварийное вождение (коэффициент бонус-малус — КБМ) при регистрации электронного ОСАГО. При оформлении полиса ОСАГО (в любой форме) применяется коэффициент, соответствующий истории страхования, содержащейся в автоматизированной информационной системе РСА. Поэтому будут применяться скидки за безаварийное вождение (если информация о них содержится в СПС). Соответственно, информация о новом договоре ОСАГО, заключенном в электронном виде, также будет передана в СПС.
Поэтому будут применяться скидки за безаварийное вождение (если информация о них содержится в СПС). Соответственно, информация о новом договоре ОСАГО, заключенном в электронном виде, также будет передана в СПС.
Электронный полис желательно распечатать на цветном или черно-белом принтере и носить с собой. Также может быть предоставлена для проверки в виде электронного документа на экране смартфона или планшета (согласно ст. 32 Закона 40-ФЗ от 25 апреля 2002 г. «Об обязательном страховании гражданской ответственности владельцев транспортных средств», в редакции от 29 октября 2019 г.)…
DPS Outfits может онлайн проверить наличие электронного через сеть IMTS МВД России или сайт PCA. Если в информационной системе есть информация о заключении такого договора, они обязаны исключить привлечение водителя к административной ответственности по ч. 2 ст. 12.3 КоАП РФ *
. * Согласно письму ГИБДД МВД России от 03. 07.2015 г.13/12-у-4440 начальнику Центрального сервисного центра Управления безопасности дорожного движения МВД России, руководителям ГИБДД регионального уровня «Об изменениях в законодательстве Российской Федерации». Федерация «.
07.2015 г.13/12-у-4440 начальнику Центрального сервисного центра Управления безопасности дорожного движения МВД России, руководителям ГИБДД регионального уровня «Об изменениях в законодательстве Российской Федерации». Федерация «.
Заключение договора
Когда пора продлевать ОСАГО? Сколько человек можно ввести в политику? А как выгоднее оформить ОСАГО: без ограничений или с лимитом?
В договор страхования ОСАГО можно заключить любое количество человек! Стоимость полиса без ограничений обычно значительно выше, чем у полиса с ограниченным списком факторов.При вводе конкретных водителей каждому водителю присваивается свой страховой класс, что в последующие годы страхования (с учетом страховой истории) может снизить стоимость полиса.
Если страхователь (и / или собственник) также управляет транспортным средством, они должны быть включены в список водителей.
Как застраховать машину, которая используется в качестве такси по ОСАГО? Возможно. В полисе есть пометка «Транспортное средство используется как такси». Свяжитесь с ближайшим к вам офисом продаж, чтобы получить такую политику.
В полисе есть пометка «Транспортное средство используется как такси». Свяжитесь с ближайшим к вам офисом продаж, чтобы получить такую политику.
Договор страхования ОСАГО может быть расторгнут по нескольким причинам, но страховая премия за неиспользованный период минус 23% РВД может быть возвращена в случае:
- Смена владельца транспортного средства.
- Смерть застрахованного (собственника).
- Утеря / гибель транспортного средства, указанного в договоре страхования ОСАГО.
- Наличие второго действующего договора ОСАГО на одно и то же транспортное средство
- Прекращение права собственности на транспортное средство у страхователя (истек срок договора аренды и т. Д.)
- Лишение застрахованных водительских прав
Договоры страхования ОСАГО, заключаемые на период проезда к месту прописки, прекращению действия не подлежат !
Для расторжения вам потребуются: паспорт или другой документ, удостоверяющий личность, оригинал договора страхования ОСАГО, банковские реквизиты, на которые будут переведены средства, а также документ, подтверждающий причину расторжения договора страхования. (договор купли-продажи, справка об отчуждении транспортного средства, постановление о возбуждении уголовного дела по факту угона транспортного средства и др.).
(договор купли-продажи, справка об отчуждении транспортного средства, постановление о возбуждении уголовного дела по факту угона транспортного средства и др.).
В случаях, предусмотренных законом об ОСАГО, возможно расторжение полиса и возврат части страховой премии. Для расторжения договора необходимо обратиться в ближайший офис продаж.
Как расторгнуть договор или внести изменения в электронный полис?Договор расторгается в стандартном порядке.
Куда вернут мои деньги, если я расторгну договор?Деньги будут возвращены на счет, указанный в заявке на возврат.
Расторжение договора ОСАГО, оформленного в электронном видеРасторжение электронного договора ОСАГО возможно только в офисе страховщика. Для расторжения договора необходимо обратиться в любой офис страховщика с заявлением о расторжении договора и документами, подтверждающими основания для расторжения договора.
Для компаний: активация личного кабинета Для активации личного кабинета юридического лица после заполнения всех необходимых реквизитов компании необходимо прикрепить электронную цифровую подпись (ЭЦП) юридического лица в формате. sig формат. После этого заявка будет отправлена на проверку.
sig формат. После этого заявка будет отправлена на проверку.
Платеж
Какую скидку я получу за 10 лет безаварийного вождения?
За каждый год безаварийной езды начисляется скидка 5%. Таким образом, максимальная скидка на 10 лет страхования может составлять 50%.
На нашем сайте вы можете проверить свой ОСАГО и класс страхования, просто рассчитав стоимость ОСАГО в нашем калькуляторе. Мы автоматически проверяем историю страхования водителя через базу данных водителей PCA.
Вы также можете узнать больше о концепции KBM и классе в разделе.
Как изменить срок действия полиса ОСАГО?Чтобы застраховать на срок до 1 года , выберите в настройках онлайн-калькулятора желаемый срок использования автомобиля на первом шаге «Расчет». В этом случае страховой период останется равным 1 году, но стоимость полиса будет скорректирована в соответствии с выбранным периодом использования транспортного средства.
Что делать, если у автомобиля нет номера VIN? Установите флажок « Отсутствует VIN » и укажите номер кузова или шасси.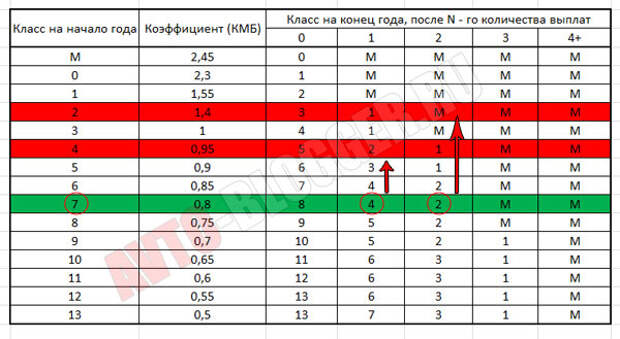
Щелкните значок со знаком вопроса рядом с полем ввода города. В появившемся окне нажмите «Выбрать из списка» и найдите в списке сначала свой регион, затем желаемый населенный пункт.
Когда теряется скидка безубыточности?Скидка безубыточной теряется в следующих случаях:
- , если в этом году вы оформили ОСАГО с ограниченным списком водителей, а в следующем году планируете купить полис без ограничения количества водителей;
- , если перерыв в страховке ОСАГО был более 1 года (в том числе, если вы путешествуете с поддельным ОСАГО на целый год).
Базовая ставка определяется на основании Закона ОСАГО и зависит от региона проживания владельца транспортного средства и типа транспортного средства. На нашем сайте вы можете рассчитать стоимость ОСАГО с помощью онлайн-калькулятора.
Как производится расчет, если автомобиль зарегистрирован в одном регионе, владелец — в другом, а автомобиль находится в управлении — в третьем? Стоимость полиса ОСАГО рассчитывается исходя из коэффициента региона постоянной прописки владельца транспортного средства. Таким образом, регистрация автовладельца имеет решающее значение.
Таким образом, регистрация автовладельца имеет решающее значение.
Нет, поскольку на момент заключения договора страхования ОСАГО Вам не исполнилось 22 года. Однако в следующем году, когда контракт будет продлен, коэффициент умножения больше не будет применяться.
Сегодня я делюсь важной и проверенной «уловкой» на эту тему, , как сэкономить деньги на автостраховании в Канаде (Манитоба) с сертификатом безаварийного вождения?
Это сертификат, подтверждающий, что водитель не попадал в аварию за определенный период времени.Те. для его получения вы должны быть водителем с минимальным опытом и хорошей репутацией вождения, при этом вовсе не обязательно быть владельцем транспортного средства (проверено для Украины).
Этот документ получен у вас на родине, но он нужен вам для того, чтобы облегчить вам жизнь в Канаде (или хотя бы в Манитобе).
Где можно и где мне получить помощь?
Это главный спорный вопрос в данной теме. Многие, по аналогии с украинскими / российскими реалиями, думают, что справку об безаварийном вождении выдает ГИБДД.Но не забывайте, что страховая компания, а не полиция, принимает во внимание «дорожные подвиги» в Канаде, поэтому справка должна быть от страховой компании, в которой застраховано транспортное средство, которым вы управляете.
Как выглядит канадское свидетельство о вождении при несчастном случае?
Вариант №1. Справку можно «сделать сам» (наша версия)
Дело в том, что ни ГИБДД, ни страховые компании не имеют представления, как выглядит эта справка.И отсутствие единого образца, конечно, вызывает определенные трудности: недостаточно просто состряпать справку, нужно еще уговорить «девушку» из страховой компании, что ее не посадят в тюрьму, если она подпишет документ, который она ранее не подписывала. Хорошо, когда в страховой компании есть знакомые или просто адекватные работники, иначе придется применить все свои дипломатические навыки и внутреннее обаяние.
Поскольку единой формы не существует, можно только предполагать, что должно быть в таком документе:
- Полное наименование страховой компании
- Реквизиты компании, контактные данные
- Драйвер IFO
- Контактная информация водителя
- Номер страхового полиса
- Запись об отсутствии претензий
- Срок действия сертификата (например, с 1 ноября 2012 г. по сегодняшний день)
- Имя, должность ответственного лица, подпись, дата.
- С маркой лучше, чем без нее, хотя марки в Канаде почти не существуют.
И не забывайте, сертификат должен быть либо на английском языке, либо к нему должен быть приложен перевод.
Вот образец взят из интернета :
Вариант № 2. Скачайте официальную форму MPI и напугайте ею отечественные страховые компании.
Официальная информация от MPI вместе с формой:
Что дает Канадский сертификат вождения при несчастном случае?
А теперь самое главное — что мы получаем за весь сделанный геморрой? Главный приз — скидка на ежемесячное обязательное страхование . .. Разница может быть очень значительной, особенно если впечатления от вождения приличные. Нам удалось получить сертификат за последние 5 лет правильного вождения моего мужа, что снизило стоимость страховки на 35 долларов каждый месяц.
.. Разница может быть очень значительной, особенно если впечатления от вождения приличные. Нам удалось получить сертификат за последние 5 лет правильного вождения моего мужа, что снизило стоимость страховки на 35 долларов каждый месяц.
Безаварийное движение позволяет получить скидки на страховой полис. Коэффициент Bonus-Malus указывается в заключенном договоре страхования. Компания учитывает информацию о коэффициенте при продаже ОСАГО.Данные получены из АБД — АИС при проверке информации в Союзе автомобильных страховщиков России. Рассмотрим, что такое класс страхования.
Применение коэффициента Bonus-Malus или страхового класса при управлении транспортным средством
Коэффициент используется при расчете стоимости. Автовладельцам — скидка на оплату договора страхования. Бонус равен единице и распределяется в двух случаях:
- при выезде транспорта к месту прописки на техосмотр.
- Страхование транспортных средств, зарегистрированных в другой стране.

Заключение договоров ОСАГО
Повышение ставки не применяется в связи с высокой конкуренцией между страховыми компаниями.
Безлимитная страховка распространяется на владельца, если водителям неограниченного круга разрешено движение. Только владелец имеет право на присвоенный класс автомобиля. На этот раз влияют два условия:
- Присвоение класса выдается, если страхование было бессрочным.
- Совпадение владельца и транспортного средства при составлении нового договора.
Особенность оформления страхового полиса заключается в составлении договора с начисленным коэффициентом … Ставка рассчитывается с учетом детального изучения предыдущих условий договора.
Досрочное прекращение ОСАГО
Новая страховая компания обязана проверить предыдущий полис. Детальное изучение кейса помогает установить бонусный коэффициент.Досрочное расторжение договора предусматривает последующее отсутствие скидки. Скидки рассчитываются исходя из количества аварий и несчастных случаев. На новый могут действовать предыдущие ограничения. Страховая компания получает комиссию за досрочное прекращение страхования. Информацию об этом легко найти на сайте страховой компании. Коэффициент можно узнать, введя личные данные в специальной форме: фамилия, имя, отчество, дата рождения.Как правило, вводятся данные водителя, где записываются серия и номер. Данные размещаются в считанные минуты, поэтому на раннее оформление контракта не уйдет много времени.
Таблица шансов, как определить свой класс
Используя эту таблицу, вы можете определить, какой класс страхования будет присвоен:
| Класс на начало периода страхования | КБМ | Количество страховых случаев за год | ||||
| 0 | 1 | 2 | 3 | 4 и более | ||
| M | 2,45 | 0 | M | M | M | M |
| 0 | 2,3 | 1 | M | M | M | M |
| 1 | 1,55 | 2 | M | M | M | M |
| 2 | 1,4 | 3 | M | M | M | M |
| 3 | 1 | 4 | 1 | M | M | M |
| 4 | 0,95 | 5 | 2 | 1 | M | M |
| 5 | 0,9 | 6 | 3 | 1 | M | M |
| 6 | 0,85 | 7 | 4 | 2 | M | M |
| 7 | 0,8 | 8 | 4 | 2 | M | M |
| 8 | 0,75 | 9 | 5 | 2 | M | M |
| 9 | 0,7 | 10 | 5 | 2 | 1 | M |
| 10 | 0,65 | 11 | 6 | 3 | 1 | M |
| 11 | 0,6 | 12 | 6 | 3 | 1 | M |
| 12 | 0,55 | 13 | 6 | 3 | 1 | M |
| 13 | 0,5 | 13 | 7 | 3 | 1 | M |
Табличные данные включают следующие элементы:
- Класс при начале страхования. Коэффициент
- .
- Страховые выплаты по классам.
Страховое возмещение рассчитывается по нулевой ставке. Далее коэффициент коэффициента рассчитывается по возрастанию класса. Например, страховой стаж равен нулю — коэффициент будет 2. 3. Таблица состоит из тринадцати показателей класса. Коэффициенты рассчитываются с учетом данных владельца с ограничениями и без них. На расчет коэффициента влияют показатели:
- Назначение: управление собственником и другими менеджерами.
- Срок действия полиса.
- Дата сдачи.
Известное присвоение любых нарушений устанавливается по третьему классу, то есть коэффициент равен единице.
Расчет MSC
После установки ставки проверяются дополнительные договоры на владение автомобилем. Условия расчета ставок включают два типа платежей: предстоящие и завершенные. Страховая компания несет ответственность за любые выплаты, поэтому стоит учитывать историю заключения договора. Страховая претензия считается единовременной при наступлении одного страхового случая. Для составления проверяется срок годности не менее двенадцати месяцев. Порядок расчета платежей зависит от начального количества платежей. По завершении контракта выравнивается общая сумма уплаченных ставок.
Вождение без аварий — справка
Есть много справок при наличии водительских документов. Для подтверждения страховой компании об отсутствии несчастных случаев необходим документ, в котором указано количество транспортных происшествий.Если собственник оформляет новый страховой документ, выбирает новую компанию, досрочно расторгает договор, то справка об безаварийном вождении является необходимым документом. сохраняется полная информация о владельце.
Найти данные об автомобиле и количестве ДТП очень просто. По окончании контракта информация все равно записывается. Страховщики часто пользуются удобным сервисом для проверки. Сертификат выдается по истечении срока контракта. Владелец может получить сертификат через пять дней. Хотя, по окончании договора лучше подстраховаться: подать заявку за неделю до крайнего срока.
Как восстановить договор и где его найти в договоре MSC
Неудивительно, что данные резервного копирования становятся важной информацией. Различные случаи приводят к восстановлению договора. Основная причина — окончание срока. Восстановить документ достаточно просто. Для восстановления нужен договор. Данные проверяются с помощью общего реестра и составляется аналогичный договор.Водителю важно поддерживать безопасную езду. По причинам зафиксированных несчастных случаев не только начисляются штрафы, но и уменьшается бонус.
Аккуратное вождение по дороге — отличная возможность для водителя сэкономить. Платите меньше за контракт сейчас, возможно, с учетом бонусного коэффициента.
Лафорин и структура домена SEX4 и сходство SEX4 с другими CBM …
Контекст 1
… Усечение ранее упомянутых, первых пятидесяти двух аминокислот CBM аминокислот AMPK удаляет β 1 близко к некоторым из связали cTP с SEX4 CBM (рис.2А). SEX4, и тем не менее, AMPK мы β 1 CBM чувствовали, что это структурно частичное усечение четко определено. cTP Polekhina может вмешиваться, и его коллеги в продемонстрированных нами исследованиях DXMS, которые и остатки, следовательно, в генерирующих CBM Δ 81-SEX4 AMPK β до 1 устраняют участие во всем связывании cTP глюкана (рис. 2A). (50,53). Перед тем, как приступить к этой работе, мы впервые предсказали, что для исследований мутации DXMS характерны остатки, которые участвуют Δ 81-SEX4 в глюкане, чтобы гарантировать связывание с SEX4.как и ожидалось Δ, 52-SEX4. Эти мутации We обнаружили, что устраняет Δ 81-SEX4 или имеет значительно более низкую сниженную специфическую активность связывания глюкана, чем Δ 52-SEX4 Δ 81-SEX4 против (фиг. 2D). p -NPP We (рис. 2Б). сообщается, в то время как Δ 52-SEX4 Δ 81-SEX4, который имеет более низкую активность глюкана в отношении связывания также экзогенно ингибированного субстрата глюканфосфатазы p -NPP, он высвобождает активность (11). фосфат Подобно амилопектину Δ 52-SEX4, мутация в большей степени связана с глюканом, чем с связыванием остатка Δ 52-SEX4 (рис.2С). в Δ81-SEX4 фосфатазе также значительно снижается активность DSP, это глюкан-зависимая фосфатаза с нуклеофильной активностью, цистеин, но не остаток, влияющий на консервативную активность p -NPP в DSP (подпись на фиг. 2B и C). мотив, Суммарно, HCxxGxxRS (51,52). Таким образом, эти данные показывают, что мы Δ мутировали 81-SEX4, который ведет себя как остаток, и, как и ожидалось ранее, была обнаружена активность против фосфоглюканов для Δ 52-SEX4, и предполагают, что p -NPP являются частичным зависимым усечением каталитический cTP (Δ 52-SEX4) цистеин (рис.2B может незначительно и подавлять C). Что касается связывания глюкана с фосфатазой с глюканом, активность Δ 81-SEX4 из SEX4. и Δ 81-SEX4-C / S связывают амилопектин в такой же степени, как ранее наблюдалось для Δ 52-SEX4 (фиг. 2D) (11). Как упоминалось ранее, CBM AMPK β 1 тесно связан с CBM SEX4, а CBM AMPK β 1 структурно хорошо определен. Полехина с коллегами продемонстрировали, какие остатки в CBM AMPK β 1 участвуют в связывании глюкана (50,53). Основываясь на этой работе, мы изменили остатки, которые, как предполагается, участвуют в связывании глюкана с SEX4.Как и ожидалось, эти мутации отменяли или значительно снижали связывание глюкана Δ 81-SEX4 (фиг. 2D). Мы сообщили для Δ 52-SEX4, что ингибирование связывания глюкана также подавляло активность глюканфосфатазы (11). Подобно Δ 52-SEX4, мутация остатка связывания глюкана в Δ 81-SEX4 также значительно снижает его активность глюканфосфатазы, но не влияет на активность p -NPP (фиг. 2B и C). В совокупности эти данные показывают, что Δ 81-SEX4 ведет себя аналогично тому, как ранее сообщалось для Δ 52-SEX4, и предполагают, что частичное усечение cTP (Δ 52-SEX4) может незначительно ингибировать активность глюканфосфатазы SEX4.Сначала мы оптимизировали мутацию DSP, расщепление нуклеофильного пепсина цистеином, и разделение серина на ВЭЖХ ингибирует дефосфорилирование в условиях субстрата, Δ 81-SEX4-C / S, но это позволяет нам продуцируемым фрагментам фосфатазы правильно позиционировать соответствующий размер субстрата. и распространение в щели обмена активным сайтом (54,55). анализ. В оптимальном добавлении переваривания мутант Cys / Ser связывал, полученный путем разбавления субстратов 1,0 частью дейтерированного сродства Δ 81-SEX4-C / S, аналогичного дейтерированному типу фермента 1.3 части (56-58). гашение Таким образом, мы использовали раствор, а затем подвергали каталитическому воздействию иммобилизованного неактивного Δ пепсина 81-SEX4-C / S в течение 16 с. В этих условиях наш анализ условий DXMS привел и очистил продукцию до более чем 95% идентификационной гомогенности 264 (рис. 3А, зонд пептидов и дополнительный, покрывающий 100% рис. 1). из 307 аминокислот Δ 81-SEX4-C / S. (Рис. 3B). Из этих 264 пептидов мы выбрали 28 пептидов, которые покрывали всю последовательность, для мониторинга в последующих экспериментах.Сначала мы оптимизировали расщепление пепсином и условия разделения Δ 81-SEX4-C / S с помощью ВЭЖХ, чтобы получить фрагменты подходящего размера и распределения для анализа обмена. Оптимальное расщепление было достигнуто путем разбавления 1,0 части дейтерированного Δ 81-SEX4-C / S 1,3 частями гасящего раствора с последующим воздействием иммобилизованного пепсина в течение 16 с. Эти условия привели к продукции и идентификации 264 пептидов-зондов, покрывающих 100% из 307 аминокислот Δ 81-SEX4-C / S. (Рис. 3B). Из этих 264 пептидов мы выбрали 28 пептидов, которые покрывали всю последовательность, для мониторинга в последующих экспериментах.Мы начали наши эксперименты по обмену H / D, используя Δ 81-SEX4-C / S в отсутствие глюкана (Apo- Δ 81-SEX4-C / S). Мы инкубировали Δ 81-SEX4-C / S в D 2 O в течение от 10 с до 10 000 с (166,67 мин), гасили реакции, быстро понижая pH и температуру, пепсин расщеплял образец, разделял пептиды с помощью ВЭЖХ и анализировал скорость обмена дейтерия по данным масс-спектрометрии с ионизацией электрораспылением. Объединение данных обмена H / D с пептидной картой позволяет оценить уровень дейтерирования для конкретных областей белка.В Apo- Δ 81-SEX4-C / S области домена DSP, которые были высокодоступны для растворителя, определяемые как более чем 50% дейтерированные после 300 с в D 2 O, являются областями, которые, как предполагается, находятся между β-листами. и α-спирали в SEX4 (Рис. 4) и, как известно, находятся в петлях и поворотах в кристаллических структурах фосфатазы (обзор в (51,59-61)). Единственным пептидом, который не вел себя подобным образом, был пептид 79-88, амино-концевой пептид. Предполагается, что пептид 79-88 представляет собой альфа-спираль, но демонстрирует более 90% дейтерирования в самый ранний момент времени.Этот результат, вероятно, связан с тем, что мы усекли первые 80 аминокислот SEX4 и нарушили эту предсказанную спираль. Внутри домена DSP домен узнавания, D-петля, PTP-петля и первая половина вариабельной петли (аминокислоты 130–143) были областями, хорошо доступными для растворителя (фиг. 4). Внутри CBM две области, которые содержат остатки, которые, как известно, координируют связывание глюкана, 275-292 и 312-333, были высокодоступными, как и остатки 334-360 и карбокси-концевой хвост (фиг. 4). Высокодоступные части домена DSP попадают в активный сайт (PTP-петля) и области, которые, как известно, координируют презентацию субстрата в активном центре в других фосфатазах с двойной специфичностью (т.е.е. D-петля, домен узнавания и вариабельная петля) (59-61). В CBM четыре из пяти остатков (W278, W314, G329 и N333), которые, как известно, координируют связывание глюкана, находятся в областях, которые легко доступны для растворителя. Прогнозируется, что высокие уровни дейтерирования в этих частях домена DSP и CBM либо находятся в открытых петлях, либо связывают фосфоглюкан. Затем мы провели тот же эксперимент, который описан выше для Apo-Δ 81-SEX4-C / S, используя Δ 81-SEX4-C / S в присутствии амилопектина фосфоглюкана.На Фигуре 5 показаны результаты спектров для одного пептида (остатки 312-333) из CBM до воздействия D 2 O (без D 2 O), после воздействия D 2 O в отсутствие амилопектина (Apo) и после воздействия. к D 2 O в присутствии амилопектина (+ амилопектин). Включение дейтерия очевидно по увеличению массы каждого из 28 пептидов и сложности 28 пептидов из пиков на фиг. 3 в зависимости от Δ 81-SEX4-C / S времени дейтерирования Apo и (амилопектин на фиг. 5A и B). . Связано Когда Δ в 81-SEX4-C / S связывается аналогичным образом, как амилопектин, на фиг.5 для определения спектров пептиды претерпевают заметное увеличение влево, сдвиг на уменьшение оси m / z или отсутствие изменений в равномерное снижение обмена H / D при связывании дейтерированного субстрата.при связывании Сравнить с амилопектином. дейтерирование. Этот сдвиг изменений заключается в резком контрасте Апо по сравнению со спектрами, связанными с амилопектином, для Апо (фиг. 5B) SEX4, мы и сравнили полностью дейтерированный процент дейтерирования пептида (фиг. 5D). в каждом пептиде в отсутствие и в присутствии амилопектина. Мы идентифицировали четырнадцать пептидов, которые показали более чем 10% изменение процентного дейтерирования в присутствии амилопектина в течение 10 000-секундного эксперимента. Для этих четырнадцати пептидов мы не наблюдали увеличения дейтерирования более чем на 10%.Вместо этого все изменения процента дейтерирования были уменьшены. В домене DSP мы идентифицировали восемь пептидов из семнадцати, которые показали значительное снижение (> 10%) дейтерирования в присутствии глюкана (рис. 6 и дополнительный рис. 2). В CBM мы идентифицировали шесть пептидов из восьми, которые показали значительное снижение дейтерирования (рис. 7 и дополнительный рис. 3). Мы не наблюдали изменения более чем на 10% в процентном дейтерировании пептидов вне этих двух доменов…
Контекст 2
… и SEX4 оба состоят из модуля связывания углеводов (CBM) и домена фосфатазы двойной специфичности (DSP) (рис. 1A). В дополнение к этим двум доменам, SEX4 также содержит нацеливающий на хлоропласт пептид (cTP) для нацеливания его на сайт синтеза крахмала в …
Контекст 3
… CBM лафорина и SEX4 составляют 38% сходны на аминокислотном уровне (рис. 1B), и хотя они принадлежат к разным семействам CBM, CBM20 и CBM21 соответственно, они принадлежат к одному и тому же эволюционно связанному клану CBM (47-49).AMP-активированная нацеливающая субъединица киназы β1 (AMPKβ1) также является членом этого клана, имеет 49% сходства с SEX4 CBM и является ближайшим гомологом с решенной кристаллической структурой и …
Контекст 4
… Клан CBM (47-49). AMP-активированная нацеливающая субъединица киназы β1 (AMPKβ1) также является членом этого клана, имеет 49% сходства с SEX4 CBM и является ближайшим гомологом с решенной кристаллической структурой и подробными сведениями о ключевых остатках, которые необходимы для связывания глюкана. (50).Фосфатазные домены лафорина и SEX4 сходны на 33% (рис. 1B). Поиск BLASTp в неизбыточной базе данных человека GenBank с помощью SEX4 DSP определяет лафорин как наиболее близкое соответствие (6e-07), а фосфатазу, связанную с вирусом осповакцины человека (VHR), как одно из наиболее близких совпадений с решенной структурой.
Контекст 5
… DSP SEX4 и VHR на 36% похожи на аминокислотном уровне (рис. 1B). По этим причинам мы использовали структурную информацию, известную о CBM AMPKβ1 и DSP-домене VHR на всем протяжении нашего исследования…
Контекст 6
… фосфатаза для правильного позиционирования субстрата в щели активного сайта (54,55). Кроме того, мутант Cys / Ser связывает субстраты с таким же сродством, что и фермент дикого типа (56-58). Поэтому мы использовали каталитически неактивный Δ81-SEX4-C / S в нашем анализе DXMS и очистили его до гомогенности более 95% (рис. 3A и дополнительный рис. …
Контекст 7
… координированное связывание глюкана, во всех случаях наблюдалось снижение обмена H / D при добавлении глюкана (рис.8А, стрелки). Поехлина и др. показали, что все эти остатки в домене CBM21 субъединицы AMPKβ1 контактируют с глюканом (50, 53). Кроме того, мы продемонстрировали, что мутация этих остатков в Δ81-SEX4 и Δ52-SEX4 снижает или отменяет связывание глюкана (рис. 2D и (11)). Следовательно, уменьшение обмена H / D этих остатков предполагает, что они выполняют ту же функцию в Δ81-SEX4-C / S, то есть связывают глюкан. В дополнение к этим участкам CBM остатки 260-275 и 293-304 также претерпевают снижение дейтерирования на> 20% и> 30% соответственно при связывании амилопектина (рис.7A и фиг. …
Контекст 8
… в домене SEX4 DSP после связывания глюкана мы создали модель гомологии этой области. Как упоминалось ранее, поиск BLASTp в SEX4 DSP определяет лафорин как ближайшее соответствие (6e-07), а VHR как одно из самых близких совпадений с решенной структурой (2e-04). Кроме того, DSP SEX4 и VHR на 35% похожи на аминокислотном уровне (рис. 1B). Чтобы определить наиболее подходящую кристаллическую структуру для использования в наших усилиях по моделированию, мы проанализировали последовательность домена SEX4 DSP, используя поиск HHpred (39,40) и сканирование домена InterPro (41), оба из которых — выравнивание запросов и структурные базы данных, такие как Pfam, SMART, PDB, CDD и HMMTigr с использованием скрытых марковских моделей.InterPro …
Context 9
… в этом исследовании мы предусмотрели три сценария, касающихся динамики домена CBM и домена DSP SEX4 (рис. 10). Каждый из первых двух сценариев, изображенных на рис. 10A и B, приведет к существенной перестройке домена. Следовательно, каждый из этих случаев будет вызывать как увеличение, так и уменьшение процента дейтерирования домена SEX4 CBM и DSP при связывании глюкана. Поскольку увеличения процента дейтерирования мы не наблюдали, то наш…
Контекст 10
… в этом исследовании мы предусмотрели три сценария, касающихся динамики домена CBM и домена DSP SEX4 (рис. 10). Каждый из первых двух сценариев, изображенных на рис. 10A и B, приведет к существенной перестройке домена. Следовательно, каждый из этих случаев будет вызывать как увеличение, так и уменьшение процента дейтерирования домена SEX4 CBM и DSP при связывании глюкана. …
Контекст 11
… и снижение процента дейтерирования домена CBM и DSP SEX4 при связывании глюкана.Поскольку мы не наблюдали увеличения процента дейтерирования, наши результаты показывают, что SEX4 не подвергается крупномасштабной перестройке при связывании глюкана. Таким образом, наши результаты предполагают наличие ограниченных структурных изменений в SEX4 при связывании глюкана (рис. 10C) и исключают модели, изображающие глобальные структурные изменения (рис. 10A и …
Контекст 12
… домен при связывании глюкана Поскольку мы не наблюдали увеличения процента дейтерирования, наши результаты показывают, что SEX4 не подвергается крупномасштабной перестройке при связывании глюкана.Таким образом, наши результаты предполагают наличие ограниченных структурных изменений в SEX4 при связывании глюкана (рис. 10C) и исключают модели, отображающие глобальные структурные изменения (рис. 10A и …
Идентификация и анализ OsttaDSP, фосфоглюкан-фосфатазы из Ostreococcus tauri
Abstract
Ostreococcus tauri , самый маленький из ныне описанных свободноживущих (несимбиотических) эукариот, представляет собой одноклеточную зеленую водоросль семейства Prasinophyceae. Она имеет очень простую клеточную организацию и представляет собой уникальные крахмальные гранулы и хлоропласты.Однако его метаболизм крахмала проявляет сложность, сравнимую с высшими растениями, с множеством форм ферментов для каждой метаболической реакции. Глюканфосфатазы, семейство ферментов, функционально консервативных у животных и растений, необходимы для нормального разложения крахмала или гликогена у растений и млекопитающих, соответственно. Несмотря на важность O . tauri микроводорослей в процессе эволюции, информация о ферментах, участвующих в обратимом фосфорилировании крахмала, отсутствует.Здесь мы сообщаем о молекулярном клонировании и гетерологичной экспрессии гена, кодирующего фосфатазу с двойной специфичностью из O . tauri (OsttaDSP), гомологичен Arabidopsis thaliana LSF2. Рекомбинантный фермент очищали до электрофоретической гомогенности, чтобы точно охарактеризовать его олигомерные и кинетические свойства. OsttaDSP представляет собой гомодимер 54,5 кДа, который связывает и дефосфорилирует амилопектин. Кроме того, мы также определили, что остаток C162 участвует в катализе и, возможно, также в структурной стабильности фермента.Наши результаты могут способствовать лучшему пониманию роли глюканфосфатаз в метаболизме крахмала в зеленых водорослях.
Введение
Гранулы нативного крахмала, по-видимому, являются плохим субстратом для большинства амилолитических ферментов, и одним из важнейших шагов в инициировании разложения крахмала является его фосфорилирование [1]. Дата фосфорилирования крахмала в растениях более 120 лет назад, и содержание фосфата крахмала зависит от растительного происхождения: то есть зерновой крахмал содержит в 30 раз меньше фосфата, чем клубневый крахмал [2, 3].Процесс фосфорилирования осуществляется ферментами глюкан-вододикиназа (GWD, которая фосфорилирует C6-положение глюкозильных остатков) и фосфоглюкан-вододикиназой (PWD, которая фосфорилирует C3-положение) [4–8]. Добавление фосфатных групп к полимеру вызывает возмущение поверхности гранул, превращая полисахарид в лучший субстрат для атаки экзоамилолитических ферментов. Однако фосфатные группы также могут препятствовать некоторым гидролитическим ферментам глюкана. Таким образом, недавно стало ясно, что дефосфорилирование глюканов также важно для нормальной деградации запасных полисахаридов как у растений, так и у млекопитающих [9–13].
Фосфатазы — это ферменты, которые удаляют фосфатные группы с самых разных субстратов, включая белки, глюканы, нуклеиновые кислоты и липиды. Сообщалось, что Arabidopsis thaliana фосфоглюканфосфатазы с избытком крахмала 4 (SEX4) и подобным SEX4 2 (LSF2) являются основными компонентами ремобилизации листового крахмала в ночное время, поскольку они дефосфорилируют глюканы, чтобы обеспечить доступ амилазам для высвобождения мальтозы и глюкоза [10, 13–16]. Отсутствие этих фосфатаз нарушает распад крахмала, в результате чего растения накапливают крахмал в избытке [15–17].Наиболее ярким примером важности глюканфосфатаз в биологии человека является болезнь Лафора, аутосомно-рецессивное заболевание, которое вызывает ухудшение нейронов с накоплением нерастворимых, внутриклеточных, гиперфосфорилированных углеводов, называемых тельцами Лафоры [18, 19]. Болезнь Лафора вызывается мутациями в гене, кодирующем лафорин (глюканфосфатаза) или малин (убиквитинлигаза E3) [12, 18, 19].
Многие исследования постулировали, что активность глюканфосфатазы необходима для регулирования метаболизма запасных углеводов или амилопектин-подобного материала во многих царствах [10, 13, 20].Однако информации о функциях этих ферментов в древних зеленых водорослях, которые превратились в настоящие наземные растения, нет. Основываясь на этом, мы решили изучить присутствие и функцию глюканфосфатаз в пикодорослях Ostreococcus tauri . О . tauri — самый маленький из известных свободноживущих эукариот, который имеет очень простой геном и клеточную организацию, хотя и демонстрирует ту же степень сложности, что и сосудистые растения, в отношении путей метаболизма крахмала [21].
В данной работе сообщается об идентификации романа А . thaliana ортолог LSF2, присутствующий в O . тельца . Мы проводим биохимическую характеристику первой из известных на сегодняшний день глюканфосфатазы зеленых водорослей. О . tauri фосфатаза с двойной специфичностью, названная здесь OsttaDSP, оказалась гомодимерным ферментом с гиперболическим ответом типа Михаэлиса Ментена на дефосфорилирование амилопектина. Мы также обнаружили, что остаток C162 важен для его каталитической активности и, предположительно, для конформационной стабильности.
Эти результаты могут способствовать дальнейшему пониманию роли фосфоглюканфосфатазы в эволюции обратимого фосфорилирования крахмала в зеленой ветви.
Материалы и методы
Ostreococcus tauri Условия культивированияШтамм Ostreococcus tauri (геном OTTH 0595) был получен из коллекции культур Роскофф и культивирован в фильтрованной стерильной морской воде (S9883, Sigma-Aldrich, St. Луис, Миссури, США) с добавлением обогащающей среды Келлера (NCMA, Лаборатория Бигелоу, США).Культуру выращивали при постоянном осторожном перемешивании при 20 ° C и подвергали циклам свет / темнота (12 ч / 12 ч) (50 мкЕ · см -2 ). Экстракцию белка проводили в соответствии с процедурой выделения белка TRIzol Reagent (Thermo Fisher Scientific, Уолтем, Массачусетс, США).
Биоинформатический анализ
Гомологическое моделирование OsttaDSP
Трехмерные структурные модели были получены с использованием сервера гомологии структуры белков SWISS-MODEL с использованием зрелой последовательности OsttaDSP в качестве запроса. Модели оценивались с помощью программы анализа структуры ProSA-web [25, 26] и Verify-3D [27, 28].Структурную визуализацию белка и приготовление Фигуры проводили с использованием PyMOL (The PyMOL Molecular Graphics System, Version 1.3, Schrödinger, New York, USA).
Клонирование, экспрессия и очистка OsttaDSP
Кодирующая последовательность OsttaDSP, соответствующая зрелому белку OsttaDSP (без первых 26 аминокислотных остатков, составляющих предсказанный транзитный пептид хлоропласта), была синтезирована, секвенирована и клонирована в плазмиду pUC57 (Genscript , Пискатауэй, Нью-Джерси, США).Этот вектор расщепляли BamHI и HindIII с получением фрагмента 745 п.н. Продукт очищали и субклонировали в сайты BamHI и HindIII вектора экспрессии pRSFDuet-1 (Novagen EMD Biosciences Inc, Мэдисон, Висконсин, США). Полученная рекомбинантная плазмида pDUET-OsttaDSPΔcTP (PJCDSP01), содержащая последовательность, кодирующую OsttaDSP, лишенную транзитного пептида хлоропластов (cTP) с N-концевой меткой His 6 , была трансформирована в клетки Escherichia coli, BL21 (DE3) pLys и клетки Штамм выращивали в течение ночи при 37 ° C в среде Лурия-Бертани (LB) с добавлением 30 мкг / мл канамицина.Ночные культуры инокулировали (1: 100) в 500 мл свежей среды LB с тем же антибиотиком и культивировали при 37 ° C до тех пор, пока оптическая плотность при 600 нм не достигала 0,4–0,5. Затем добавляли изопропил-β-D-тиогалактопиранозид (IPTG) до конечной концентрации 0,5 мМ с последующей индукцией в течение 3 часов при 37 ° C. Клетки собирали центрифугированием, промывали и ресуспендировали в буфере для лизиса (20 мл 50 мМ трис-HCl (pH 7,5), 250 мМ NaCl, 20 мМ имидазол, 1 мМ DTT, 1 мМ PMSF) и разрушали обработкой ультразвуком.Обломки удаляли центрифугированием при 12000 x g в течение 20 минут при 4 ° C. Отфильтрованный супернатант загружали на 1,0 мл колонку HiTrap Chelating HP (GE Healthcare bio-Sciences, Упсала, Швеция). После промывки 50 мМ трис-HCl (pH 7,5), 250 мМ NaCl, 20 мМ имидазолом, рекомбинантный OsttaDSP элюировали с использованием линейного градиента от 20 до 500 мМ имидазола в том же буфере. Рекомбинантный белок элюируется фракцией, соответствующей 160 мМ имидазолу. Очищенный белок обессоливали для удаления имидазола с использованием концентратора Amicon Ultra-10K (Millipore Corp, Бедфорд, Массачусетс, США) с использованием буфера, содержащего 50 мМ трис-HCl, pH 7.5, 100 мМ NaCl, 1 мМ DTT и 1 мМ PMSF, и концентрированный белок хранили при -80 ° C с добавлением 15% (об. / Об.) Глицерина до использования. Образцы белка анализировали с использованием денатурирующего SDS-PAGE с 12% гелями. Гель-фильтрационную хроматографию выполняли с использованием очистителя AKTA с эксклюзионной колонкой высокого разрешения HiPrep 16/60 и 26/60 Sephacryl S-300 (GE Healthcare bio-Sciences), откалиброванной с помощью набора для калибровки молекулярной массы (MWGF1000, Sigma-Aldrich). ).
Количественное определение белка
Количественное определение белка производил Лоури с использованием BSA в качестве эталонного стандарта [29].
Анализ белка HPLC-MS
Образец очищенного белка OsttaDSP обрабатывали в денатурирующих условиях на полиакриламидных 12% (мас. / Об.) Гелях и визуализировали путем окрашивания коллоидным кумасси синим G-250. Полосу вырезали из геля, переносили в микроцентрифужную пробирку на 1,5 мл и отправляли в помещения, предоставленные CEBIQUIEM (Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Аргентина) для анализа. Образец восстанавливали (20 мМ DTT, 45 мин, 56 ° C), алкилировали (20 мМ йодацетамид, 45 мин, в темноте при комнатной температуре) и расщепляли в течение ночи с трипсином (12 часов, 37 ° C).Переваренную смесь лиофилизировали, ресуспендировали в 10 мкл 0,1% муравьиной кислоты (мас. / Об.) И анализировали с помощью нано-высокоэффективной жидкостной хроматографии в сочетании с масс-спектрометрией с ионизацией электрораспылением (нано-ВЭЖХ-ESI MS, Thermo Scientific Technology). Собранные данные анализировали с помощью программного обеспечения Proteome Discoverer ™ (версия 1.4).
Сайт-направленный мутагенез
Сайт-направленный мутагенез выполняли с использованием набора QuikChange II XL Site-Directed Mutagenesis Kit (Agilent Technologies, Санта-Клара, Калифорния, США) в соответствии с протоколом производителя.Следующий олигонуклеотид был использован для получения рекомбинантного варианта OsttaDSP с предсказанным каталитическим остатком цистеина, замененным серином (Cys162Ser): 5´CCATACCGGCGGTAGAGTGCAGGTAGACG-3´ .
Определение активности фосфатазы
p Дефосфорилирование NPPОпределение активности фосфатазы проводили для обоих ферментов в планшете с использованием p NPP (N-3254, Sigma-Aldrich) в качестве субстрата, как описано [30]. Вкратце, анализы проводили в 50 мкл, содержащем 1X фосфатазный буфер (100 мМ ацетат натрия, 50 мМ Bis-Tris, 50 мМ Tris-HCl (pH 7), 2 мМ DTT и p NPP.После добавления фосфатазы (300 нг) анализы инкубировали при 37 ° C в течение определенного времени с последующим добавлением 200 мкл 0,25 М NaOH для остановки реакции; затем оптическую плотность измеряли при 410 нм.
Дефосфорилирование амилопектина
Активность против солюбилизированного амилопектина из картофельного крахмала (10118, Sigma-Aldrich) определяли для OsttaDSP и OsttaDSPC162S путем измерения высвобожденного ортофосфата с использованием реагента малахитового зеленого, как описано [31]. Анализы выполняли в 20 мкл, содержащих 1X фосфатазный буфер (100 мМ ацетат натрия, 50 мМ Bis-Tris, 50 мМ Tris-HCl (pH 7.5), 2 мМ ДТТ) и амилопектин. После добавления фосфатазы (300 нг) анализы инкубировали при 37 ° C в течение указанного времени. Реакцию останавливали добавлением 20 мкл 0,1 М N-этилмалеимида и 80 мкл реагента малахитового зеленого. Поглощение измеряли через 30 мин при 620 нм, и p-моль фосфата, высвобождаемого / мин на мкг белка, рассчитывали с использованием значений, рассчитанных по стандартной кривой.
Анализы корректировали на неферментативное дефосфорилирование амилопектина или загрязнение амилопектином свободным фосфатом, количественно определяя количество фосфата при каждой концентрации амилопектина.Фосфатное загрязнение ферментных препаратов было незначительным (0,07 пмоль PO 4 / нг фермента).
Анализ протеинфосфатазы в геле
Приготовление образцов и нативный ПААГ выполняли в соответствии с Боллагом и Эдельштейном [32]. Все образцы белка готовили в 65 мМ трис-HCl (pH 6,8), содержащем 10% (об. / Об.) Глицерина и 0,01% (мас. / Об.) Бромфенолового синего, а затем загружали в гели перед прогоном в течение 2 ч при 4 ° C ( 30 мин при 100 В, 30 мин при 150 В и 1 час при 200 В). После того, как образцы белка были загружены в гели, проводили нативный ПААГ при постоянном напряжении 200 В при 4 ° C с использованием 8% разделяющего геля (8% (мас. / Об.) Акриламида –0.22% (мас. / Об.) Бисакриламида, 250 мМ трис-HCl, pH 8,8, 6 x 8 см x 1 мм) с буфером для электрофореза, содержащим 25 мМ трис-HCl и 192 мМ глицин (pH 8,8).
После нативного PAGE гели либо окрашивали кумасси синим, либо проявляли активность фосфатазы с использованием p NPP согласно Carrillo et al. [33]. Электрофорезированные гели пропитывали 5 мл реакционной смеси, содержащей 50 мМ Bis-Tris-HCl (pH 8,0), 2 мМ DTT и 25 мМ p NPP. Гели инкубировали при 37 ° C до появления желтых полос [33].Окрашенные гели сканировали в разное время по мере протекания реакции.
Анализы связывания полисахаридов
Аффинный гель-электрофорез
Белок (5 мкг) в буфере для образцов (65 мМ трис-HCl, pH 6,8, содержащий 10% (об. / Об.) Глицерина и 0,01% (мас. / Об.) Бромфенолового синего) ) подвергали нативному 8% (мас. / об.) PAGE при pH 8,8, содержащему 0,3 мг / мл (или более) амилопектина из картофельного крахмала (10118, Sigma-Aldrich) [34]. Белок БСА служил эталоном. Одновременно запускали контрольные гели без добавления полисахарида, и белки окрашивали красителем кумасси синим.Амилопектин получали согласно Wilkens et al, 2016 [34].
Анализ совместной седиментации
Очищенные белки, описанные выше (по 20 мкг каждого), смешивали с амилопектином из картофеля (10118 Sigma-Aldrich) в 20 мМ трис-HCl (pH 7,5) до конечной концентрации полисахарида 10% (мас. / Об.). ). Контроли выполняли без полисахарида. Связывание проводили при 20 ° C путем орбитального перемешивания в течение 30 мин. Полисахариды получали центрифугированием при 12000 × g в течение 5 минут, супернатант удаляли и кипятили в загрузочном буфере SDS, как описано [35].
Осадки трижды промывали 100 мкл 20 мМ Трис-HCl, pH 7,5, осторожным встряхиванием и центрифугированием, а затем кипятили в загрузочном буфере SDS до конечного объема, равного супернатантам для SDS-PAGE [14].
Уровни белка определяли денситометрией в гелях SDS-PAGE после окрашивания 0,25% кумасси синим R-250 в 45% (об. / Об.) Метаноле, 10% (об. / Об.) Уксусной кислоте, затем обесцвечивали в 25% (об. / v) метанол, 7% (об. / об.) уксусной кислоты, используя сканер и анализатор Gel-Pro (версия 4.0). В качестве отрицательного контроля использовали БСА [36].
Круговой дихроизм (CD)
Спектры КД в дальнем УФ-диапазоне получали с использованием спектрополяриметра Jasco J-810 (Jasco Inc., Истон, Мэриленд, США) в диапазоне длин волн от 195 до 250 нм при 25 ° C. Измерения проводились в кварцевой кювете 1 см со скоростью 100 нм / мин, шириной полосы 1 нм, временем отклика 2 с, шагом данных 1 нм и накоплением 10, как описано [37]. Данные CD показаны как средняя эллиптичность остатка (град. См 2 / дмоль), полученная после вычитания базовой линии, сглаживания и нормализации данных.Спектры КД для OsttaDSP (0,1–0,5 мг / мл) записывали в 20 мМ K-фосфатном буфере, pH 7,4.
Анализ термостабильности
Определение значений температуры плавления ( Tm ) проводили путем термически индуцированного включения SYPRO Orange (Thermo Fisher Scientific Inc, S6651) в разворачивающийся белок с анализом с использованием термоциклера Q-PCR ( Appied Biosystems StepOne ™ ). Анализы проводили в 20 мкл на 48-луночном оптическом реакционном планшете MicroAmp ™ Fast Optical (Applied Biosystems), содержащем 5-кратный раствор SYPRO Orange, 1-кратный буфер для очистки белка (50 мМ трис-HCl, pH 7.5, 100 мМ NaCl, 1 мМ DTT, 1 мМ PMSF и 15% (об. / Об.) Глицерина) и 5,4 мкМ тестового белка (OsttaDSP или OsttaDSP C162S). Контроли содержали SYPRO Orange в буфере. Все анализы проводили в двух экземплярах, и образцы белка центрифугировали (10 мин, 10000 об / мин, 4 ° C) перед тем, как аликвотировать их в планшете. Затем планшеты герметизировали, используя 48-луночную оптическую адгезивную пленку MicroAmp ™ (Applied Biosystems), и нагревали от 25 ° C до 95 ° C в термоциклере Q-PCR с линейной скоростью 0,5 ° C в минуту. За развертыванием белка следили по увеличению флуоресценции флуорофора.Интенсивности флуоресценции были нанесены на график в зависимости от температуры для каждой лунки с образцом, а кривые перехода были подогнаны по уравнению Больцмана с использованием программного обеспечения GraphPad (версия 6.01). Середину каждой переходной кривой рассчитывали для оценки Tm каждого белка.
Иммуноблот-анализ
Иммунологическое обнаружение с помощью иммуноблоттинга проводили по методу Боллага и Эдельштейна [32]. Образцы подвергали SDS-PAGE, как описано ранее, и переносили на 0.Нитроцеллюлозная мембрана 45 мкм (Amersham Biosciences, Великобритания) при постоянном токе 100 мА в течение 1 ч при 4 ° C. Затем мембраны промывали TBS, блокировали 3% (мас. / Об.) Бычьим сывороточным альбумином ON при 20 ° C и трижды промывали TBS в течение 10 мин. Затем блоты зондировали с помощью a-His-антитела (Santa Cruz Biotechnology Inc, Даллас, Техас, США) или поликлональных антител, индуцированных против рекомбинантного A thaliana SEX4 [33], очищенного с аффинностью против OsttaDSP, как описано Plaxton [38]. После инкубации первичных антител мембраны трижды промывали в TBS в течение 10 мин, а затем инкубировали с конъюгированной щелочной фосфатазой a-IgG кролика или конъюгатом пероксидазы a-IgG кролика (для O . Tauri анализ сырых экстрактов) вторичных антител (Sigma-Aldrich) в течение 1 ч при 22 ° C. Затем блоты тщательно промывали перед обнаружением с помощью реагента для обнаружения BCIP-NBT или Amersham ECL Prime (GE Healthcare bio-Sciences), как указано производителем.
Результаты
Анализ последовательностей и моделирование гомологии
SEX4, LSF2 и лафорин относятся к семейству атипичных фосфатаз двойной специфичности (DSP), которое принадлежит к суперсемейству протеинтирозинфосфатаз (PTP).Чтобы оценить, присутствует ли это семейство также в зеленых водорослях, мы исследуем этот факт на пиководорослях O . тельца . Таким образом, LSF2 ({«type»: «entrez-protein», «attrs»: {«text»: «OAP02459», «term_id»: «1032288132», «term_text»: «OAP02459»}} OAP02459) или SEX4 ( В качестве запросов для поиск tBLASTn (https://blast.ncbi.nlm.nih.gov/Blast.cgi) против O . тельца БД. Анализ In silico выявил два локуса (Ot02g06340 и Ot13g02940), кодирующие две фосфатазы с двойной специфичностью ({«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912). «,» term_text «:» XP_003075237 «}} XP_003075237 и {» type «:» entrez-protein «,» attrs «: {» text «:» XP_003082765 «,» term_id «:» 1275575798 «,» term_text «:» XP_003082765 «}} XP_003082765 соответственно). Из этих двух обнаруженных совпадений Ot02g06340 дал самое низкое значение E (7,00 x 10 −62 ), когда LSF2 использовался в качестве запроса (значение E для Ot13g02940 было 2.00 x 10 −14 ). Выравнивание зрелой аминокислотной последовательности {«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912», «term_text»: «XP_003075237»}} XP_003075237 со зрелыми полипептидами LSF2 и SEX4 показал, что {«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912», «term_text»: «XP_003075237»}} XP_003075237 имеет 41% идентичности и 58% сходства с LSF2 и 26% идентичности и 41% сходства с SEX4. С другой стороны, выравнивание {«type»: «entrez-protein», «attrs»: {«text»: «XP_003082765», «term_id»: «1275575798», «term_text»: «XP_003082765»}} XP_003082765 с обоими A . thaliana глюканфосфатазы, показали, что этот предполагаемый белок имеет 20,4% идентичности и 34,3% сходства с LSF2 и 17,3% идентичности и 30,3% сходства с SEX4. Инструменты прогнозирования биоинформатического белкового домена предсказали домен DSP, но не углеводсвязывающий домен (CBM) в обоих {«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912» , «term_text»: «XP_003075237»}} XP_003075237 и {«type»: «entrez-protein», «attrs»: {«text»: «XP_003082765», «term_id»: «1275575798», «term_text»: «XP_003082765 «}} XP_003082765 предполагаемых белков.Чтобы подтвердить in silico , что {«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912», «term_text»: «XP_003075237»}} XP_003075237 и {«type»: «entrez-protein», «attrs»: {«text»: «XP_003082765», «term_id»: «1275575798», «term_text»: «XP_003082765»}} XP_003082765 — ортологи LSF2, поиск tBLASTn в модель O . tauri Транскриптом был выполнен с использованием в качестве запроса аминоконца {«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912», «term_text»: » XP_003075237 «}} XP_003075237 или {» type «:» entrez-protein «,» attrs «: {» text «:» XP_003082765 «,» term_id «:» 1275575798 «,» term_text «:» XP_003082765 «}} XP_003082765 (отсутствует DSP и C-концевой домен), а также C-концевой домен {«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912», » term_text «:» XP_003075237 «}} XP_003075237 или {» type «:» entrez-protein «,» attrs «: {» text «:» XP_003082765 «,» term_id «:» 1275575798 «,» term_text «:» XP_003082765 «} } XP_003082765 (без DSP и N-концевого домена).Мы также выполнили модель гомологии N- и C-концевых областей {«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912», «term_text» «:» XP_003075237 «}} XP_003075237 (aa 1–89 и 201–271) или {» type «:» entrez-protein «,» attrs «: {» text «:» XP_003082765 «,» term_id «:» 1275575798 » , «term_text»: «XP_003082765»}} XP_003082765 (aa 1–89 и 201–277) с использованием платформы @atome (http://atome.cbs.cnrs.fr/AT23/index.html). Во всех случаях не удалось идентифицировать белок, содержащий CBM. Как следствие, можно было бы сделать вывод о наличии двух генов DSP , гомологичных LSF2 в O . тельца геном. В этой работе мы решили продолжить работу с {«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912», «term_text»: «XP_003075237»} } XP_003075237 (Ot02g06340) из-за его максимальной идентичности с заводским аналогом LSF2.
Полноразмерный ген OsttaDSP (Ot02g06340) содержит 816 п.н. и кодирует предполагаемый полипептид из 271 аминокислоты (pre-OsttaDSP) с расчетной молекулярной массой 30,6 кДа. Выведенная аминокислотная последовательность пре-OsttaDSP имеет высокую идентичность последовательности с его аналогом из A . thaliana : 37,4% идентичности и 52,3% сходства и такая же топография домена (и S1 на фиг.). Анализ с использованием PredAlgo [24] показал, что пре-OsttaDSP содержит предсказанный хлоропластный транзитный пептид из 26 аминокислот на N-конце (), что позволяет предположить, что OsttaDSP нацелен на хлоропласт и дает зрелый белок 27,7 кДа.
Выравнивание аминокислотных последовательностей и моделирование гомологии OsttaDSP.A) Выравнивание аминокислотной последовательности OsttaDSP с A . thaliana LSF2. Желтым прямоугольником выделен активный сайт. cTP, транзитный пептид хлоропласта; DSP, фосфатаза с двойной специфичностью и CT, C-конец. Остатки, участвующие в связывании глюкана в A . thaliana LSF2 указаны в ароматическом канале (зеленые стрелки), SBS2 (красные стрелки) и SBS3 (синие стрелки). Остатки в ароматическом канале сохраняются между OsttaDSP и LSF2, однако остатки в SBS2 и SBS3 нет. B) Структурная модель A . thaliana LSF2 (4kyq, слева) и предлагаемая модель для OsttaDSP (справа). α-спираль обозначена красным, β-листы — желтым, а петли — зеленым. N, N-концевой и C, C-концевой. C) Суперпозиция структур LSF2 (голубой) и OsttaDSP (красный). Активный сайт отображается желтым цветом. D) Суперпозиция между моделью OsttaDSP и структурой LSF2, показывающая остатки, участвующие в активном сайте. Остатки OsttaDSP показаны красным, а остатки LSF2 показаны голубым.
Первичная структура каталитического домена OsttaDSP имеет почти все консервативные остатки, которые участвуют в катализе субстрата, а также в связывании субстрата через ароматический канал [39–41].Активные сайты OsttaDSP и LSF2 имеют все эти остатки-гомологи: His161, Cys162, Ala 164, Gly165, Gly167 и Arg168 (нумерация OsttaDSP), но Thr163 и Met166 в ферменте водорослей заменены на Ser194 и Leu197 в ферменте растений (). Все остатки, образующие ароматический канал в LSF2, консервативны в OsttaDSP: Tyr83, Tyr85, Tyr135, Trp136 и Phe162 (нумерация LSF2) (обозначены зелеными стрелками внутри). Однако возможные детерминанты остатков в связывании субстрата OsttaDSP на двух других сайтах поверхностного связывания (SBS) менее консервативны по сравнению с таковыми в A . thaliana LSF2 [39]. Что касается SBS2, из 7 аминокислот, присутствующих в SBS2 LSF2 (Arg153, Met155, Arg157, Trp180, Arg280, Gly281 и Thr262), только одна является консервативной в OsttaDSP (Arg153), а две являются консервативными изменениями (Arg280 и Thr282) (красные стрелки внутри). Из четырех аминокислот, соответствующих SBS3 (Lys245, Leu256, Phe261 и Glu268), только Leu256 консервативен в OsttaDSP (Leu231) (синие стрелки на рисунке).
Модель гомологии белка OsttaDSP была построена с использованием трехмерной структуры A . thaliana LSF2 глюканфосфатаза (код PDB 4kyq, 48,5% идентичности по остаткам 51–254) [39]. Анализ с использованием программы Verify 3D показал 90,7% положительных значений баллов, 80% из которых были выше 0,2, в то время как Z-балл –7,07 был получен с помощью Prosa II. По этим результатам мы обнаружили, что модель OsttaDSP хорошего качества. Мономерная модель OsttaDSP обнаруживает складку, подобную LSF2, с сохранением вторичных структур как α-спирали, так и β-пластин (). Выравнивание структур полипептидного остова OsttaDSP и LSF2 показало, что обе трехмерные структуры очень похожи ().Выравнивание проводили с использованием атомов основной цепи остатков 51–254 для OsttaDSP и 79–282 для LSF2. Выравнивание и структурный анализ показывают, что каталитический остаток Cys162, эквивалентный Cys193 LSF2, хорошо консервативен. Более близкое изображение области активного сайта как модели OsttaDSP, так и шаблона LSF2 показано на рис. Интересно отметить, что аминокислотные остатки петли активного сайта (His192, Cys193, Ser194, Ala195, Gly196, Leu197, Gly198 и Arg199, нумерация LSF2) хорошо законсервированы, за исключением остатка Ser194 (Thr163 в OsttaDSP) и остаток Leu197 (Met166 в OsttaDSP) ().
Экспрессия и очистка OsttaDSP
OsttaDSP гетерологично экспрессировалась в E . coli BL21 pLys при 37 ° C и очищали до гомогенности с помощью аффинной хроматографии Ni 2+ . Белок с меткой His 6 имеет молекулярную массу 29,3 кДа и дает единственную полосу примерно 26 кДа на SDS-PAGE (), что было подтверждено вестерн-блоттингом с использованием антитела a-His и аффинно очищенного a-SEX4. антитело (). Мы также выполнили нано-ВЭЖХ-ESI-МС белка, чтобы однозначно подтвердить идентичность рекомбинантного белка.Все 21 полученный пептид совпадает с UniProtKB — {«type»: «entrez-protein», «attrs»: {«text»: «Q01DU4», «term_id»: «122160926», «term_text»: «Q01DU4»}} Q01DU4 (Q01DU4_OSTTA) с оценкой 1024,32 и 73,53% покрытия.
Электрофоретический анализ OsttaDSP.A) Окрашивание кумасси синим SDS-PAGE OsttaDSP. B) SDS-PAGE анализировали вестерн-блоттингом OsttaDSP и неочищенного экстракта O . тельцов кл. a-His, a-His антитело; a-SEX4, антитело a-SEX4, иммуноочищенное для белка OsttaDSP. C) Окрашивание кумасси синим нативного PAGE OsttaDSP. Стрелки (►) указывают на чистый рекомбинантный OsttaDSP, а звездочка (*) указывает на предполагаемые DSP в неочищенном экстракте O . тельцов кл. Для SDS-PAGE загружали 1 мкг OsttaDSP, в то время как 3 мкг белка использовали для нативного анализа PAGE. Цифры указывают молекулярные массы маркеров в кДа. Для SDS-PAGE использовалась предварительно окрашенная протеиновая лестница Page Ruler (диапазон 10–170 кДа) (Thermo Fisher Scientific, Уолтем, Массачусетс, США), а для нативного электрофореза в качестве маркеров использовался набор для калибровки высокого молекулярного веса Amersham (диапазон 66–669 кДа). ).МММ, маркеры молекулярной массы. ОсттаДСП, О . тельца ОсттаДСП, О . тельца CE, O . таури неочищенный экстракт (20 мкг).
Эксклюзионная хроматография показала единственный пик для OsttaDSP (S2 рис.), Соответствующий расчетной массе 54,4 кДа, что очень близко к теоретическому размеру гомодимера (55,4 кДа), что убедительно указывает на то, что OsttaDSP является гомодимерным белком в исследуемые условия. Кроме того, OsttaDSP мигрирует в виде единой полосы в нативных гелях, как показано на.
Для анализа экспрессии фосфатаз с двойной специфичностью in vivo аффинно очищенные антитела против a-SEX4 использовали для зондирования вестерн-блоттинга O . таури экстрактов общего белка, полученных с TRIzol (Invitrogen, Carlsbad, CA, USA). Эти блоты показали только одну конкретную полосу сырых экстрактов O . tauri клеток с молекулярной массой около 26 кДа. Этот результат предполагает, что белок (белки), распознаваемый антителами к a-SEX4 при иммуноочищении с помощью OsttaDSP, присутствует / присутствует в O . клетки таури сырые экстракты ().
Кинетическая характеристика OsttaDSP
OsttaDSP in vitro Активность фосфатазы анализировали в отношении небольшой синтетической молекулы пара -нитрофенилфосфата ( p NPP), а также его биологического субстрата, амилопектина. В последнем случае фосфат, высвобождаемый из амилопектина под действием OsttaDSP, детектируется колориметрическим методом за счет образования комплекса фосфомолибдата малахитового зеленого [31].
Активность OsttaDSP строго зависела от присутствия 2 мМ восстанавливающего тиол соединения DTT (дитиотреитол) в среде для анализа для максимальной активности, как ранее описано для других DSP [15, 17, 42].
Активность очищенного OsttaDSP реагировала на pH по-разному в зависимости от анализируемого субстрата. Реакция дефосфорилирования НПП p показала наиболее сильную зависимость от pH. Скорость дефосфорилирования амилопектина имеет максимум в диапазоне pH 6.5-8,5 (), тогда как дефосфорилирование p NPP показало максимальную скорость при анализе при pH 7 (). Таким образом, мы определили кинетические параметры реакций p NPP и дефосфорилирования амилопектина при pH 7 и 7,5 соответственно ().
Кинетическая характеристика OsttaDSP.A) Влияние pH на активность рекомбинантного OsttaDSP. Активность анализировали с p NPP (закрашенные треугольники / ▲) или амилопектином (закрашенные кружки / ●) в качестве субстрата, используя 100 мМ ацетат натрия, 50 мМБис-Трис и 50 мМ Трис в качестве буфера.Значения pH буфера доводили до значений, показанных на графике, и использовали для анализа фермента. Все данные представляют собой средние значения ± стандартное отклонение 3 независимых экспериментов. B) p График насыщения NPP для OsttaDSP, определенный при pH 7. C) График насыщения амилопектина для OsttaDSP, определенный при pH 7,5.
График насыщения, полученный при анализе зависимости скорости реакции от p. NPP был гиперболическим со значением S 0,5 22,7 ± 3,4 мМ и V max из 4.5 ± 0,3 (нмоль PO 4 / мин мкг белка) (). Максимальная активность, измеренная с этим субстратом, составляет примерно половину от активности, полученной для A . thaliana LSF2 [15].
Кроме того, графики начальной скорости реакции OsttaDSP в зависимости от концентрации амилопектина показали гиперболический ответ (), характеризующийся S 0,5 11,5 ± 1,2 мг / мл и максимальной скоростью 1135,0 ± 64,3 (пмоль PO ). 4 / мин мкг белка). Таким образом, полученная удельная активность примерно в 5 раз выше, чем ранее сообщенная для A . thaliana LSF2 [15].
Характеристика модифицированного белка OsttaDSP C162S
Глюканфосфатазы, входящие в состав PTP, обладают инвариантным каталитическим цистеином в активном центре. В соответствии с выравниванием белковой последовательности OsttaDSP с LSF2 (), остаток Cys162 должен играть эту каталитическую роль. Следовательно, чтобы подтвердить функциональность Cys162, мы создали сайт-направленный мутант для этого остатка с консервативной заменой: остаток цистеина был заменен на серин.Полученный фермент, названный OsttaDSPC162S, был протестирован с p NPP или амилопектином в качестве субстратов (). OsttaDSPC162S не обладает активностью фосфатазы p NPP, но демонстрирует некоторую активность амилопектинфосфатазы (). Этот мутировавший фермент показал удельную активность менее 10 пмоль PO 4 / мин мкг белка и около 400 пмоль PO 4 / мин мкг белка при анализе при 10 мг / мл и 20 мг / мл амилопектина соответственно. Также была исследована зависимость активности фермента OsttaDSPC162S от pH (S3, фиг.).OsttaDSP и OsttaDSPC162S показали постоянную максимальную активность в диапазоне pH от 6,5 до 8,5 при анализе при 20 мг / мл амилопектина (S3 фиг.). Таким образом, затем мы проанализировали реакцию мутантного белка OsttaDSPC162S на увеличение концентрации амилопектина при pH 7,5 (). OsttaDSPC162S показал интересное кинетическое поведение при анализе с амилопектином в качестве субстрата; графики зависимости начальной скорости реакции от концентрации амилопектина показали сигмоидальный ответ () с коэффициентом Хилла ( n H ), равным 4.Эта реакция характеризовалась S 0,5 17,1 ± 1,9 мг / мл и максимальной скоростью 425 ± 51 (пмоль PO 4 / мин мкг белка). Последний результат совпадает с результатами, полученными для LSF2 и SEX4, поскольку мутация Cys активного сайта в Ser вызывает полную потерю активности обоих ферментов при анализе с использованием p NPP, а также амилопектина в низкой концентрации (2,25 мг / мл) [15, 40]. Нет сообщений, показывающих, что оба, SEX4 или LFS2, были протестированы с амилопектином в высоких концентрациях, ни кинетические свойства ферментов, связанных с дефосфорилированием крахмала в фотосинтезирующих организмах.
Характеристика модифицированного белка OsttaDSP C162S.A) Специфические активности ферментов OsttaDSP дикого типа (WT) и C162S (C162S) с p NPP в качестве субстрата. Обе активности были определены при 100 мМ p NPP. Все данные представляют собой средние значения ± стандартное отклонение 3 независимых экспериментов. B) Специфические активности модифицированного фермента OsttaDSP дикого типа (WT) и C162S (C162S) в присутствии амилопектина. Обе активности были определены при 10 мг / мл (белые столбцы) или 20 мг / мл (черные столбцы) амилопектина.Все данные представляют собой средние значения ± стандартное отклонение 3 независимых экспериментов. C) Анализ в естественном PAGE фермента OsttaDSP дикого типа (WT) и мутантного фермента C162S (C162S). OsttaDSP WT (3 мкг) и OsttaDSP C162S (3 мкг) были разделены с помощью нативного PAGE. После нативного PAGE гели окрашивали либо кумасси синим, либо с помощью анализа активности геля с использованием p NPP. Закрашенные стрелки (►) указывают на очищенные рекомбинантные ферменты, окрашенные кумасси синим, а пустая стрелка (>) указывает на OsttaDSP WT, окрашенную p NPP в анализе активности геля.Число указывает маркер молекулярной массы в кДа. MMM, маркер молекулярной массы (набор для калибровки высокомолекулярного веса Amersham (диапазон 66–669 кДа)). D) Кинетика амилопектина OsttaDSP дикого типа (WT) и модифицированного белка OsttaDSP C162S (C162S). Графики насыщения амилопектина для OsttaDSP WT (закрашенные кружки (●)) и варианта OsttaDSP C162S (закрашенные стрелки (►)) были выполнены при pH 7,5. Все данные представляют собой средние значения ± стандартное отклонение 3 независимых экспериментов.
Когда OsttaDSPC162S был проанализирован на нативном PAGE и обнаружен окрашиванием кумасси синим, он, по-видимому, вел себя как мономер, а не как димер, как его аналог дикого типа ().Анализы активности в геле подтвердили отсутствие фосфатазной активности OsttaDSPC162S в отношении p NPP (). Таким образом, OsttaDSPC162S потерял активность фосфатазы p NPP как в геле, так и в растворе, но сохранил некоторую активность амилопектинфосфатазы при высоких концентрациях амилопектина с увеличением примерно в 1,5 раза в S 0,5 для амилопектина ().
Основываясь на этом результате, можно предположить, что фермент активен в отношении амилопектина в качестве мономера или что присутствие его природного субстрата каким-то образом индуцирует его олигомеризацию.Чтобы проверить это, мы провели аффинный гель-электрофорез (AGE) в присутствии амилопектина (0,3 мг / мл). Как показано в, OsttaDSPC162S мигрировал быстрее в нативном PAGE (в качестве мономера), но показал явное замедление AGE с амилопектином. В последнем случае OsttaDSPC162S мигрировал параллельно с OsttaDSP дикого типа, что позволило предположить, что мутантный вариант димеризуется в присутствии амилопектина. Стоит отметить, что ни OsttaDSP, ни OsttaDSPC162S не показали более значительного замедления при увеличении концентрации амилопектина в гелях.Однако с помощью анализов совместной седиментации мы смогли определить, что оба фермента связывают амилопектин в одинаковой степени (S4, фиг.).
Аффинный гель-электрофорез (AGE) OsttaDSP дикого типа (WT) и мутантного белка C162S (C162S).Белки OsttaDSP WT (WT, 5 мкг) и OsttaDSP C162S (C162S, 5 мкг) запускали на нативном ПААГ без или с амилопектином (0,3 мг / мл) одновременно в одних и тех же условиях. Затем гели выявляли окрашиванием кумасси синим. Число указывает маркер молекулярной массы в кДа.MMM, маркеры молекулярной массы (Amersham High Molecular Weight Calibration Kit (диапазон 66–669 кДа)).
Кроме того, важно отметить, что мутация C162S не привела к каким-либо заметным конформационным изменениям вторичной структуры фермента, поскольку спектр кругового дихроизма (КД) мутанта был очень похож на спектр фермента дикого типа. (S5 Рис). Кроме того, термостабильность белков дикого типа и мутантных белков анализировали с помощью дифференциальной сканирующей флюорометрии. Оба белка давали почти одинаковую температуру плавления около 39 ° C.
Обсуждение
В соответствии с исследованиями in silico , зеленые линии глюканкиназ и фосфатаз, по-видимому, довольно хорошо сохранились от зеленых водорослей до наземных растений, что подчеркивает существенную природу обратимого фосфорилирования глюкана [16, 43, 44] . Анализ О . Геном тельца показывает присутствие двух генов DSP (Ot02g06340 и Ot13g02940) и пяти генов, кодирующих пять предполагаемых ферментов фосфорилирования крахмала (Ot13g01510, Ot16g02370, Ot04g04170, Ot080t0860g и Ot08g0860g).На сегодняшний день нет ни данных по характеристике ферментов фосфатаз, ни каких-либо объяснений относительно множественности дикиназ в этом организме. Согласно анализу in silico , оба гена DSP кодируют ортологи LSF2, предполагая, что DSP будут высококонсервативными по всей зеленой линии, включая самые старые геномы, такие как O . тельца .
Как описано ранее, из двух генов DSP , обнаруженных в O . tauri , мы продолжаем работать с Ot02g06340 из-за его белкового продукта ({«type»: «entrez-protein», «attrs»: {«text»: «XP_003075237», «term_id»: «308800912», «term_text» : «XP_003075237»}} XP_003075237) имеет наивысшую идентичность со своим заводским аналогом LSF2 из A . Талиана . Полноразмерный ген OsttaDSP (Ot02g06340) содержит 816 п.н. и кодирует зрелый полипептид из 245 аминокислот с высокой идентичностью последовательности с LSF2. Как и LSF2, OsttaLSF2 не имеет CBM, о котором сообщалось на сегодняшний день, но он эффективно связывает и дефосфорилирует амилопектин, составляя активный фермент (и S4 Фиг.).Структура Arabidopsis LSF2 показала, что этот белок взаимодействует с глюкановой цепью через ароматический канал и два SBS на расстоянии около 20 ° от активного центра [39, 45]. В то время как ароматический канал полностью консервативен в OsttaDSP (зеленые стрелки внутри), это не относится к SBS2 и SBS3 (красные и синие стрелки). Поскольку SBS представляют собой короткие отрезки несмежных аминокислот, которые объединяются, чтобы обеспечить связывание глюкана, они имеют гетерогенную топологию и отсутствует строгий сигнатурный мотив SBS [16].Вот почему сложно идентифицировать SBS OsttaDSP только с помощью инструментов биоинформатики.
Биохимическая характеристика OsttaDSP показала, что он мигрирует в виде единой полосы в SDS-PAGE и нативных гелях (). Используя гель-фильтрационную хроматографию, фермент был обнаружен как белок 54,4 кДа (S2 фиг.), Что позволяет предположить, что OsttaDSP является гомодимером. Кинетический график OsttaDSP в присутствии амилопектина показал гиперболическую кинетику с S 0,5 11,5 ± 1,2 мг / мл. Стоит отметить, что кинетические свойства ферментов, связанные с дефосфорилированием крахмала в фотосинтезирующих организмах, неизвестны.
Как известно из предыдущих исследований, PTP имеют сигнатурный мотив HCX 5 R, который содержит инвариантный остаток цистеина в основании щели активного сайта [46, 47]. Этот цистеин существует как активный тиолат-анион во время катализа и стабилизируется электростатическими взаимодействиями соседнего гистидина [47]. Аргинин сигнатурного мотива координирует цистеинилфосфатный промежуточный продукт, который образуется после нуклеофильной атаки тиолат-ионом цистеина.Перенос фосфата стимулируется протонированием дефосфорилированного субстрата остатком аспарагиновой кислоты, расположенным примерно на 30 остатков выше сигнатурного мотива. Фосфат высвобождается после гидролиза вышеупомянутым аспартатом и близлежащим глутамином для восстановления тиолат-аниона. Arabidopsis thaliana LSF2 и SEX4 активны с использованием p NPP или амилопектина в качестве субстратов, а в активном сайте DSP консервативный Cys, как сообщается, важен для активности [15, 20, 30].Мутация соответствующего Cys в LSF2 (Cys193) на Ser отменяет его активность против p, NPP и амилопектина (2,25 мг / мл), аналогично мутации C198S в SEX4 [15, 20, 48]. В этой работе мутировавший фермент OsttaDSP C162S сохраняет некоторую активность при более высоких концентрациях амилопектина, но эта активность теряется при использовании pNPP в качестве субстрата (). Однократная аминокислотная замена Cys на Ser приводила к изменению гиперболической кинетики на сигмоидальную в ответ на концентрацию амилопектина ().Это объясняет, почему фермент показывает очень низкую активность при субнасыщающих концентрациях амилопектина, но сохраняет около 40% активности фермента дикого типа при насыщающих количествах амилопектина. Кроме того, данные, обнаруженные с помощью нативного электрофореза, показали, что образование гомодимера также может быть потеряно с мутацией C162S (), что предполагает участие этого остатка как в каталитической активности, так и в структурной стабильности. Из результатов, представленных здесь, мы можем сделать вывод, что Cys162 имеет решающее значение для активности OsttaDSP и что, возможно, локальные структурные эффекты, возникающие в результате мутации Cys в Ser, делают мутантный фермент способным выполнять дефосфорилирование амилопектина во всем анализируемом диапазоне pH (и S3 Инжир).Однако необходимы дальнейшие исследования, чтобы полностью понять значение этой консервативной точечной мутации в каталитическом механизме OsttaDSP, а также в окончательной структуре активного сайта.
Наши результаты могут способствовать лучшему пониманию метаболизма крахмала в этой микроводоросле и обеспечить основу для лучшей эволюционной характеристики этих фосфатаз двойной природы. Хотя описано, что SEX4 гидролизует как C6-, так и C3-связанный фосфат, LSF2 уникален, поскольку он высокоспецифичен для C3-положения глюкозильных остатков крахмала, хотя он также имеет низкую способность дефосфорилировать некоторые C6-сложные эфиры [15].Отсутствие ортолога SEX4 n O . tauri открывает возможность того, что OsttaDSP проявляет обе активности или что дефосфорилирование C6-фосфорилированных остатков осуществляется другим DSP, обнаруженным в Ostreococcus . Определение структур глюканфосфатаз водорослей позволит лучше понять их механизм активности и специфичность, в частности, из-за присутствия SBS. Конкретная роль (и) SBS является активной областью исследований, поскольку наблюдаемая синергетическая функция может быть обусловлена измененной динамикой из-за эффектов близости, различных предпочтений связывания или глобальных эффектов на стабильность глюкана.Кроме того, особые свойства, касающиеся регуляции метаболизма полисахаридов, являются фундаментальными из-за их потенциального биотехнологического и промышленного применения.
Структура, функция и биосинтез никельзависимых ферментов — Альфано — 2020 — Наука о протеине
1 ВВЕДЕНИЕ
В начале жизни окружающая среда была сильно восстановительной, с бескислородной атмосферой, богатой такими газами, как H 2 , CO и CO 2 , и горячими океанами, хорошо снабженными переходными металлами, такими как Fe (II) и Ni. (II).1 Чтобы приспособиться к этим ранним условиям жизни, никель, скорее всего, будет играть ключевую роль в разработке катализаторов. Примечательно, что его роль была важна как кофактор металла в метаболизме метаногенных архей.2 Теория «никелевого голода» была предложена играть центральную роль в эволюции: 3 она коррелирует великое событие окисления (GEO) с резким сокращением поток никеля в архейских океанах, вызванный охлаждением верхней мантии и уменьшением извержения богатых никелем ультраосновных пород, что привело бы к голоданию основного сообщества океанических микробов — метаногенов.4 Их упадок оставил место для размножения других микроорганизмов, особенно океанических цианобактерий, которым не требовалось столько никеля. Это привело к увеличению производства O 2 посредством фотосинтеза, одновременно с уменьшением концентрации метана. Появление кислорода в атмосфере 2,4 миллиарда лет назад оказало драматическое влияние на эволюцию метаболизма, и многие пути ферментативных реакций, используемые анаэробным метаболизмом в восстановительных условиях, были заменены аэробными.5 Результатом стала сегрегация микроорганизмов, зависящих от путей окисления H 2 и / или CO и путей восстановления CO 2 в бескислородные ниши, такие как дно океана или озера, пищеварительный тракт животных и вулканическая грязь. только девять никель-зависимых ферментов были идентифицированы у архей, бактерий, растений и примитивных эукариот, включая [NiFe] -моноксиддегидрогеназу углерода (CODH), ацетил-CoA декарбонилазу / синтазу (ACS), [NiFe] -гидрогеназу метил-CoM редуктаза (MCR), уреаза, Ni-супероксиддисмутаза (NiSOD), лактатрацемаза (LarA), глиоксилаза I (GlxI) и ациредуктон-диоксигеназа (ARD; рис. 1).7 Напротив, никелевый фермент не был обнаружен у видов млекопитающих. 8 Несмотря на их дефицит, они часто необходимы, выполняя ключевые функции в различных метаболических процессах, таких как энергетический метаболизм и вирулентность, а также функционируют как окислительно-восстановительные или нередокс-ферменты (Таблица 1 ). Преимущество никеля как каталитического центра основано на его гибкой координационной геометрии, позволяющей выполнять разнообразные биологические функции. Более того, в окислительно-восстановительных ферментах металлическая среда имеет решающее значение для регулирования его окислительно-восстановительного потенциала, и, таким образом, никель может циклически проходить через несколько окислительно-восстановительных состояний и катализировать реакции, охватывающие более 1.5 В, в то время как в нередокс-ферментах Ni (II) используется в качестве кислоты Льюиса.
Схема аминокислотных последовательностей и металлсвязывающих мотивов Ni-ферментов. Остатки, участвующие в связывании Ni или Fe, выделены зеленым и оранжевым цветом соответственно. Остатки, участвующие в связывании Ni и Fe, выделены пурпурным цветом. Синим цветом выделены остатки во взаимодействии с кофакторами. Регистрационный номер в UniProtKB выделен курсивом. Остатки, составляющие активный сайт, аннотированы. Rr CODH: мономер CODH из R. rubrum ; Mt САУ: α-сусблок CODH / САУ от Moorella thermoacetica ; Dg H 2 аза: малая (HydA) и большая (HydB) субъединица [NiFe] -H 2 аза из Desulfovibrio gigas , сигнал последовательности HydA (1-23) для периплазматической транслокации и пропептид ( 537–551), обработанные в HydA во время созревания, находятся в закрытом состоянии; Mm MCR: субъединицы α (McrA), ß (McrB) и ɤ (McrG) MCR из Methanothermobacter marbugensis ; Ss Ni-SOD: мономер Ni-SOD из Streptomyces seoulensis , процессированный пропептид (1–14) находится с перемычкой; Sp Уреаза: субъединицы α, ß и ɤ уреазы из Sporosarcina pasteurii ; Lp LarA: LarA из Lactobacillus planetarium ; Ec GlxI: мономер Glx I из E.кишечная палочка; Ko ARD: Ni-ARD из Klebsellia oxytoca
Таблица 1. Возникновение Ni-ферментов и совокупность различных каталитических реакций| Возникновение | Ферментная реакция | |
|---|---|---|
| Редокс-ферменты | ||
| [NiFe] -гидрогеназа | Бактерии , Археи | H 2 ↔ 2H + + 2e — |
| CO-дегидрогеназа | Бактерии , Археи | CO + H 2 O ↔ CO 2 + 2H + + 2e — |
| Ацетил-SCoA-синтаза | Бактерии , Археи | CO + CoA-S — + CH 3 -CO 3+ FeSP ↔ CH 3 C (O) -S-CoA + co + FeSP |
| Метил-SCoM редуктаза | Археи | канал 3 -SCoM + CoBSH ↔ канал 4 + CoBS-SCoM |
| Супероксиддисмутаза | Бактерии | |
| Морская эукариота | 2 O 2 — ° + 2H + ➔ H 2 O 2 + O 2 | |
| Нередокс-ферменты | ||
| Уреаза | Бактерии, Археи Эукариоты (растения, грибы, водоросли) | (NH 2 ) CO 2 + H 2 O ➔ CO 2 + 2 NH 3 |
| Лактат рацемаза | Бактерии Архей? | л-лактат ↔ д-лактат |
| Глиоксалаза I | Бактерии Эукариота (простейшие, растения) | CH 3 -CO-C (OH) -SG ➔ CH 3 -CH (OH) -CO-SG |
| Ациредуктон-диоксигеназа | Бактерии Эукариота? | 1,2-дигидрокси-3-кето-5-метилтиопентан + O 2 ↔ 3-метилтиопропаноат + формиат + CO |
- Примечание : жирным шрифтом выделены наиболее репрезентативные царства для каждого фермента и основные продукты или субстраты.
Присутствие металлоферментов в организмах требует жесткой регуляции гомеостаза металлов, абсолютно критичного для клеток, чтобы поддерживать соответствующую внутриклеточную концентрацию основных металлов, избегая при этом токсичности, вызванной избыточными количествами.9 С одной стороны, если концентрация становится слишком низкой, клетка пострадает от инактивации основных ферментов. С другой стороны, нефизиологический металл, присутствующий в высоких внутриклеточных концентрациях, может привести к замене природного металла, что, в свою очередь, может привести к инактивации или каталитическому образованию высокотоксичных активных форм кислорода.В случае никеля текущие уровни в естественной среде обычно находятся в наномолярном диапазоне, за исключением конкретных ниш. Следовательно, его очистка является критическим этапом и требует строго контролируемых и высокоэффективных систем импорта.10 После получения нужный металл будет доставляться и включаться в целевые ферменты через специализированные белковые комплексы, содержащие шапероны никеля и дополнительные белки. Эти белки участвуют в доставке никеля, сборке металлоцентра или синтезе кофакторов.
В этом обзоре сначала будет представлено филогенетическое распределение Ni-ферментов. Будут обсуждены их трехмерные структуры, а также сложность их активных центров, и особое внимание будет уделено биосинтезу активных центров и активации никелем апо-ферментов. Будут исключены детали механизмов реакции, а также описание поглощения никеля, оттока никеля и систем регулирования.
2 ВОЗНИКНОВЕНИЕ И БИОЛОГИЧЕСКАЯ АКТУАЛЬНОСТЬ
Большинство никелевых ферментов участвует в переработке газа в качестве субстратов или конечных продуктов реакции (CO, CO 2 , H 2 , аммиак, O 2 и CH 4 ), за исключением GlxI I и LarA.Они делятся на анаэробные и аэробные ферменты в зависимости от их метаболического воздействия. Ni-утилизирующие организмы перегруппируют архей, бактерий и некоторых эукариот и обладают одним или несколькими никелевыми ферментами (таблица 1). Все ферменты, кроме MCR, обнаружены в бактериях, причем [NiFe] -H 2 аза и уреаза являются наиболее распространенными, тогда как другие имеют ограниченное и мозаичное распределение. [NiFe] -H 2 аза также является наиболее распространенным Ni-ферментом в архее.
2.1
Редокс-ферментыH 2 азы были разделены на три филогенетически несвязанных класса в зависимости от металлического состава их активного центра: [Fe] -, [FeFe] — и [NiFe] -H 2 азов6. типы обратимо катализируют окисление молекулярного водорода до протонов и электронов. Водород может играть двойную роль: либо как источник энергии, либо как конечный продукт для удаления возможного избытка восстанавливающих эквивалентов. [NiFe] -H 2 азы, обнаруженные у бактерий и архей, были разделены на четыре основные группы в зависимости от их функции.Группа 1 содержит ассоциированные с мембраной H 2 гидрогеназы поглощения; растворимые поглощающие гидрогеназы и сенсорные гидрогеназы образуют Группу 2; Гетеромультимерные цитоплазматические гидрогеназы, несущие восстанавливаемый кофактор (F420 или NAD (P)), находятся в группе 3, а последняя группа состоит из энергосберегающих гидрогеназ.11
Дегидрогеназа монооксида углерода (CODH) играет центральную роль в метаболизме углерода в анаэробных микроорганизмах, обратимо катализируя окисление CO до CO. 2 для различных метаболических целей.12 В направлении окисления CO, монофункциональный CODH используется различными карбоксидотрофными археями и бактериями для производства энергии. В направлении восстановления CO 2 CODH может быть соединен с ацетил-SCoA-синтазой с образованием либо комплекса CODH / ACS в анаэробных бактериях, либо мультиферментного комплекса ацетил-CoA декарбонилаза / синтаза (ACDS) в архее.13 Комплекс катализирует синтез ацетил-КоА из кофермента А, конденсированного с CO (полученного из восстановления CO 2 , катализируемого CODH), и метильной группы, полученной из корриноида / белка Fe – S Co (III) -FeSP.CODH и ACS играют важную роль в пути Вуда – Люнгдаля (WL), одном из шести путей связывания углерода, известных на Земле. Этот путь обнаружен в ацетогенах для сохранения энергии и автотрофной ассимиляции углерода с ацетатом в качестве конечного продукта. У метаногенных архей он используется только для фиксации CO 2 , в то время как сохранение энергии достигается за счет метаногенеза, который термодинамически более благоприятен. Путь WL также может действовать в обратном направлении (в окислительном направлении), создавая восстанавливающую способность за счет окисления органических соединений, что иллюстрируется сочетанием окисления ацетата с H 2 и CO 2 , с восстановлением сульфата. у сульфатредуцирующих бактерий.Путь WL состоит из двух ветвей, определяемых как метильная (или восточная) и карбонильная (или западная) ветви. Хотя его общая схема является консервативной, бактериальные и архейные метильные ветви включают различные кофакторы, C1-носители и ферменты, тогда как карбонильная ветвь является общей для всех микроорганизмов. В метильной ветви одна молекула CO 2 подвергается шестиэлектронному восстановлению с образованием метильной группы, конденсированной с CoA и CO, возникающей в результате восстановления CO 2 в карбонильной ветви , с образованием ацетила. -CoA, ключевая молекула в метаболизме белков, углеводов и липидов.13 ACS также может быть обнаружен как независимый монофункциональный фермент у карбоксидотрофов.
MCR строго ограничен архей и играет важную роль в метаболизме углерода, являясь ключевым ферментом в биологическом образовании метана.14 Этот фермент катализирует восстановление метил-S-кофермента M (CH 3 -S-CoM) под действием кофермента. B (CoB) с образованием метана, который является заключительным этапом метаболизма метаногенных архей. Эти строго анаэробные микроорганизмы, способные расти на ацетате, метаноле, формиате или CO 2 и H 2 , ответственны за более чем 90% метана, присутствующего на Земле.15
SOD возникла с повышением уровня O 2 в атмосфере около 2 миллиардов лет назад. Его роль заключается в защите биологических систем от окислительного повреждения, вызываемого супероксид-радикальными анионами (O 2 — ° ), побочным продуктом метаболизма кислорода.16 Фермент катализирует дисмутацию супероксид-анионов до перекиси водорода и кислорода (Таблица 1 ). Его активный центр может состоять из разных металлов. Наиболее распространены из них либо диядерный центр Cu – Zn, либо одноядерный атом Fe или Mn.Открытие NiSOD в 1996 г. у видов Streptomyces стало неожиданностью для сообщества, потому что Ni (II) является единственным стабильным состоянием окисления в водной среде и не может катализировать диспропорционирование супероксида в водном растворе17. в качестве каталитического центра привело к уникальному появлению этого фермента, который не имеет гомологии последовательности с другими SOD. NiSOD обычно встречается в цианобактериях, которые первыми продуцировали кислород, а также у некоторых морских эукариот, что делает NiSOD наиболее распространенным SOD в современных океанах.18
2,2
Ферменты без окисления-восстановленияУреаза была первым примером использования никеля в качестве кофактора фермента.19 Этот фермент обнаружен во множестве организмов, включая растения, грибы, водоросли, археи и бактерии, и катализирует гидролиз мочевины с образованием аммиака и карбамата. Последний самопроизвольно разлагается до аммиака и угольной кислоты. Широкое распространение уреазы связано с изобилием мочевины в различных экологических нишах, где фермент участвует в различных биологических процессах и является активным игроком в глобальном круговороте азота.20 Интересно, что уреаза также считается фактором вирулентности для некоторых патогенных бактерий. В этом случае бикарбонат и аммиак используются в качестве буферных соединений для поддержания нейтрального цитозольного pH, позволяя микроорганизмам противостоять кислой среде, такой как пищеварительный тракт или мочевыводящие пути, увеличивая их выживаемость во время колонизации хозяина. Одним из типичных примеров является желудочный патоген Helicobacter pylori , для которого уреаза представляет собой основную детерминанту вирулентности, обеспечивающую его выживание в кислой среде желудка человека.21
Глиоксалаза I (Glo1 или GlxI) использует внутриклеточные тиолы для превращения α-кетоальдегидов, таких как метилглиоксаль, высоко цитотоксического побочного продукта метаболизма, в нетоксичные d-гидроксикислоты.7 Фермент работает вместе с глиоксалазой II и превращает образующийся гемитиоацеталь. по реакции метилглиоксаля с восстановленным глутатионом до S -d-лактоилглутатион, который, в свою очередь, используется GlxII в качестве субстрата для восстановления восстановленного глутатиона и продуцирования d-лактата.GlxI был описан как цинк-зависимый фермент до 1998 года, когда было показано, что активность GlxI из Escherichia coli максимизируется Ni (II), в то время как замена Zn (II) приводила к инактивации фермента.22 NiGlx1 был описан в бактерии в простейших, таких как Trypanosoma и Leishmania , а также в растениях.
Ациредуктон-диоксигеназа участвует в пути восстановления метионина. Во время этого пути 5′-метилтиоаденозин превращается в ациредуктон, который можно использовать в качестве субстрата для образования двух разных продуктов.23 Этот фермент уникален тем, что проявляет две различные реакционные способности в зависимости от природы металла, присутствующего в активном центре. 7 При загрузке Fe, ARD производит предшественник кетокислоты, который может быть переработан обратно в метионин. Если вместо этого активным центром является Ni, ARD катализирует побочный эффект, который превращает ациредуктон в формиат, монооксид углерода и метилтиомасляную кислоту. В последнем случае фермент предположительно участвует в регуляторных и / или сигнальных функциях. Эта двойная химия ARD была первоначально обнаружена у бактерии Klebsiella oxytoca .24 Эта активность была подтверждена in vitro для млекопитающих Mus musculus 25 и ARD человека. Однако маловероятно, что NiARD играет биологически значимую роль у эукариот.26 Хотя Fe-содержащая форма использует Fe (II) для активации двуокиси кислорода для окисления субстрата посредством окислительно-восстановительной химии (окислительное расщепление связи C1C2), Ni (II) используется в качестве кислоты Льюиса для активации субстрата в реакции с O 2 (разрыв связей C1C2 и C2C3). Филогенетическое распределение Ni-зависимых ARD трудно оценить, поскольку природу физиологического металла определить нелегко.
LarA, недавно идентифицированный как девятый известный никель-зависимый фермент, катализирует взаимное превращение между изомерами l- и d-молочной кислоты. Единственным охарактеризованным ферментом является фермент, обнаруженный у видов Lactobacillus , где он может действовать как спасательный фермент в стрессовых условиях, обеспечивая продукцию d-лактата. 27 d-лактат обычно вырабатывается d-лактатдегидрогеназой и является важным компонентом. пептидогликана клеточной стенки в Lactobacillus .С тех пор гены larA и были идентифицированы у других бактерий и некоторых архей, хотя они не были четко идентифицированы как Ni-зависимые ферменты.
3 КОНСТРУКЦИИ В целом
Было решенорентгеновских структур девяти Ni-ферментов, описанных до сих пор (рис. 2).
Общая структура Ni-ферментов. (а). Димер CODH из Rhodospirillum rubrum (код PDB: 1JQK). N-концевой домен выделен пурпурным цветом, а два домена Россмана — зеленым и синим.С-кластеры изображены в сферах B. α 2 β 2 тетрамер CODH / ACS из Moorella thermoacetica (код PDB: 1OAO). Две ß-субъединицы CODH окрашены в синий и голубой цвета. Две субъединицы ACS находятся в открытой или закрытой конформации. А- и С-кластеры изображены сферами. C. Архетипическая структура [NiFe] -гидрогеназы из Desulfovibrio gigas (код PDB: 1FRV). Большая субъединица выделена пурпурным цветом, а малая — зеленым. Активное место захоронения изображено сферами.D. Димер αβɤ MCR из Methanothermobacter marbugensis (код PDB: 3POT). Субъединицы α, ß и ɤ выделены синим, голубым и пурпурным цветом соответственно. Коэнзим F430 обозначен оранжевым цветом, а коэнзим B — зеленым. E. Гексамер Ni-SOD из Streptomyces seoulensis (код PDB: 1Q0D). (е). Тример αβɤ уреазы из Sporosarcina pasteurii (код PDB: 4CEU). Субъединицы α, ß и ɤ окрашены в пурпурный, синий и голубой цвета соответственно. Мотив спираль-поворот-спираль (остатки 375–405), принадлежащий субъединице α, выделен оранжевым цветом.(грамм). Закрытая конформация LarA из Lactobacillus plantarium (код PDB: 5HUQ). Два домена обозначены оранжевым и синим цветом, а клещевой нуклеотид — пурпурным. (час). Димер глиоксалазы I из E. coli (код PDB: 1F9Z). (я). Мономер Ni-ARD из Klebsellia oxytoca (код PDB: 1ZRR) α-спирали имеют голубой цвет, а ß-цепи — пурпурный. Во всех структурах ионы никеля изображены зелеными сферами, а кластеры FeS изображены красными и желтыми сферами для атомов железа и серы соответственно
Первые структуры двух CODH были решены в 2001,28,29, что показало, что монофункциональные ферменты являются гомодимерами (рис. 2а).Каждый мономер состоит из трех разных доменов, известных как N-концевой спиральный домен, и двух центральных и C-концевых α / β (Россманноподобных) доменов. Гомодимер содержит пять металлокластеров: два уникальных кластера [Ni-4Fe-4S], образующих активные центры (а именно C-кластер), два кластера [4Fe-4S] (а именно B-кластер) и один межмолекулярный кластер [4Fe-4S]. (а именно d-кластер). Позже была решена рентгеновская структура бифункционального фермента ACS / CODH из Moorella thermoacetica .30, 31 В этом случае тетрамерный белок α 2 β 2 образован двумя β-субъединицами CODH в центр и по одной α-субъединице ACS на каждой конечности.Субъединица ACS содержит три разных домена: N-концевой домен, отвечающий за взаимодействие ACS с CODH, центральный домен и C-концевой домен, который содержит активный сайт, называемый A-кластером. Весь комплекс ACS-CODH может принимать открытое или закрытое состояние, демонстрируя значительные конформационные изменения (Рис. 2b). Только открытая форма содержит активный биядерный сайт Ni.30,32 Более того, бифункциональный фермент содержит обширную сеть полостей, соединяющую активные сайты гидрофобными каналами, чтобы обеспечить диффузию CO, продуцируемого CODH, в активный сайт ACS.На этой основе был предложен точно управляемый механизм туннельного затвора, регулирующий, таким образом, эффективную диффузию CO внутри фермента, избегая в то же время выброса этого токсичного газа в клетку.
Стандартная [NiFe] -гидрогеназа — это гетеродимеры, состоящие из большой субъединицы, содержащей активный центр, и небольшой субъединицы, которая связывает кластеры FeS, необходимые для переноса электронов. Общей чертой всех доступных рентгеновских структур является глубоко скрытое положение активного центра, что подразумевает наличие гидрофобных туннелей для доступа / высвобождения дигидрогена, а также путей протонов в дополнение к электронным реле.11 Архетипическая структура [NiFe] -гидрогеназы из Desulfovibrio gigas (рис. 2c) выявила присутствие трех кластеров FeS с одним проксимальным и одним дистальным [Fe 4 S 4 ] кластерами и средним [Fe 3 S 4 ] cluster.33 Малая субъединица состоит из двух доменов: домен I имеет флаводоксиноподобную складку, содержащую проксимальный кластер, а домен II связывает срединный и дистальный кластеры FeS. Домен II отсутствует у некоторых NiFe-гидрогеназ.Большая субъединица содержит пять доменов с активными сайтами между двумя α / ß доменами I и II. Две субъединицы обладают обширной контактной границей около 3500 Å 2 . Вариации обнаружены в [NiFeSe] -гидрогеназе, которая обладает медианным [Fe 4 S 4 ] вместо кластера [Fe 3 S 4 ] 34, и в O 2 -толерантных ферментах, которые имеют модифицированный проксимальный кластер, соответствующий центру [Fe 4 S 3 ]. 35 Этот гетеродимерный прототип часто участвует в белковых комплексах и взаимодействует с различными окислительно-восстановительными партнерами.
Кристаллическая структура MCR из Methanothermobacter marburgensis показывает гексамер, расположенный в виде димера гетеротримеров (αβϒ) 2 (рис. 2d) .36 Фермент содержит два пространственно разделенных активных центра, а именно кофермент F 430 , один в каждой α-субъединице. Рентгеновские структуры показали, что коферменты F , 430, , M и B, а также гетеродисульфид CoMSSCoB встроены в узкий канал размером 50 Å, от поверхности белка до скрытого активного центра.37 Остатки от разных субъединиц образуют канал, показывающий, что один тример αβϒ не может составлять активную каталитическую единицу. Этот фермент обладает способностью претерпевать несколько необычных посттрансляционных модификаций аминокислот, расположенных рядом с активным центром в субъединице McrA, в основном метилирование остатков цистеина, гистидина, аргинина и глутамина, катализируемое S-аденозил-1-метионином (SAM) зависимыми N- и S-метилтрансферазы.38 Эти посттрансляционные модификации могут служить важными факторами для повышения стабильности ферментов.
Четвертичная структура NiSOD является эксклюзивной для семейства SOD.39 Он образует гомогексамер, каждая субъединица которого принимает складку из четырех спиралей (Figure 2e). 7/8 N-концевые остатки зрелого белка образуют «крючок», выступающий из пучка из 4 спиралей, для хелатирования активного центра Ni. Топология биологической единицы включает шесть независимых активных сайтов, которые не взаимодействуют друг с другом. Интересно, что 14 аминокислот на N-конце процессируются в зрелую и активную форму из 117 аминокислот, оставляя гистидин, координирующий Ni, в качестве первого остатка (рис. 1).
В настоящее время в Банк данных по белкам депонировано около 50 различных структур уреаз, большинство из которых принадлежит бактериям.40 Среди них наиболее репрезентативная структура белка соответствует тримеру тримеров (αβϒ) 3 , в котором субъединица α содержит каталитический центр, что в сумме составляет три активных центра на биологическую единицу (рис. 2f) .20 В других бактериальных уреазах четвертичная структура соответствует тримеру (αβ) 3 , в котором субъединица β представляет собой слияние β и ϒ субъединицы.В H. pylori фермент представляет собой тетрамер (αβ) 3 тримеров, содержащих 12 активных центров. У растений слияние трех субъединиц α, β и образует единую субъединицу α, организованную как димер гомотримеров (α 3 ) 2 . Несмотря на вариабельность четвертичных структур, вторичные и третичные структуры всех уреаз очень похожи. Субъединицы α состоят из бочкообразного домена TIM и домена β-листа, субъединицы β расположены на внешней поверхности тримера и в основном состоят из β-листов, а субъединицы γ состоят из доменов, содержащих как α-спирали, так и β-листы.Важно, что субъединицы α обладают высококонсервативным гибким мотивом спираль-поворот-спираль, фланкирующим активный сайт, который, как предполагается, участвует в модуляции диффузии субстратов и продуктов к активному сайту и от него (рис. 1 и 2).
Внутренняя нестабильность LarA ограничивает имеющиеся знания о структуре и функциях ферментов. С 2014 года исследования рацемизации лактата в L. plantarum 27 и, в частности, определение кристаллической структуры holo-LarA в 2015 году, 42 принесли существенно новую информацию об этом ферменте, особенно о его идентификации как никелевый фермент.Удивительно, хотя никель абсолютно необходим для активности, металл легко отделяется от фермента. Определение структуры LarA в комплексе с его физиологическим металлом стало возможным только благодаря добавлению сульфита, который, как было показано, стабилизирует LarA и задерживает спонтанную утечку Ni. Ni (II) связывается с белком через нуклеотид Ni-pincer (NPN), ковалентно связанный с белком, образуя тиоамид с остатком лизина. LarA имеет 18 ß-цепей и 16 α-спиралей, расположенных в новой складке, состоящей из двух доменов, соединенных двумя шарнирами (рис. 2g).Две молекулы, составляющие асимметричный блок, принимают открытую или закрытую форму с разной степенью закрытия каталитического центра. Закрытая форма защищает никель от растворителя благодаря непосредственной близости N- и C-концов. Открытая конформация приводит к потере иона никеля из-за легкого доступа к активному центру для растворителя. Это означает, что доступ субстрата к каталитическому центру должен быть быстрым, чтобы избежать дезактивации фермента, и что LarA, скорее всего, способен динамически переключаться между открытой и закрытой конформациями.
Структура Glx I из E. coli представляет собой гомодимер с общей укладкой, аналогичной структуре человеческого фермента. Каждая субъединица состоит из двух доменов смешанного β-слоя. Димер состоит из двух антипараллельных мономеров с двумя независимыми металлическими активными центрами внутри изогнутых β-листов на границе раздела димера (рис. 2h). Рентгеновские структуры фермента в апо-форме или в комплексе с рядом двухвалентных металлов принесли ключевую информацию о важности геометрии координации металла в каталитическом механизме.43 Примечательно, что активные формы E. coli и GlxI человека связывают Ni (II) и Zn (II), соответственно, принимая октаэдрическую геометрию. Напротив, фермент E. coli связывает Zn (II) в тригонально-бипирамидной геометрии, что приводит к неактивной форме, что подтверждает необходимость в октаэдрической среде для ускорения катализа независимо от природы металла. Основное структурное различие между двумя классами глиоксалаз — это отсутствие длинного N-концевого плеча у Ni-ферментов и делеций в трех других областях.В частности, отсутствие остатков 73–87 оказывает сильное влияние на профиль активации металла.44
Первая молекулярная структура ARD была определена на основе данных ЯМР фермента из K. oxytoca .45 Этот фермент принадлежит к суперсемейству структурных купинов, перегруппировывая функционально разнообразные белки, обладающие консервативной ß-ствольной складкой (известной как мотив купина; рис. 2i). Многие другие негемовые железозависимые оксигеназы разделяют мотив купина. Было показано, что Ni (II) — и Fe (II) -формы ARD разделены хроматографически, что указывает на то, что в зависимости от связанного металла фермент может принимать различные конформации.23 Наиболее легко наблюдаемое структурное различие между двумя формами — это наличие более неупорядоченной спирали на вершине ß-цилиндра в связанной с Fe (II) форме, что делает активный центр значительно более доступным для растворителя. На противоположной стороне движение двух спиралей вызывает резкую перестановку. Это явление упоминается как структурный переключатель энтропии с неупорядоченным C-концом и упорядоченным N-концом в Fe-форме, в то время как противоположное состояние наблюдается в Ni-форме.45 Хотя происхождение этих конформационных изменений неочевидно, природа металла, вероятно, вызывает различную селективность при катализе двух различных реакций.
4 АКТИВНЫХ САЙТА
Белковая среда оказывает большое влияние на переходные металлы, присутствующие в активных центрах металлоферментов. В частности, воздействие растворителя, а также природа донорных лигандов, участвующих в координации металлов, в значительной степени определяют химические свойства металлических активных центров.Белковый каркас имеет защитный эффект от окислительного повреждения анаэробных ферментов, где активный центр часто локализован в скрытом положении с ограниченным доступом к растворителю. Это подразумевает существование специализированных каналов, контролирующих диффузию продуктов и субстратов, специфических протонных каналов и кластеров FeS в качестве электронных реле между активным центром и физиологическим партнером (ами) (как в случае CODH, ACS, гидрогеназ, MCR; Рисунок 3). Локально природа координирующих лигандов управляет окислительно-восстановительными свойствами металла, регулируя окислительно-восстановительные потенциалы, необходимые для биологических процессов, и предоставляя доступ к различным окислительно-восстановительным состояниям, задействованным во время катализа.Чтобы удовлетворить этот спрос, в окислительно-восстановительных ферментах отдается предпочтение средам, богатым лигандами, богатыми S-донорами. Напротив, в нередокс-ферментах, где Ni (II) действует как кислотный катализатор Льюиса, предпочтение отдается O / N-донорным лигандам. Кристаллография белков сыграла решающую роль в характеристике активного центра Ni-ферментов.
Активные центры Ni-ферментов. S-доноры: сравнение природного сульфидного никелевого макинавита, грейгита и виоларита и ранних никелевых ферментов (адаптировано из ссылки 46).Атомы, координирующие активный центр и никель, находятся в сферах. Ni отображается зеленым цветом, азот — синим, сера — желтым, а кислород — красным. W, молекула воды4,1
Цистеиновая средаCODH, ACS и [NiFe] -H 2 азы имеют общий двухъядерный активный центр Ni – Ni / Fe, координированный с белком через один или несколько остатков цистеина с мостиковой позицией для связывания субстрата / продукта / промежуточного соединения в CODH и [NiFe] -h3ase (Рисунок 3).Эти три фермента определены как ферменты, предшествующие последнему универсальному общему предку (LUCA), активные центры которых проявляют структурное сродство с природными катализаторами на основе сульфидов металлов46
Определение первой кристаллической структуры [NiFe] -H 2 -азы и характеристика его активного центра в 1995 году оказали значительное влияние на научное сообщество.33 Во-первых, структура раскрыла природу биядерного активного центра NiFe. сайт. Во-вторых, карта электронной плотности показала существование трех двухатомных лигандов, связанных на концах Fe.По данным FTIR-исследований, они были отнесены к одному CO и двум лигандам CN –. 47 Ni координируется с белком через два мотива CXXC. Два тиолата цистеина (по одному от каждого мотива) связывают Fe и Ni, в то время как два других тиолата цистеина на концах связывают Ni. В [NiFeSe] -гидрогеназах один из концевых цистеинов заменен селеноцистеином. Координационная сфера Fe дополняется тремя двухатомными лигандами, оставляя доступный мостик Ni-Fe для связывания субстрата. Связывание активного центра Fe с лигандами CO и CN — способствует низкому окислительно-восстановительному состоянию иона металла, делая его относительно мягкой кислотой Льюиса, способствуя его связыванию с мягким основанием Льюиса H —, что является вероятной стадией. в катализе.Во время катализа никель подвергается окислительно-восстановительному переходу от Ni (II) к Ni (III) .11
Рентгеновская структура CODH выявила уникальную природу активного центра, искаженного [NiFe 3 S 4 ] кубана, координированного с моноядерным сайтом Fe (Fe1) (рис. 3) .29 Белок обеспечивает концевой цистеин. тиолатный лиганд как для Ni, так и для Fe1 и гистидиновый лиганд для Fe1. Координация Ni завершается двумя неорганическими S из кластера и лабильным положением, в котором субстрат / продукт (CO или CO 2 ) связывается, в то время как молекула воды связывается с Fe1.28 Кристаллические структуры ACS / CODH выявили природу активного центра (A-кластера) ACS.30 Этот биядерный сайт состоит из проксимального Ni (Ni p ), который является каталитическим центром, связанным с [4Fe- 4S] через мостиковый тиолат цистеина. Ni p связан мостиком с дистальным Ni (Ni d ) через два дополнительных тиолата цистеина. Присутствует лабильное положение для связывания субстрата и / или промежуточных продуктов. Что касается Ni d , его координация обеспечивается двумя тиолатами и двумя амидными группами основной цепи (одна из Gly и одна из Cys) из необычного мотива Cys-Gly-Cys в S 2 N 2 плоских квадратных геометрия.Постулируется, что Ni d не участвует в окислительно-восстановительной химии и остается в состоянии Ni (II). Было предложено играть роль либо поддерживающего лиганда для стабилизации проксимального никеля на низковалентном окислительно-восстановительном уровне, либо для создания открытого сайта на каталитическом металле благодаря его гемилабильному свойству раскрытия кольца.48, 49 Ni p , с другой стороны, представляет различные степени окисления во время катализа.
Идентификация NiSOD как окислительно-восстановительного фермента подчеркнула роль белкового окружения центра Ni как в поддержании степени окисления Ni (III), так и в снижении потенциала пары Ni (III) / (II) более чем на 2 В.Сайт связывания металла фактически образован N-концевым «крючком Ni», который координирует ион Ni через тиолатную и амидатную группы цистеина 2, тиолатную группу цистеина 6 и аминовую и имидазольную группы гистидина 1.16. Координация связывания никеля изменяется в соответствии со степенью окисления металла, переходя от пирамидальной геометрии для окисленного состояния Ni (III) к плоской квадратной геометрии N 2 S 2 для восстановленного Ni (II), теряя апикальную донор имидазола (рис. 3).В то время как тиолатные и имидазольные лиганды имеют решающее значение для поддержания окислительно-восстановительного состояния иона никеля, роль смешанной амино-амидатной координации является предметом различных исследований.50-52 Были синтезированы несколько модельных пептидов и комплексов NiSOD, в которых N-донор лиганды варьировались от естественной смешанной амино-амидатной среды до бис-амидатной, что приводило исключительно к каталитически неактивным частицам. Одна из причин заключается в том, что бис-амидатные комплексы считаются более реактивными по отношению к O 2 .Таким образом, смешанная координация амин / амидат будет необходима для повышения устойчивости к субстратам и продуктам реакции.
4,2
Окружающая среда, богатая гистидиномОкружающая среда, богатая гистидином, содержится в трех нередокс-ферментах, а именно, уреаза, ARD и GlxI, где никель находится в состоянии окисления Ni (II) (рис. 3).
В случае уреазы активный центр представляет собой диядерный центр с двумя ионами никеля, пространственно разделенными на 3.5–3,7 Å, соединенный мостиком карбамилированного остатка лизина и координированный двумя остатками гистидина.20 Молекулы воды заполняют оставшиеся координационные позиции, образуя пентакоординированную искаженную квадратно-пирамидальную геометрию (Ni1), в то время как второй никель (Ni2) дополнительно связан к аспартату, что приводит к гексакоординированной искаженной октаэдрической геометрии. Недавно была решена рентгеновская структура уреазы в комплексе с ее субстратом, что показало, что мочевина связывается в мостиковом положении между двумя сайтами Ni.53
В GlxI координация никеля включает гистидин и глутаминовую кислоту каждого мономера, а также две молекулы воды для завершения октаэдрической геометрии, необходимой для катализа. В ARD характеристика лиганда с помощью спектроскопических исследований и исследований мутагенеза позволила предположить октаэдрическую координационную геометрию для обоих металлов с участием трех гистидинов и одной глутаминовой кислоты в качестве возможных доноров, дополненных двумя дополнительными водами.43
4,3
Ni-содержащие кофакторыВ метаногенах развились уникальные кофакторы, присущие только этой группе архей.В MCR было показано, что никель является составной частью низкомолекулярного кофактора (F430), идентифицированного как производное тетрапиррола, также известного как корфин (рис. 3) .37 Это наиболее восстановленный комплекс тетрапиррола с металлом, встречающийся в природе. Название кофактора происходит от его полосы поглощения, точно при 430 нм, в степени окисления Ni (II). Состояние Ni (I) также участвует во время катализа, подразумевая, что для его функциональности требуется жесткий контроль окислительно-восстановительного состояния металла. F 430 не связан ковалентно с белком.Кольцо кофактора F 430 хелатирует ион никеля, и его координация завершается через аксиальный глутамин 147 на стороне, противоположной каналу. Trans к последнему, есть свободный сайт, доступный для связывания субстрата и продукта.
В Lp LarA, производное мононуклеотида никотиновой кислоты с двумя добавленными тиокарбоксилатными группами, одна из которых образует тиоамид с лизином 184, присутствует в активном сайте и называется никелево-клещевым нуклеотидом (NPN) 42 (Рисунок 3) .Пинцетные комплексы не новы в химии, но примечательно, что это единственный пример такой молекулы в ферменте. Никель связан в искаженном плоском расположении с кофактором NPN через окружение лиганда SCS на основе мононуклеотида пиридиний-3,5-бистиокарбоновой кислоты. Кофактор ковалентно связан с белком через тиоамидную связь с остатком лизина, а координационная сфера никеля дополняется гистидином 200. Стабильная связь NiC в состоянии покоя / стабильности этого фермента является неожиданной.Действительно, в других Ni-содержащих ферментах связи NiC наблюдались только как промежуточные продукты реакции.18 Эта координация важна для гарантии стабильности металла в комплексе. Фактически, похоже, что переключение между открытой и закрытой конформациями происходит из-за искажения координации NPN-клещей и смещения His200.
5 БИОСИНТЕЗ МЕТАЛЛОЦЕНТРА
В клетку никель должен быть правильно доставлен и включен в желаемые активные центры ферментов.Эти процессы часто требуют сложной команды дополнительных белков, работающих согласованно для биосинтеза этих сложных ферментов металлокластеров. Добавление избытка Ni (II) к микробным культурам часто может компенсировать нехватку их специализированных вспомогательных белков, что приводит к частично активированным ферментам. Это предполагает, что процесс созревания может протекать спонтанно, но не через полностью эффективный процесс. Более того, учитывая низкий уровень никеля в клетке, необходим механизм созревания, который хорошо организован в пространстве и времени.Хотя шапероны никеля, участвующие в биогенезе нескольких активных центров, были тщательно охарактеризованы, понимание их роли на молекулярном уровне на этапах доставки никеля еще предстоит выяснить. Фактически, эти исследования очень сложны из-за модульности свойств связывания никеля и аллостерических регуляций, вызванных взаимодействиями белок / белок или взаимодействиями белок / металл. В следующем разделе обсуждаются пути созревания уреазы, H 2 азы, LarA, MCR, CODH и ACS.Что касается других ферментов, мало что известно о биосинтезе их активных центров. Общим для всех описанных механизмов созревания является наличие фактора созревания, гидролизующего NTP, принадлежащего к SIMIBI-классу NTPаз, 54 богатого гистидином белка (HRP) и, в конечном итоге, дополнительных никелевых шаперонов.18 NTPases потенциально играют регулирующую роль посредством влияя на взаимодействие партнеров в белковых комплексах или сродство к иону никеля, в то время как HRP часто описывается как запасные белки.
5.1
УреазаУреаза сначала продуцируется в апо-форме, которую затем необходимо активировать двумя основными этапами: карбамилированием лизина и введением никеля в активный сайт.20 Учитывая скрытое положение этого сайта в апо-белке, возникновение Модификация сворачивания белка, как ожидается, сделает возможным внедрение никеля. Помимо трех субъединиц фермента, кластер генов уреазы кодирует четыре дополнительных белка: UreD / H, UreE, UreF и UreG, участвующих в доставке никеля и созревании уреазы.Созревание уреазы зависит от гидролиза GTP, катализируемого никель-зависимой GTPase UreG, 80 и требует образования комплекса UreFGH-уреаза. С другой стороны, UreE описывается как металло-шаперон, который обеспечивает Ni (II) ферменту, 81, 82 посредством его взаимодействия с UreG. Интересно, что UreG был идентифицирован как внутренне неупорядоченный белок (IDP) с очень низкой активностью GTPase, которая значительно усиливается за счет образования комплекса.80 Комплекс UreH 2 F 2 G 2 был выделен и кристаллизован , 83 раскрывая существование водного туннеля, берущего свое начало от Ni-связывающего сайта UreG, расположенного на границе раздела димеров, проходящего через UreF и выходящего из UreD / H84, чтобы, наконец, обеспечить Ni (II) активным центром уреазы, что подтверждается структурными моделями.
С учетом самых последних результатов была постулирована модель для общего пути созревания уреазы, в которой подчеркивается роль конформационных изменений в UreG во время гидролиза GTP / связывания партнера (Рисунок 4) .85 В этом сценарии UreH 2 F 2 G 2 комплекс дестабилизируется GTP-связыванием, вызывая высвобождение UreG 2 и позволяя его взаимодействовать с Ni-UreE 2 с образованием Ni- (UreEG) 2 сложный.За переносом Ni (II) от UreE к UreG следует диссоциация комплекса, и комплекс, связанный с уреазой (UreHF) 2 , затем будет взаимодействовать с Ni- (UreG) 2 . Последующий гидролиз GTP вызывает конформационные изменения, способствующие высвобождению никеля из UreG в апо-уреазу через UreH и UreF. GDP-UreG 2 затем предпочитает связываться с (UreHF) 2 , регенерируя UreH 2 F 2 G 2 .
Созревание уреазы.В этом механизме димер UreG, заряженный никелем, привлекается для образования активационного комплекса с апоуреазой и UreF 2 H 2 . Гидролиз GTP способствует высвобождению никеля для созревания уреазы (адаптировано из ссылки 85)5,2
[NiFe] -гидрогеназаБиосинтез биядерного активного центра [NiFe] -гидрогеназы представляет собой многоступенчатый процесс с тремя последовательными событиями: (i) Fe (CN) 2 Биосинтез и внедрение CO-центра с последующей (ii) доставкой никеля и, наконец, (iii) ) удаление C-концевого хвоста (CTT) большой субъединицы (LSU) для фиксации активного сайта на месте (рис. 5).55 После обработки зрелая LSU связывается с малой субъединицей (SSU), а в случае мембраносвязанных и периплазматических ферментов зрелая димерная форма экспортируется через систему Twin-Arginine Translocation (TAT). Требуются по крайней мере шесть строго консервативных дополнительных белков, а именно HypABCDEF, 56 для биосинтеза активного сайта, в дополнение к никелевому шаперону SlyD, обнаруженному в некоторых микроорганизмах57, и специфической протеазе, расщепляющей CTT (HycI в E. coli ). Более подробно, LSU созревает в соответствии со следующими этапами.Сначала HypEF опосредует образование центра Fe (CN) 2 CO совместно с HypCD. Предполагается, что HypC координирует фрагмент Fe (CN) 2 CO через Cys2 вместе с Cys41 HypD и напрямую взаимодействует с предшественником LSU. После этого шага следует встраивание этого центра Fe в белок.
Созревание [NiFe] -гидрогеназы. Предлагаемый механизм биосинтеза ферментов разделен на три последовательных этапа.1. Фрагмент Fe (CN) 2 CO синтезируется до его введения в фермент. 2. Никель вводится непосредственно в фермент (адаптировано из ссылки 60). 3. Протеолиз С-концевого хвоста необходим для стадии активации фермента (адаптировано из ссылки 64).Встраивание Ni происходит посредством NTP-зависимого механизма, опосредованного Ni / Zn-зависимой NTPase HypB, 58, никелевым шапероном HypA, 59 и в некоторых случаях SlyD. В H. pylori , HypA и HypB также задействованы для созревания уреазы посредством их соответствующего взаимодействия с UreE и UreG.21 В E. coli HypB явно взаимодействует индивидуально с HypA и SlyD, но не взаимодействует напрямую с LSU.60 Роль SlyD не совсем понятна, несмотря на его высокое сродство (в диапазоне нМ) к HypB: это считается, что способствует высвобождению Ni (II) из HypB по отношению к другим партнерам, 61 но также предотвращает взаимодействие HypB-HypA в конкурентных экспериментах, предполагая поэтапный процесс с HypB в качестве центрального компонента.60 HypA содержит два металлических сайта, структурный Zn (II) сайт и уникальный сайт связывания Ni (II) на N-конце.Недавно двойной ЯМР и вычислительный подход показали, что HypA представляет собой удлиненный белок с двумя металлсвязывающими доменами, соединенными гибким линкером, причем Ni (II) -связывание стабилизирует N-концевую спираль и, вероятно, влияет на его взаимодействие с партнером.59 В текущей модели HypA служит никелевым реле от HypB к предшественнику LSU. HypB обладает строго консервативным сайтом связывания Ni / Zn, встроенным в домен NTPase (G-домен), в то время как в некоторых случаях присутствуют дополнительные богатые гистидином кластеры и / или N-концевой сайт с высоким сродством, функция которого не совсем понятна. .62 Недавние исследования показали, что гидролиз GTP управляет взаимодействием между HypA и HypB посредством образования комплекса Ni-HypB 2 A, при этом Ni (II) быстро переносится в HypA из HypB, нагруженного GDP 2 , индуцированного резким конформационным воздействием. изменение и повышенное сродство HypA к Ni (II), когда он находится в комплексе с HypB, с последующей диссоциацией комплекса HypAB 2 и образованием комплекса Ni-HypA / LSU.63
Протеолитическое расщепление С-концевого хвоста LSU представляет собой стимулируемый никелем ключевой этап в процессе биосинтеза [NiFe] -H 2 азов, подчеркивая ключевую роль Ni в распознавании эндопептидазы во время процесса созревания.64 Роль CTT состоит в том, чтобы разрешить взаимодействие с механизмом Hyp, избегая при этом преждевременного взаимодействия с SSU. Недавняя кристаллическая структура преждевременного LSU в комплексе с HypA показала, что внедрение Ni в активный центр вызывает пространственные перестройки в LSU. В этом сценарии CTT принимает конформацию ß-цепи и формирует ß-лист с N-концевыми ß-цепями, предотвращая доступ эндопептидазы к его сайту узнавания. Нагруженный Ni HypA взаимодействует как с N-концом, так и с C-концевым удлинением, помещая Ni-связывающий сайт HypA в непосредственную близость к активному сайту H 2 азы, вероятно, обеспечивая прямой перенос металла.Взаимодействие Ni с одним из координирующих цистеин лигандов в активном центре вызывает конформационные изменения, а также высвобождение и воздействие растворителя CTT. Дополнительные молекулярно-динамические исследования показали, что CTT является внутренне неупорядоченной областью (IDR), что способствует его распознаванию протеазой и последующему образованию зрелого фермента.65
Несмотря на обширные исследования этого фермента, все представленные здесь данные подчеркивают сложность определения точного механизма биосинтеза активного сайта и предложения универсальной модели созревания азы H 2 .
5,3
Дегидрогеназа монооксида углеродаЧто касается гидрогеназы, созревание [NiFe] -CODH представляет собой многоступенчатый процесс, включающий два последовательных события: начальное внедрение кластера FeS с последующей доставкой никеля. Процесс биосинтеза C-кластера начинается со вставки атомов Fe и S с образованием кластера Fe 4 S 4 , что, вероятно, выполняется классическими механизмами ISC / SUF, ответственными за биогенез кластеров FeS, как показано на примере производства. полностью загруженного FeS CODH, полученного в E.coli с помощью механизма ISC.66 Следующим шагом является внедрение атома Ni благодаря трем никельсвязывающим белкам: CooC, CooT и CooJ.67 Филогенетический анализ показал, что CooC широко распространен в микроорганизмах, обладающих [NiFe] — CODH, как правило, находится в опероне с ферментом и необходим для созревания CODH в физиологических условиях.68 Напротив, CooT и CooJ труднее идентифицировать в геномах. Хотя CooC описывается как главный игрок в созревании CODH, CooJ и CooT, тем не менее, имеют отношение к доставке никеля в CODH в R.rubrum in vivo.67 Более того, недавний филогенетический анализ выявил существование по крайней мере 111 гомологов CooT у анаэробных архей и бактерий69 и по крайней мере 46 гомологов CooJ у бактерий, 70 предполагая различные пути созревания CODH с CooC +/− CooT и / или CooJ. CooC — это никель-зависимая АТФаза, принадлежащая к тому же классу, что и UreG и HypB, и демонстрирующая аналогичную взаимную корреляцию между гидролизом нуклеотидов и связыванием никеля.71 Гипотеза состоит в том, что фермент динамически циклически переключается между открытым состоянием Ni (II) и закрытым состоянием. АТФ-зависимое состояние, которое приводит к высвобождению металла.72 Недавняя характеристика CooJ из R. rubrum показала, что белок представляет собой гомодимер, состоящий из спиральной спирали, фланкированной двумя отдельными гистидиновыми хвостами. 70 Все гомологи CooJ обладают двумя пространственно разделенными никель-связывающими мотивами: вариабельным С-концевым гистидином. хвост и строго консервативный мотив «H- (W / F) -X 2 -HX 3 -H», связывающий Ni (II) в наномолярном диапазоне, что предполагает двойную функцию CooJ как шаперона Ni и как запасной белок Ni.73 CooT — это дополнительный шаперон никеля, обладающий специфическими особенностями.Гомологи 111 CooT демонстрируют удивительно большую вариабельность, при этом Cys2 является единственным строго консервативным остатком. Эволюционная консервация цистеина, подвергающегося воздействию растворителя, в белке CooT предполагает его важность для выполнения конкретной и важной функциональной роли, которую еще предстоит обнаружить. В семействе CooT были идентифицированы два разных Ni (II) -связывающих мотива, а именно «Cys2» (около 30% белков CooT) и «Cys2His55». Недавнее исследование группы мотивов «Cys2» предполагает, что диамагнитный Ni (II) имеет плоско-квадратную геометрию с бисамидатными / бис-тиолатными лигандами, координированными одним цистеиновым мотивом.Это было бы беспрецедентным в биологии и поднимает вопрос о его роли в активации CODH на молекулярном уровне.
Мессбауэровские и ЭПР-исследования показали, что одноядерный сайт Fe (Fe1), присутствующий в С-кластере в Rr CODH, наблюдается только в присутствии никеля. Следовательно, включение никеля в C-кластер, вероятно, изменяет координационное окружение одного атома железа.75 Сайт-направленный мутагенез остатков, координирующих C-кластер в Rr CODH, подчеркивает, что единственным критическим остатком, необходимым для связывания Ni, является His265.76 Удивительно, но все мутанты цистеина, даже тот, который влияет на остаток, непосредственно участвующий в координации Ni, содержат один эквивалент Ni на мономер, предполагая, что ион Ni (II) связан с другим положением в белке, образуя предполагаемое промежуточное состояние. Напротив, His265, который координирует одноядерный ион Fe1, является важным остатком в биогенезе C-кластера. Если предшественником С-кластера является классический кубановый кластер Fe 4 S 4 , как показали спектроскопические исследования, внедрение никеля будет означать разрыв связи с участием His265 и Cys300.Самые недавние структурные исследования CODH из Desulfovibrio vulgaris ( Dv CODH) показали большую пластичность C-кластера и согласуются с теорией «разрыва связи» с His266 (His265 в Rr CODH) и Cys302 (Cys300 в Rr CODH), служащий сайтом связывания никеля перед его переносом в его стабильный активный сайт (Рисунок 6a.77, 78 В Dv CODH, d-кластер представляет собой центр Fe 2 S 2 которые будут участвовать во внедрении никеля, опосредуя перенос электронов, работая совместно с CooC, чтобы контролировать окислительно-восстановительное состояние активного центра, обеспечивая, таким образом, правильную металлизацию кластера.Необходимость восстановленного промежуточного кластера в механизме подкрепляется требованием восстанавливающих условий для активации Ni-дефицитного CODH in vitro путем добавления солей никеля в раствор. Хотя его никогда не наблюдали спектроскопически, прекластер [Fe 3 S 4 ] -Fe1 мог бы быть ключевым промежуточным звеном в биосинтезе С-кластера непосредственно перед введением никеля. На сегодняшний день существует много неопределенностей относительно внедрения никеля в C-кластер, механизма, который, по-видимому, не является прямым и, вероятно, осложняется присутствием сайта Fe1.
Созревание ACS / CODH. (а) Предлагаемый механизм созревания CODH: атомы Fe и S сначала вставляются с образованием классического кластера [Fe 4 S 4 ]. Следующие шаги остаются неясными для получения активного C-кластера (адаптировано из ссылки 77). (b) Предлагаемый механизм созревания ACS (адаптировано из ссылки 79)5,4
Ацетилкофермент А-синтазаМало что известно о созревании ACS и о том, как формируется и вставляется своеобразный A-кластер.Что касается CODH и [NiFe] -H 2 -азы, внедрение никеля, по-видимому, является вторым этапом биосинтеза фермента. Недавно было показано, что АТФаза AcsF участвует в биогенезе активного центра.79 Первоначально были идентифицированы две основные группы белков CooC в зависимости от их геномного контекста: «CooC-подобная» группа, расположенная в монофункциональных оперонах CODH, и «AcsF-подобная» группа, обнаруженная в оперонах ACS / CODH (или кластерах генов). Изучение AcsF из C. Hydrogenoformans показало, что этот фермент действительно необходим для активации ACS и не может быть заменен белками CooC.В свете этих результатов, следует рассмотреть разделение на два различных класса CooC и AcsF, участвующих в созревании CODH и ACS, соответственно. Было высказано предположение, что образование комплекса AcsF / ACS индуцирует создание по крайней мере одного высокоаффинного сайта связывания Ni (рис. 6b).
5,5
Лактат рацемазаСреди -ми кластеров генов , LarB отвечает за биосинтез мононуклеотида пиридиния 3,5-бикарбоновой кислоты (P2CMN), катализируя карбоксилирование адениндинуклеотида никотиновой кислоты (NaAD).86 Впоследствии LarE превращает P2CMN в мононуклеотид пиридиний-3,5-бикарбоновой кислоты (P2TMN) посредством двух реакций переноса серы, а LarC обеспечивает никель для образования активной формы клешневого кофактора, который будет связываться с LarA. 87, 88 LarE принадлежит к группе Семейство пирофосфатаз PP-петли и имеет два независимых домена: N-концевой домен, содержащий консервативный мотив SGGXDS PP-петли, и C-концевой домен, который не является общим для любого члена этого семейства АТФаз N-типа, что свидетельствует о двойной функции для LarE.Фермент катализирует AMPилирование карбоксильных групп пиридиния с последующим переносом серы через консервативный цистеин 176, присутствующий в С-концевой части белка в качестве донора серы, для преобразования P2CMN в P2TMN. Эта гипотеза была недавно доказана благодаря определению кристаллических структур LarE из L. plantarum и его мутанта C176A в их апо-форме и в комплексе с коферментом A (CoA) .87 Это исследование in vitro выявило существенные роль Cys176 как каталитического сайта для вставки серы, а также роль CoA persulfilde в регенерации активного LarE, хотя физиологическая значимость этого механизма циклирования остается неясной.Наконец, LarC будет напрямую вставлять никель в неполный клещевой лиганд, все еще связанный с LarE, способствуя образованию никелевого клещевого нуклеотида, который затем переносится на LarA (рис. 7a) .89 LarC образует две связи SNi и своеобразная стабильная связь CNi. В отличие от других дополнительных белков никеля, это единственный пример, способный катализировать образование связи CNi путем встраивания металла в органическую молекулу посредством CTP-зависимого циклометаллирования, вызывая возможную конформационную модификацию.Из последовательности LarC была идентифицирована область, богатая His, которая не является строго необходимой для активности LarC, как возможное хранилище никеля. Структура C-концевого домена была решена в присутствии или в отсутствие CTP, что позволило идентифицировать специфический сайт связывания, который не соответствует какому-либо известному мотиву связывания нуклеотидов.90 Однако, как гидролиз CTP связан с никелем Прошивка еще предстоит изучить.
Созревание LarA и MCR.(а). Предлагаемый механизм биосинтеза нуклеотида никелевых клещей с последующим его включением в LarA (адаптировано из ссылки 89). (б). Биосинтетический путь кофермента F430 с помощью оборудования Cfb (адаптировано из ссылки 91) и предложенная рабочая модель для сборки MCR (адаптирована из ссылки 93)5,6
MCRПрисутствие кофермента F430 в MCR привело к поиску специфических хелатаз, которые, как известно, катализируют металлирование встречающихся в природе тетрапрололов.Несколько лет назад пять генов, обозначенных как cfbABCDE , консервативных во всех метаногенах, были идентифицированы как ответственные за биосинтез этого специфического кофактора.91, 92 Для трансформации предшественника сирогидрохлорина в кофермент F430 необходимы четыре ферментативных стадии (рис. 7b). Первый этап выполняется белком CfbA, который, как было показано, представляет собой специфическую хелатазу никеля (CfbA), способствующую встраиванию Ni в сирогидрохлорин; Затем предложены два механизма, в которых CfbB или CfbE катализируют амидирование двух карбоксильных групп с образованием промежуточного амида Ni-сирогидрохлорина a, c .После стадии восстановления благодаря белку Fe CfbC и белку MoFe CfbD, оба гомолога белкам NifH и NifD, соответственно, участвуют в биосинтезе нитрогеназы. Наконец, CfbE или CfbF могут действовать как активатор г -пропионатной боковой цепи для образования внутримолекулярной связи CC с образованием карбоксильного F-кольца и, таким образом, действовать как кофермент F430-синтаза. На данный момент сборка активного MCR не совсем понятна. Кластер генов mcrBDCGA содержит два консервативных гена, mcrC и mcrD , функция которых неизвестна.Была предложена рабочая модель, в которой McrB будет служить каркасом для сборки др. Субъединиц (Figure 7b) .93 Комплекс McrBDGA будет сформирован первым. McrD будет как предотвращать сворачивание субъединицы McrA для обеспечения правильных посттрансляционных модификаций, так и способствовать встраиванию кофермента F430, который приведет к высвобождению McrD перед заключительной стадией активации, на которой McrC может принадлежать комплексу редуктазы, обеспечивающему образование и стабилизация активного состояния Ni (I).
БЛАГОДАРНОСТИ
Работа поддержана «Программой ITERLIS PhD, CEA Life Sciences» для финансирования со стороны магистра наук. Эта работа частично поддержана Labex ARCANE и CBH-EUR-GS (ANR-17-EURE-0003).
КОНФЛИКТ ИНТЕРЕСОВ
Авторы заявляют, что у них нет конфликта интересов по поводу содержания этой статьи.
ССЫЛКИ
- 1Konhauser KO, Pecoits E, Lalonde SV, et al.Истощение запасов никеля в океане и голод по метаногену перед великим окислительным событием. Природа . 2009; 458: 750–753.
- 2Thauer RK. Моя давняя страсть к биохимии и анаэробным микроорганизмам. Анну Рев Микробиол . 2015; 69: 1–30.
- 3Конхаузер К.О., Роббинс Л.Дж., Пекойц Э., Павлин С., Капплер А., Лалонд С.В.Возвращение к архейскому никелевому голоду. Астробиология . 2015; 15: 804–815.
- 4Wang SJ, Rudnick RL, Gaschnig RM, Wang H, Wasylenki LE. Метаногенез поддерживается сульфидным выветриванием во время великого окислительного события. Нат Геоши . 2019; 12: 296–300.
- 5Рэймонд Дж., Сегре Д. Влияние кислорода на биохимические сети и эволюцию сложной жизни. Наука . 2006; 311: 1764–1767.
- 6Fontecilla-Camps JC, Amara P, Cavazza C, Nicolet Y, Volbeda A. Структурно-функциональные взаимосвязи анаэробных металлоферментов при переработке газа. Природа . 2009; 460: 814–822.
- 7Боер Дж. Л., Малруни С. Б., Хаусингер Р. П.. Никельзависимые металлоферменты. Арч Биохим Биофиз .2014; 544: 142–152.
- 8Замбелли Б., Уверский В.Н., Чурли С. Влияние никеля на здоровье человека: взгляд на внутренние нарушения. Биохимический протеин Biophys Acta Proteins . 2016; 1864: 1714–1731.
- 9MacOmber L, Hausinger RP. Механизмы токсического действия никеля на микроорганизмы. Металломика . 2011; 3: 1153–1162.
- 10Li Y, Zamble DB. Гомеостаз никеля и регулирование никеля: обзор. Chem Rev. . 2009; 109: 4617–4643.
- 11Fontecilla-Camps JC, Volbeda A, Cavazza C, Nicolet Y. Взаимосвязь между структурой и функцией [NiFe] — и [FeFe] -гидрогеназ. Chem Rev. . 2007; 107: 4273–4303.
- 12Робб Ф.Т., Тектманн С.М.Жизнь на периферии: адаптация микробов к росту на угарном газе. F1000 Исследование . 2018; 7.
- 13Adam PS, Borrel G, Gribaldo S. История эволюции монооксиддегидрогеназы углерода / ацетил-КоА-синтазы, одного из старейших ферментативных комплексов. Proc Natl Acad Sci U S A . 2018; 115: E1166– E1173.
- 14Evans PN, Boyd JA, Leu AO, et al.Эволюция взглядов на метаболизм метана у архей. Натр Рев Микробиол . 2019; 17: 219–232.
- 15Kietäväinen R, Purkamo L. Происхождение, источник и круговорот метана в биосфере глубоких кристаллических пород. Фронтальный микробиол . 2015; 6: 725.
- 16Sheng Y, Abreu IA, Cabelli DE, et al. Супероксиддисмутазы и супероксидредуктазы. Chem Rev. . 2014; 114: 3854–3918.
- 17Youn HD, Kim EJ, Roe JH, Hah YC, Kang SO. Новая никельсодержащая супероксиддисмутаза из Streptomyces spp. Биохимия J . 1996; 318: 889–896.
- 18Замбл Д. Введение в биологическую химию никеля. РНЦ Металлобиология 2017; 2017: 1–11.
- 19Dixon NE, Gazzola C, Blakeley RL, Zerner B.Уреаза фасоли (EC 3.5.1.5). Металлофермент. Простая биологическая роль никеля? Дж. Ам Хем Соц . 1975; 97: 4131–4133.
- 20Маззей Л., Мусиани Ф., Чурли С. Уреасе. РНЦ Металлобиология. Vol. 2017. С. 60–97; 2017 г.
- 21De Reuse H, Vinella D, Cavazza C. Общие темы и уникальные белки для поглощения и транспортировки никеля, металла, необходимого для вирулентности Helicobacter pylori. Микробиол для фронтальных клеточных инфекций . 2013; 3: 94.
- 22Clugston SL, Barnard JFJ, Kinach R, et al. Избыточное производство и характеристика димерной нецинковой глиоксалазы I из Escherichia coli : доказательства оптимальной активации ионами никеля. Биохимия . 1998; 37: 8754–8763.
- 23Dai Y, Wensink PC, Abeles RH.Один белок, два фермента. Дж Биол Химия . 1999; 274: 1193–1195.
- 24Chai SC, Ju T, Dang M, Goldsmith RB, Maroney MJ, Pochapsky TC. Характеристика связывания металлов в активных центрах изоформ ациредуктондиоксигеназы из Klebsiella ATCC 8724. Биохимия . 2008; 47: 2428–2438.
- 25Дешпанде А.Р., Вагенпфейл К, Почапский ТЦ, Петско Г.А., Ринге Д.Металл-зависимая функция ациредуктон-диоксигеназы млекопитающих. Биохимия . 2016; 55: 1398–1407.
- 26Miłaczewska A, Kot E, Amaya JA, et al. О структуре и механизме реакции ациредуктон-диоксигеназы человека. Химия . 2018; 24: 5225–5237.
- 27Desguin B, Goffin P, Viaene E, et al.Лактатрацемаза — это никель-зависимый фермент, активируемый широко распространенной системой созревания. Нац Коммуна . 2014; 5: 3615.
- 28Drennan CL, Heo J, Sintchak MD, Schreiter E, Ludden PW. Жизнь на окиси углерода: рентгеновская структура дегидрогеназы окиси углерода Ni-Fe-S Rhodospirillum rubrum. Proc Natl Acad Sci U S A . 2001; 98: 11973–11978.
- 29Доббек Х., Светличный В, Гремер Л, Хубер Р., Мейер О.Кристаллическая структура дегидрогеназы монооксида углерода выявляет кластер [Ni-4Fe-5S]. Наука . 2001; 293: 1281–1285.
- 30 Дарно С., Волбеда А., Ким Э. Дж. И др. Кластеры Ni-Zn- [Fe4-S4] и Ni-Ni- [Fe4-S4] в закрытых и открытых α-субъединицах ацетил-CoA-синтазы / дегидрогеназы монооксида углерода. Нат Структур Биол . 2003; 10: 271–279.
- 31Дуков Т.И., Иверсон Т.М., Серавалли Дж., Рэгсдейл, SW, Дреннан, CL.Центр Ni-Fe-Cu в бифункциональной дегидрогеназе монооксида углерода / ацетил-КоА-синтазе. Наука . 2002; 298: 567–572.
- 32Gencic S, Grahame DA. Никель в субъединице β мультиферментного комплекса ацетил-CoA декарбонилаза / синтаза в метаногенах: каталитические свойства и доказательства наличия биядерного сайта Ni-Ni. Дж Биол Химия . 2003; 278: 6101–6110.
- 33Вольбеда А, Харон М.Х., Пирас С., Хатчикян Э.Ц., Фрей М., Фонтекилла-Кэмпс ЮК.Кристаллическая структура никель-железной гидрогеназы из Desulfovibrio gigas . Природа . 1995; 373: 580–587.
- 34Garcin E, Vernede X, Hatchikian EC, Volbeda A, Frey M, Fontecilla-Camps JC. Кристаллическая структура восстановленной гидрогеназы [NiFeSe] дает изображение активированного каталитического центра. Строение . 1999; 7: 557– 566.
- 35 Волбеда А., Амара П., Дарно С. и др.Рентгеноструктурные и компьютерные исследования O 2-толерантной [NiFe] -гидрогеназы 1 из Escherichia coli . Proc Natl Acad Sci U S A . 2012; 109: 5305–5310.
- 36Ermler U, Grabarse W, Shima S, Goubeaud M, Thauer RK. Кристаллическая структура метил-коэнзим М-редуктазы: ключевой фермент биологического образования метана. Наука . 1997; 278: 1457–1462.
- 37Cedervall PE, Dey M, Li X, et al.Структурный анализ Ni-метиловых частиц в метил-кофермент M редуктазе из methanothermobacter marburgensis. Дж. Ам Хем Соц . 2011; 133: 5626–5628.
- 38Deobald D, Adrian L, Schöne C, Rother M, Layer G. Идентификация уникальной радикальной метилтрансферазы SAM, необходимой для sp3-C-метилирования остатка аргинина метил-коэнзим M редуктазы. Научный сотрудник . 2018; 8: 7404.
- 39Вергес Дж., Ли Дж. В., Йим Йи, Йим Х.С., Кан С.О., Каруго К.Д.Кристаллическая структура никельсодержащей супероксиддисмутазы выявляет другой тип активного центра. Proc Natl Acad Sci U S A . 2004; 101: 8569–8574.
- 40Kappaun K, Piovesan AR, Carlini CR, Ligabue-Braun R. Уреазы: исторические аспекты, каталитические и некаталитические свойства — обзор. J Adv Res . 2018; 13: 3–17.
- 41Ciurli S, Benini S, Rypniewski WR, Wilson KS, Miletti S, Mangani S.Структурные свойства ионов никеля в уреазе: новые сведения о каталитических механизмах и механизмах ингибирования. Обзоры по координации химии . 1999; 190–192: 331– 355.
- 42Desguin B, Zhang T, Soumillion P, Hols P, Hu J, Hausinger RP. Привязанный клещевой комплекс, полученный из ниацина, с никель-углеродной связью в лактатрацемазе. Наука . 2015; 349: 66–69.
- 43He MM, Clugston SL, Honek JF, Matthews BW.Определение структуры глиоксалазы I Escherichia coli предполагает структурную основу для дифференциальной активации металлов. Биохимия . 2000; 39: 8719–8727.
- 44Suttisansanee U, Ran Y, Mullings KY, Sukdeo N, Honek JF. Регулирование селективности глиоксалазы i к металлу путем делеционного мутагенеза: основные структурные факторы, влияющие на профили активации никеля. Металломика .2015; 7: 605–612.
- 45Почапски Т.С., Покапски С.С., Джу Т., Хефлер С., Лян Дж. Уточненная модель структуры ациредуктон-диоксигеназы из Klebsiella ATCC 8724, включающая остаточные диполярные связи. Дж Биомол ЯМР . 2006; 34: 117–127.
- 46Nitschke W, McGlynn SE, Milner-White EJ, Russell MJ. О древности металлоферментов и их субстратов в биоэнергетике. Biochim Biophys Acta Bioenerg . 2013; 1827: 871–881.
- 47Pierik AJ, Roseboom W, Happe RP, Bagley KA, Albracht SPJ. Окись углерода и цианид как внутренние лиганды железа в активном центре [NiFe] -гидрогеназ. NiFe (CN) 2CO, биологический способ активации h3. Дж Биол Химия . 1999; 274: 3331–3337.
- 48Кришнан Р., Риордан К.Г.Трипептидные комплексы Cys-Gly-Cys никеля: биядерные аналоги каталитического сайта в ацетилкофермент синтазе. Дж. Ам Хем Соц . 2004; 126: 4484–4485.
- 49Golden ML, Reibenspies JH, Даренсбург, MY. Захват NiII, CuI и ZnII тиолатными сульфорами комплекса N2S2Ni: роль металлотиолатного лиганда в активном центре ацетил-кофермент-синтазы. Химическая связь . 2003; 3: 1824–1825.
- 50Huang HT, Dillon S, Ryan KC, et al. Роль смешанного амино-амидного лигирования в супероксиддисмутазе никеля. Неорг Химия . 2018; 57: 12521–12535.
- 51Матрубутэм В., Томас Дж., Стейплз Р., Маккракен Дж., Ширер Дж., Хегг Е.Л. Бисамидат и смешанные амино / амидатные комплексы NiN2S2 в качестве моделей никельсодержащего ацетилкофермент-синтазы и супероксиддисмутазы: экспериментальное и вычислительное исследование. Неорг Химия . 2010; 49: 5393– 5406.
- 52Титце Д., Сарториус Дж., Колей Сет Б. и др. Новое понимание механизма деградации супероксида никеля на основе исследований модельных пептидов. Научный сотрудник . 2017; 7: 17194.
- 53Mazzei L, Cianci M, Benini S, Ciurli S. Структура неуловимого комплекса уреаза-мочевина раскрывает механизм парадигматического никель-зависимого фермента. Angew Chem Int Ed . 2019; 58: 7415–7419.
- 54Лейпе Д.Д., Вольф Ю.И., Кунин Е.В., Аравинд Л. Классификация и эволюция ГТФаз P-петли и родственных АТФаз. Дж Мол Биол . 2002; 317: 41–72.
- 55Lacasse MJ, Zamble DB. Созревание [NiFe] -гидрогеназы. Биохимия . 2016; 55: 1689–1701.
- 56Böck A, King PW, Blokesch M, Posewitz MC. Созревание гидрогеназ. Adv Microb Physiol . 2006; 51: 1–71.
- 57Калуараччи Х., Сазерленд ДЭК, Янг А., Пикеринг И.Дж., Стиллман М.Дж., Замбл Д.Б. Ni (II) -связывающие свойства металлохаперона SlyD. Дж. Ам Хем Соц . 2009; 131: 18489–18500.
- 58Sydor AM, Lebrette H, Ariyakumaran R, Cavazza C, Zamble DB. Взаимосвязь между координацией Ni (II) и Zn (II) и связыванием нуклеотидов с помощью Helicobacter pylori [NiFe] -гидрогеназы и фактора созревания уреазы HypB. Дж Биол Химия . 2014; 289: 3828–3841.
- 59Spronk CAEM, erko S, Górka M, et al. Структура и динамика никель-шаперона hypa Helicobacter pylori: комплексный подход с использованием ЯМР-спектроскопии, функциональных анализов и вычислительных инструментов. Дж Биол Неорг Хим . 2018; 23: 1309–1330.
- 60Khorasani-Motlagh M, Noroozifar M, Kerman K, Zamble DB. Комплексообразование между факторами созревания никеля Escherichia coli [NiFe] -гидрогеназа. Биометаллы . 2019; 32: 521–532.
- 61Kaluarachchi H, Zhang JW, Zamble DB. Escherichia coli SlyD, больше, чем резервуар Ni (II). Биохимия . 2011; 50: 10761– 10763.
- 62Khorasani-Motlagh M, Lacasse MJ, Zamble DB. Связывание с высоким сродством металла дополнительным белком HypB Escherichia coli [NiFe] -гидрогеназы избирательно модулируется SlyD. Металломика . 2017; 9: 482–493.
- 63Lacasse MJ, Summers KL, Khorasani-Motlagh M, George GN, Zamble DB.Бимодальный никель-связывающий сайт на Escherichia coli [NiFe] -гидрогеназа металло-шаперон HypA. Неорг Химия . 2019; 58: 13604–13618.
- 64Квон С., Ватанабе С., Нишитани Ю. и др. Кристаллические структуры большой субъединицы [NiFe] гидрогеназы HyhL в незрелом состоянии в комплексе с Ni шапероном HypA. Proc Natl Acad Sci U S A . 2018; 115: 7045–7050.
- 65Albareda M, Pacios LF, Palacios JM.Вычислительный анализ, молекулярная динамика и исследования мутагенеза необработанной формы [NiFe] гидрогеназы показывают роль нарушения в эффективном созревании ферментов. Biochim Biophys Acta Bioenerg . 2019; 1860: 325–340.
- 66Jeoung JH, Dobbek H. Активация диоксида углерода в Ni, Fe-кластере анаэробной дегидрогеназы монооксида углерода. Наука . 2007; 318: 1461–1464.
- 67Керби Р.Л., Ладден П.В., Робертс Г.П.Включение никеля in vivo в дегидрогеназу монооксида углерода Rhodospirillum rubrum: молекулярная и физиологическая характеристика cooCTJ. Дж Бактериол . 1997; 179: 2259–2266.
- 68Alfano M, Cavazza C. Биологически опосредованная реакция сдвига водяного газа: структура, функция и биосинтез монофункциональных дегидрогеназ монооксида углерода [NiFe]. Экологически чистое топливо . 2018; 2: 1653–1670.
- 69 Тимм Дж., Брошье-Армане С., Перард Дж. И др. Дополнительный белок CO-дегидрогеназы CooT представляет собой новый никель-связывающий белок. Металломика . 2017; 9: 575–583.
- 70 Альфано М., Перард Дж., Карпентье П. и др. Дополнительный белок дегидрогеназы монооксида углерода CooJ представляет собой богатый гистидином многодоменный димер, содержащий неожиданный сайт связывания Ni (II). Дж Биол Химия . 2019; 294: 7601–7614.
- 71Jeoung JH, Giese T., Grünwald M, Dobbek H. CooC1 из Carboxydothermus Hydrogenoformans представляет собой никельсвязывающую АТФазу. Биохимия . 2009; 48: 11505–11513.
- 72Jeoung JH, Giese T, Grünwald M, Dobbek H. Кристаллическая структура АТФ-зависимого фактора созревания Ni, Fe-содержащих дегидрогеназ монооксида углерода. Дж Мол Биол . 2010; 396: 1165–1179.
- 73Алфано М., Перард Дж., Кавазза С. Индуцированная никелем олигомеризация богатого гистидином металло-шаперона CooJ из Rhodospirillum rubrum. Неорганические вещества . 2019; 7: 84.
- 74 Альфано М., Веронези Дж., Мусиани Ф. и др. Цистеин, подвергающийся воздействию растворителя, образует своеобразный сайт связывания NiII в металло-шапероне CooT из Rhodospirillum rubrum. Химия . 2019; 25: 15351–15360.
- 75Spangler NJ, Lindahl PA, Bandarian V, Ludden PW. Спектроэлектрохимическая характеристика металлических центров в дегидрогеназе монооксида углерода (CODH) и дефицитном никель CODH из Rhodospirillum rubrum. Дж Биол Химия . 1996; 271: 7973–7977.
- 76Spangler NJ, Meyers MR, Gierke KL, Kerby RL, Roberts GP, Ludden PW.Замена гистидина 265 на валин в дегидрогеназе монооксида углерода из Rhodospirillum rubrum влияет на активность и спектроскопические состояния. Дж Биол Химия . 1998; 273: 4059–4064.
- 77Wittenborn EC, Cohen SE, Merrouch M, et al. Структурное понимание созревания металлофактора в дегидрогеназе оксида углерода. Дж Биол Химия . 2019; 294: 13017–13026.
- 78Wittenborn EC, Merrouch M, Ueda C, et al.Редокс-зависимые перестройки кластера nifes монооксиддегидрогеназы. Элиф . 2018; 7: e39451.
- 79Gregg CM, Goetzl S, Jeoung JH, Dobbek H. AcsF катализирует АТФ-зависимую вставку никеля в кластер Ni, Ni- [4Fe4S] ацетил-CoA-синтазы. Дж Биол Химия . 2016; 291: 18129–18138.
- 80Zambelli B, Stola M, Musiani F и др.UreG, шаперон в процессе сборки уреазы, по своей сути является неструктурированной GTPase, которая специфически связывает Zn2 +. Дж Биол Химия . 2005; 280: 4684–4695.
- 81Мулруни С.Б., Уорд С.К., Хаузингер Р.П. Очистка и свойства металло-связывающего домена Klebsiella aerogenes UreE, функционального металло-шаперона уреазы. Дж Бактериол . 2005; 187: 3581–3585.
- 82Song HK, Mulrooney SB, Huber R, Hausinger RP.Кристаллическая структура Klebsiella aerogenes UreE, никель-связывающего металло-шаперона для активации уреазы. Дж Биол Химия . 2001; 276: 49359–49364.
- 83 Фонг Й.Х., Вонг Х.С., Юэнь М.Х., Лау PH, Чен Ю.В., Вонг КБ. Структура комплекса UreG / UreF / UreH показывает, как вспомогательные белки уреазы способствуют созреванию уреазы Helicobacter pylori. ПЛоС Биол . 2013; 11: e1001678.
- 84Farrugia MA, Wang B, Feig M, Hausinger RP.Мутационные и компьютерные доказательства того, что туннель для переноса никеля в UreD используется для активации уреазы Klebsiella aerogenes . Биохимия . 2015; 54: 6392–6401.
- 85Yuen MH, Fong YH, Nim YS, Lau PH, Wong KB, Fletterick RJ. Структурные сведения о том, как GTP-зависимые конформационные изменения в металло-шапероне UreG способствуют созреванию уреазы. Proc Natl Acad Sci U S A .2017; 114: E10890– E10898.
- 86Desguin B, Soumillion P, Hols P, Hausinger RP. Биосинтез никелевого кофактора с клещами включает в себя LarB-катализируемое карбоксилирование пиридиния и LarE-зависимое введение жертвенной серы. Proc Natl Acad Sci U S A . 2016; 113: 5598– 5603.
- 87Fellner M, Desguin B, Hausinger RP, Hu J.Структурные сведения о каталитическом механизме жертвенной серной инсертазы семейства АТФ-пирофосфатаз N-типа, LarE. Proc Natl Acad Sci U S A . 2017; 114: 9074– 9079.
- 88Fellner M, Rankin JA, Desguin B, Hu J, Hausinger RP. Анализ остатка цистеина в активном центре жертвенной серной инсертазы LarE из lactobacillus plantarum. Биохимия . 2018; 57: 5513–5523.
- 89Хаузингер РП. Новые металлические кофакторы и недавние открытия в области металлофакторов. Curr Opin Struct Biol . 2019; 59: 1–8.
- 90Desguin B, Fellner M, Riant O и др. Биосинтез никель-клещевого нуклеотидного кофактора лактатрацемазы требует CTP-зависимой циклометаллазы. Дж Биол Химия . 2018; 293: 12303–12317.
- 91Zheng K, Ngo PD, Owens VL, Yang XP, Mansoorabadi SO. Путь биосинтеза кофермента F430 у метаногенных и метанотрофных архей. Наука . 2016; 354: 339–342.
- 92Moore SJ, Sowa ST, Schuchardt C, et al. Выяснение биосинтеза метанового катализатора кофермента F 430. Nature .2017; 543: 78–82.
- 93Lyu Z, Chou CW, Shi H, et al. Сборка метилкофермент М-редуктазы в метаногенной археоне Methanococcus maripaludis. Дж Бактериол . 2018; 200: 00717 «- 00746.
страница с ошибкой 404 | PreventionWeb
Перейти к основному содержанию Выберите ваш языки
Перейти
МенюЗнание
- Отчет о глобальной оценке (GAR)
- ПрофилактикаВеб
Особые события
- Глобальная платформа
- Международный день уменьшения опасности бедствий
- Всемирный день осведомленности о цунами
Инструменты
- Монитор Сендайской платформы
- Добровольные обязательства
UNDRR
Меню
PW — Основная навигация
- Дом
- Понимание риска бедствий
- База знаний
- Сообщество
- Сендайский фреймворк
PW — Основная навигация
- Дом
- Понимание риска бедствий
- База знаний
- Сообщество
- Сендайский фреймворк
Закрыть меню
- Дом
- Страница ошибки 404
Страница ошибки 404
Оставайтесь на связи
Подпишитесь на обновления
Быстрые ссылки
- Последние дополнения
- Понимание рисков стихийных бедствий
- База знаний: опасности, темы и страны
- Объявления сообщества
- Сендайская рамочная программа
Поделитесь своим контентом
- Отправьте свой контент (статьи, публикации, события, вакансии и т. Д.)
- Презентации для блога
- Ознакомьтесь с политикой отправки
Свяжитесь с нами
© UNDRR 2020-2021
Нижний колонтитул
- Политика конфиденциальности
- Условия эксплуатации


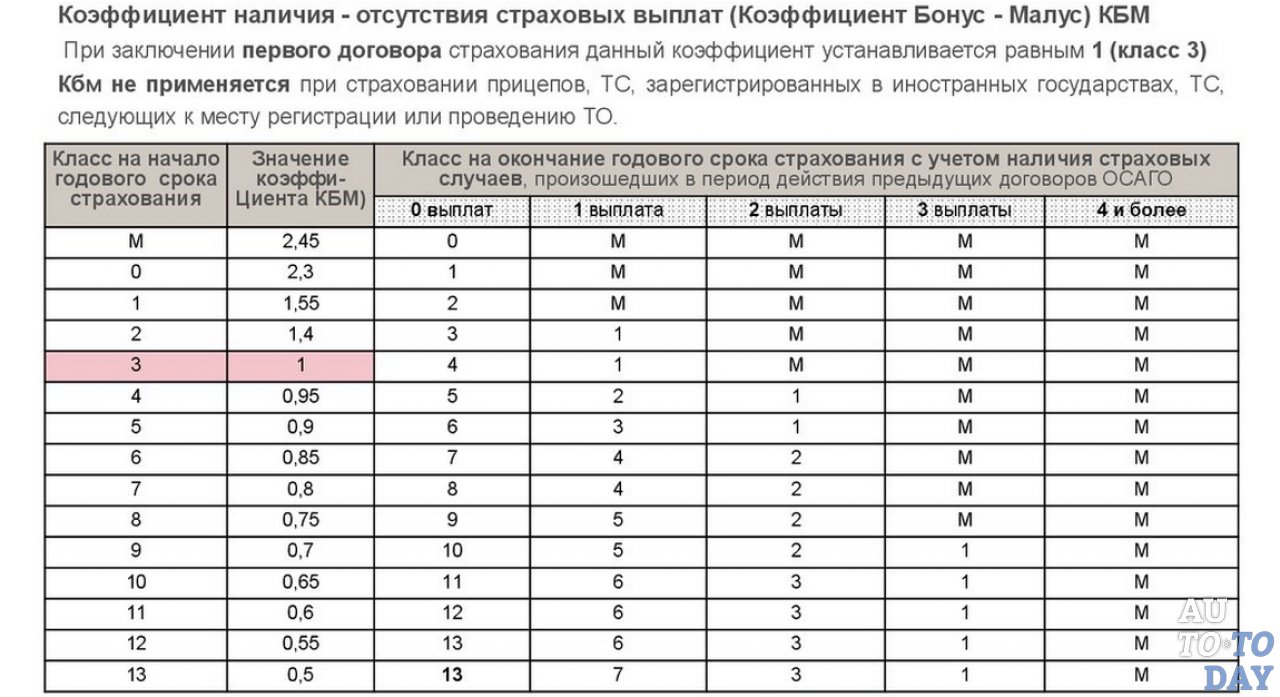
 Если у вас хорошая история, взвесьте, что выгодней: испортить ее, обратившись за компенсацией, или решить вопрос с пострадавшей стороной без привлечения СК.
Если у вас хорошая история, взвесьте, что выгодней: испортить ее, обратившись за компенсацией, или решить вопрос с пострадавшей стороной без привлечения СК. medexpress.ru в разделе «Контакты»
medexpress.ru в разделе «Контакты» Чем больше у человека опыта безаварийной эксплуатации транспортного средства, тем большую скидку предоставляет страховая компания;
Чем больше у человека опыта безаварийной эксплуатации транспортного средства, тем большую скидку предоставляет страховая компания;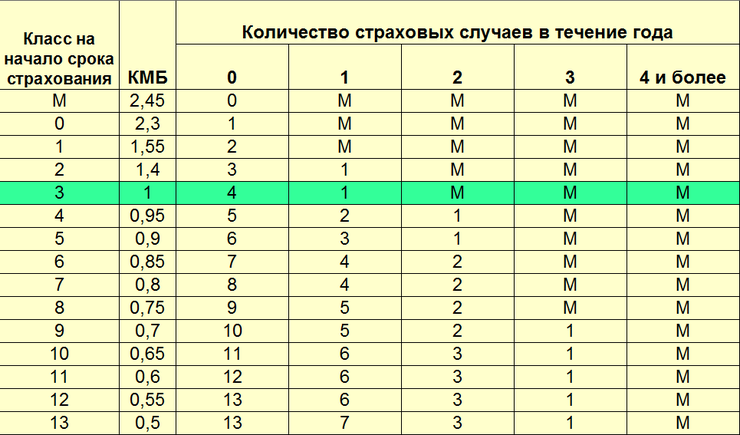 При эксплуатации автотранспорта на территории РФ оформляется временная регистрация и временный полис, но КМБ не влияет на стоимость страховки;
При эксплуатации автотранспорта на территории РФ оформляется временная регистрация и временный полис, но КМБ не влияет на стоимость страховки;
 12.2015, то есть в начале следующей политики;
12.2015, то есть в начале следующей политики; После проверки и исправления запрос может быть отправлен повторно;
После проверки и исправления запрос может быть отправлен повторно; Если есть письменный ответ от союза автостраховщиков и исправлена ошибка в базе данных, проблем с переоформлением автостраховки нет.
Если есть письменный ответ от союза автостраховщиков и исправлена ошибка в базе данных, проблем с переоформлением автостраховки нет.

 Есть два варианта оформления договора: с ограниченным количеством водителей или без ограничений.
Есть два варианта оформления договора: с ограниченным количеством водителей или без ограничений.