Стойкое к коррозии емкостное оборудование в Екатеринбурге, Тюмени, Челябинске
Виды коррозии, которым подвергаются металлические резервуары
Во время эксплуатации металлических резервуаров в них может происходить коррозия металла. Это вызывающие его разрушение процессы, которые протекают при химическом и физико-химическом взаимодействии с окружающей средой. По виду воздействующих факторов различают коррозию:
- химическую, связанную с химическим взаимодействием металла и других веществ;
- физико-химическую, когда разрушающие процессы усиливаются за счёт вибрации и т.п.;
- электрохимическую, протекающую в электропроводящей среде.
Коррозионные процессы могут происходить на внутренней и наружной поверхности металлической ёмкости. При этом разрушительные факторы действуют комплексно, и на разных участках их влияние отличается.
Влияние характера окружающей среды на коррозию металла
Коррозионные процессы в металле протекают по электрохимическому механизму. Их скорость увеличивается при контакте с водой и зависит от концентрации в ней химически активных катионов – от степени агрессивности окружающей среды.
Их скорость увеличивается при контакте с водой и зависит от концентрации в ней химически активных катионов – от степени агрессивности окружающей среды.
При этом внутренние поверхности могут быть постоянно покрыты водой или другой жидкостью, либо может происходить выпадение конденсата.
Если резервуары подземные, к их поверхности происходит доступ влаги из почвы, и степень агрессивности среды зависит от состава почвы.
При наружной установке влага попадает из осадков, а также происходит образование конденсата. Степень агрессивности зависит от концентрации в атмосфере пылевых загрязнений и газов, которые могут растворяться в воде, образуя химически активные катионы.
Влияние на скорость коррозии состава металла
Все происходящие коррозионные процессы в резервуарах протекают по гетерогенному механизму, так как атомы, находящиеся в кристаллической решётке в различных положениях (на поверхности, в середине) имеют разное число свободных связей. Неоднородность металла, наличие примесей, включений также нарушает структуру и влияет на скорость коррозии.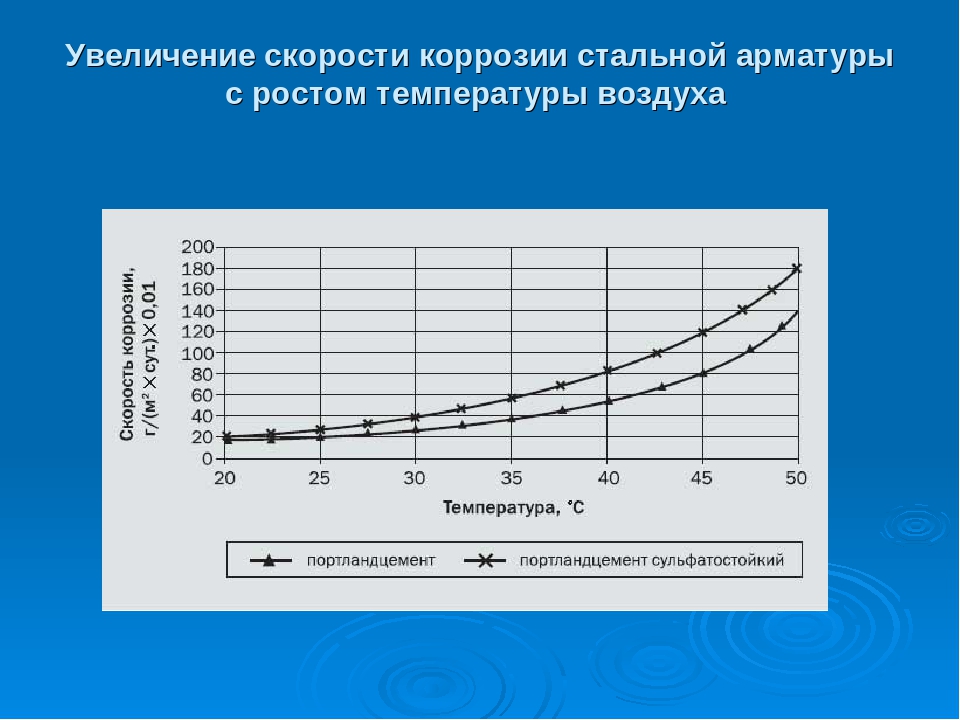
Твёрдые продукты реакции, образующиеся в результате коррозии, оседают на поверхности металла и перекрывают доступ к ней коррозионно опасных веществ. В результате растворения их в воде или при механических воздействиях может происходить их удаление, что также увеличивает скорость коррозии.
Скорость химических реакций может увеличиваться при повышении температуры, при воздействии ультрафиолетового излучения.
Коррозионная защита должна учитывать влияние всех факторов и проводиться комплексно.
Скорость коррозии — это… Что такое Скорость коррозии?
- Скорость коррозии
- Corrosion rate — Скорость коррозии.Результат воздействия коррозии на металл за единицу времени. Используемая характеристика скорости коррозии зависит от технической системы и вида коррозии. Скорость коррозии может быть выражена как увеличение глубины коррозии за единицу времени (скорость проникновения).
 Например, мм/год или масса металла превратившаяся в коррозионный продукт на единицу площади поверхности за единицу времени (потеря в весе, например, г/м2/год).
Например, мм/год или масса металла превратившаяся в коррозионный продукт на единицу площади поверхности за единицу времени (потеря в весе, например, г/м2/год).Коррозионный эффект может измениться со временем и может быть не одинаков во всех точках корродирующей поверхности. Следовательно, отчеты о скорости коррозии должны сопровождаться информацией о типе временной зависимости и локализации результата действия коррозии.
(Источник: «Металлы и сплавы. Справочник.» Под редакцией Ю.П. Солнцева; НПО «Профессионал», НПО «Мир и семья»; Санкт-Петербург, 2003 г.)
.
- Corrosion rate
- Corrosion resistance
Смотреть что такое «Скорость коррозии» в других словарях:
Скорость коррозии — коррозионные потери с единицы поверхности в единицу времени. Источник: snip id 5429: Руководство по проектированию и защите от коррозии подземных металлических сооружений связи 6.
 Скорость … Словарь-справочник терминов нормативно-технической документации
Скорость … Словарь-справочник терминов нормативно-технической документацииСкорость коррозии — – скорость изменения свойств строительного материала в изделии или в конструкции в единицу времени вследствие воздействия агрессивной среды. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А.… … Энциклопедия терминов, определений и пояснений строительных материалов
скорость коррозии — Коррозионные потери единицы поверхности металла в единицу времени. Применение Применим для терминов: коррозия металлов, сплошная коррозия, разномерная коррозия, неравномерная коррозия, местная коррозия и подповерхностная коррозия. [ГОСТ 5272 68]… … Справочник технического переводчика
Скорость коррозии строительного материала — – скорость изменения свойств строительного материала в изделии или конструкции в единицу времени, вследствие воздействия агрессивной среды. [СТ СЭВ 4419 83] Рубрика термина: Общие, коррозия Рубрики энциклопедии: Абразивное оборудование,… … Энциклопедия терминов, определений и пояснений строительных материалов
скорость коррозии строительного материала — Скорость изменения свойств строительного материала в изделии или конструкции в единицу времени, вследствие воздействия агрессивной среды.

Скорость коррозии арматуры — коррозионные потери единицы поверхности арматуры в единицу времени… Источник: Распоряжение Росавтодора от 30.11.2010 N 773 р Об издании и применении ОДМ 218.3.001 2010 Рекомендации по диагностике активной коррозии арматуры в железобетонных… … Официальная терминология
Скорость коррозии строительного материала — 8. Скорость коррозии строительного материала Скорость изменения свойств строительного материала в изделии или конструкции в единицу времени, вследствие воздействия агрессивной среды Источник: СТ СЭВ 4419 83: Защита от коррозии в строительстве.… … Словарь-справочник терминов нормативно-технической документации
скорость коррозии арматуры — 3.3 скорость коррозии арматуры: Коррозионные потери единицы поверхности арматуры в единицу времени. Источник … Словарь-справочник терминов нормативно-технической документации
скорость коррозии строительного материала — скорость изменения свойств строительного материала в изделии или конструкции в единицу времени вследствие воздействия агрессивной среды.
 (Смотри: СТ СЭВ 4419 83. Защита от коррозии в строительстве. Конструкции строительные. Термины и… … Строительный словарь
(Смотри: СТ СЭВ 4419 83. Защита от коррозии в строительстве. Конструкции строительные. Термины и… … Строительный словарьСкорость коррозии рутения в растворах HCl различной концентрации (продолжительность опыта 15 ч.) — Концентрация HCl, н Анодный потенциал, мВ Плотность тока, А/м2 Выход по току на растворение Ru, % общая на растворение Ru … Химический справочник
|
Эксперт Центра химико-экологических экспертиз «ЭХО», к.х.н. Михаил Рейнов
Во всем мире для борьбы со снегом и льдом используют разные виды солей и их комбинации: хлориды, ацетаты, нитраты, карбамиды и формиаты. В качестве фрикционных материалов могут выступать мраморный или гранитный щебень, песок, различные отсевы дробления горных пород.
Широкое применение противогололедных реагентов (сокращенно ПГР) стало любимым предметом критики среди некоторых экспертов и общественности. Химию большинство людей не любит с 7-го класса, и многие граждане любую идею запретить непонятные для них «реагенты» всегда готовы поддержать, при этом, как правило, не затрудняя себя изучением сути проблемы.
Коррозия металла
Одним из преувеличений стала уверенность в особо губительном коррозионном воздействии ПГР на металлические части автомобилей. Скорость и интенсивность ржавления кузова главным образом зависят от качества металла и целостности лакокрасочного покрытия.
Причиной коррозии является не реагенты, а кислород. При контакте железной поверхности с содержащей кислород водой неизбежно начинается реакция окисления железа с образованием ржавчины – гидрата окиси трехвалентного железа. Механизм коррозии электрохимический, это означает образование на поверхности металла пары катод – анод. Катод – это зона поверхности, заряженная отрицательно, с нее растворенный в воде кислород забирает электроны и переходит в восстановленную форму – воду или гидроксид-ионы. Анод – это зона, заряженная положительно, с нее катионы железа переходят в раствор, далее взаимодействуют с гидроксид-ионами, получается гидроокись двухвалентного железа, которая окисляется и образуется ржавчина. Поэтому ржавление происходит везде, где есть кислород и вода, – в водоемах, лужах, на дорогах, на влажном воздухе, даже в пустыне.
Существует понятие атмосферной коррозии – эта коррозия, которая происходит на воздухе. Механизм этого вида коррозии и величина зависят от уровня влажности воздуха, причем для каждого сплава свои критические значения. Обычно при влажности более 60–70% атмосферная коррозия протекает по вышеупомянутому электрохимическому механизму, по которому происходит ржавление железных конструкций в воде. В этом случае на металлической поверхности образуется тонкая пленка воды, концентрация растворенного атмосферного кислорода в ней постоянно велика, и поэтому скорость коррозии значительна и возрастает с повышением влажности. При достаточной влажности скорость атмосферной коррозии оказывается намного выше, чем при полном погружении металлической поверхности в раствор электролита. Иначе говоря, при большой влажности, в пасмурную погоду, при тумане, ржавление происходит интенсивнее, чем если бы металлические конструкции были полностью погружены в лужи, реки и водоемы.
Факторы влияния
Ржавление может идти быстрее или медленнее. Одни факторы замедляют коррозию. В их числе добавление в железные сплавы специальных добавок, например хрома. У железа при электрохимической коррозии образуется рыхлая ржавчина, которая слабо экранирует металлическую поверхность от раствора. Хром, так же как и железо, окисляется растворенным в воде кислородом, но образующийся оксид хрома, в отличие от ржавчины, покрывает поверхность плотной защитной пленкой, через которую взаимодействие с раствором затруднено, и поэтому коррозия замедляется. Если в сплаве хрома более 10%, то мы имеем нержавеющую сталь. Добротные кузова автомобилей делают из устойчивых к коррозии сплавов. Другой способ защитить железо – оцинковка. Изделие покрывают тонким слоем цинка, который хоть и активно окисляется растворенным в воде кислородом, но при этом образуется прочная защитная пленка оксида цинка, останавливающая дальнейшее окисление.
Наличие некоторых солей в воде действительно может ускорять коррозию. Некоторые анионы, особенно хлора, брома и йода, которые называют ионами-активаторами, взаимодействуют с металлической поверхностью, разрушают естественную защитную оксидную пленку и образуют растворимые в воде галогениды железа, которые отводятся от металлической поверхности, в результате чего контактирует с раствором оголенная металлическая поверхность, что увеличивает скорость коррозии.
Однако есть соли, воздействие на металл которых сопоставимо с водопроводной водой и снегом.
Показатели коррозионной активности на сталь 3 для различных сред, измеренных в стандартных условиях
Как видно из таблицы, использование чистых хлоридов действительно может увеличить скорость ржавления металла. Данные соли – формиаты и ацетаты – обладают в том числе хорошей плавящей способностью и низкой «рабочей» температурой. Так, например, формиат калия плавит лед до –50 °С. Из-за низкого воздействия на металл такие реагенты широко используют в аэропортах.
При этом, обладая коррозионным воздействием в разы ниже, чем у хлоридов, формиаты и ацетаты могут значительно снижать активность всей противогололедной смеси к металлу.
В последние годы производители реагентов делают ставку именно на многокомпонентные составы, представляющие собой смесь различных солей с ингибирующими добавками, в том числе с использованием низкокоррозионных веществ, таких как формиат натрия. В комбинированных реагентах недостатки компонентов минимизируются, а достоинства (плавящая способность, температура действия и пр.
|
|
|
«Газпромнефть-Оренбург» онлайн мониторит скорость коррозии трубопроводов
Для этого на низконапорном водоводе установлен датчик с GSM-модулем.
В «Газпромнефть-Оренбурге» на Восточном участке Оренбургского нефтегазоконденсатного месторождения проводятся испытания новой марки стали 05ХГБ. Для оценки ее коррозионной стойкости была установлена современная система онлайн-мониторинга скорости коррозии трубопроводов «Web-Monicor». Для этого на низконапорном водоводе был установлен датчик с GSM-модулем, позволяющий измерять скорость коррозии и передавать полученные данные на web-сервер в режиме реального времени. Благодаря датчику контроля производственных процессов специалисты «Газпромнефть-Оренбурга» могут анализировать информацию о скорости коррозии трубопроводов, находясь на рабочем месте, и оперативно принимать решения по методам и технологиям снижения агрессивности транспортируемого агента или защиты внутренней стенки трубы. Внедрение нового оборудования для улучшения надежности трубопроводного парка предприятия – важная часть экологической программы «Газпромнефть-Оренбурга», сообщили Информ-Девону в компании. Онлайн-мониторинг позволяет оперативно выявлять изменение коррозионной агрессивности транспортируемой продукции и предпринимать меры по снижению скорости коррозии на промысловых трубопроводах. В дальнейшем новая техника, подтвердившая свою эффективность, будет использоваться и на других месторождениях предприятия.
В дальнейшем новая техника, подтвердившая свою эффективность, будет использоваться и на других месторождениях предприятия.
«Газпромнефть-Оренбург» последовательно реализует мероприятия по внедрению новых технологий, обеспечению целостности и надежности трубопроводов. На данный момент на Капитоновском, Царичанском месторождениях и Восточном участке оренбургского нефтегазоконденсатного месторождения установлено 28 узлов контроля коррозии, продолжаются испытания эффективных ингибиторов и альтернативной коррозионной марки стали», – отметил главный инженер-первый заместитель генерального директора «Газпромнефть-Оренбурга» Сергей Трубавин.
Metal Corrosion and the Efficiency of Corrosion Inhibitors in Less Conductive Media
Вышеуказанные методы были использованы для оценки коррозии данных22 мягкая сталь (состоящие из 0,16% веса C, 0,032% массы P, 0,028% веса S и баланс F) в среде смесей этанола бензин (EGBs), содержащий vol. 10 и 85% этанола (E10 и E85), соответственно. Для подготовки этих EGBs, бензин в соответствии с требованиями EN 228 содержащий 57.4 vol. % насыщенных углеводородов, 13,9% vol. олефинов, 28,7% vol. ароматических углеводородов и 1 mgkg1–серы был использован. Агрессивность этих видов топлива была увеличена путем добавления воды и отслеживать количество хлоридов (3 mgkg–1), сульфаты (3 mgkg–1) и уксусной кислоты (50 mgkg–1). E10 топлива содержит 0,5% vol. воды так, чтобы произошло без разделения этапов водный этанол и углеводородов. 6% vol. воды загрязненных Топливо Е85. 22 протестированных коррозии содержится octadecylamin и концентрации ингибитора в топлива 200 mgL–1. Полученные данные представлены в таблице 1.
10 и 85% этанола (E10 и E85), соответственно. Для подготовки этих EGBs, бензин в соответствии с требованиями EN 228 содержащий 57.4 vol. % насыщенных углеводородов, 13,9% vol. олефинов, 28,7% vol. ароматических углеводородов и 1 mgkg1–серы был использован. Агрессивность этих видов топлива была увеличена путем добавления воды и отслеживать количество хлоридов (3 mgkg–1), сульфаты (3 mgkg–1) и уксусной кислоты (50 mgkg–1). E10 топлива содержит 0,5% vol. воды так, чтобы произошло без разделения этапов водный этанол и углеводородов. 6% vol. воды загрязненных Топливо Е85. 22 протестированных коррозии содержится octadecylamin и концентрации ингибитора в топлива 200 mgL–1. Полученные данные представлены в таблице 1.
Время курса статических и динамических испытаний представлены в 7 Рисунок и Рисунок 8. Зависимостей вес теряет представлена в эти цифры относятся к площади поверхности испытуемого образца металлик. Эти потери веса могут быть пересчитаны в курс скорость коррозии в порядке представлены на шаг 4. Это показано на загрязненных E85 топливо в 7 Рисунок и Рисунок 8. Обе цифры очевидно, что периоды времени 1200 h и 340 h были достаточны для достижения стабилизации мягкая сталь E10 (E85) топливных систем для статических и динамических испытаний, соответственно. Кроме того эффективность ингибитора коррозии проявляется в обоих видов топлива, как значительно ниже материал, что потери были замечены при применении ингибиторов. Эффективность ингибитора, см. таблицу 1, были рассчитаны после эксперимента и после травления поверхности образца в решении chelaton III, см. шаг 5.1. Удаление продуктов коррозии поверхности путем травления позволяет нам получить реальные материальные потери, которые имеют важное значение для расчета эффективности ингибиторов коррозии.
Зависимостей вес теряет представлена в эти цифры относятся к площади поверхности испытуемого образца металлик. Эти потери веса могут быть пересчитаны в курс скорость коррозии в порядке представлены на шаг 4. Это показано на загрязненных E85 топливо в 7 Рисунок и Рисунок 8. Обе цифры очевидно, что периоды времени 1200 h и 340 h были достаточны для достижения стабилизации мягкая сталь E10 (E85) топливных систем для статических и динамических испытаний, соответственно. Кроме того эффективность ингибитора коррозии проявляется в обоих видов топлива, как значительно ниже материал, что потери были замечены при применении ингибиторов. Эффективность ингибитора, см. таблицу 1, были рассчитаны после эксперимента и после травления поверхности образца в решении chelaton III, см. шаг 5.1. Удаление продуктов коррозии поверхности путем травления позволяет нам получить реальные материальные потери, которые имеют важное значение для расчета эффективности ингибиторов коррозии. Травления причины увеличения реальных корродирования как документально подтверждается результатами представлена в таблице 1. Это можно наблюдать специально для динамического испытания с циркуляцией агрессивной среды, где металл-окружающей среды системы гораздо более подчеркнул и стойкость материала значительно сократилось. Согласно условиям теста и коррозионной среды металл равномерно покрытые толстым слоем продуктов коррозии, смотри Рисунок 9.
Травления причины увеличения реальных корродирования как документально подтверждается результатами представлена в таблице 1. Это можно наблюдать специально для динамического испытания с циркуляцией агрессивной среды, где металл-окружающей среды системы гораздо более подчеркнул и стойкость материала значительно сократилось. Согласно условиям теста и коррозионной среды металл равномерно покрытые толстым слоем продуктов коррозии, смотри Рисунок 9.
Некоторые образцы коррозионной среды не может быть проверен динамического испытания из-за их высокой вязкости. Такие пробы (например, моторного масла, загрязненные несгоревшего топлива E100) может быть проверена статическое испытание под рефлюкс кулер при повышенных температурах, см. шаг 3. Таблица 2 представлены полученные результаты коррозии из мягкой стали и двух образцов латуни, которые были протестированы в окисленном моторного масла (искусственно возрасте нефти в атмосфере кислорода на 650 кПа и 160 ° C) с общее кислотное число (TAN) 3,5 мг KOHg–1 , содержащий 15% vol.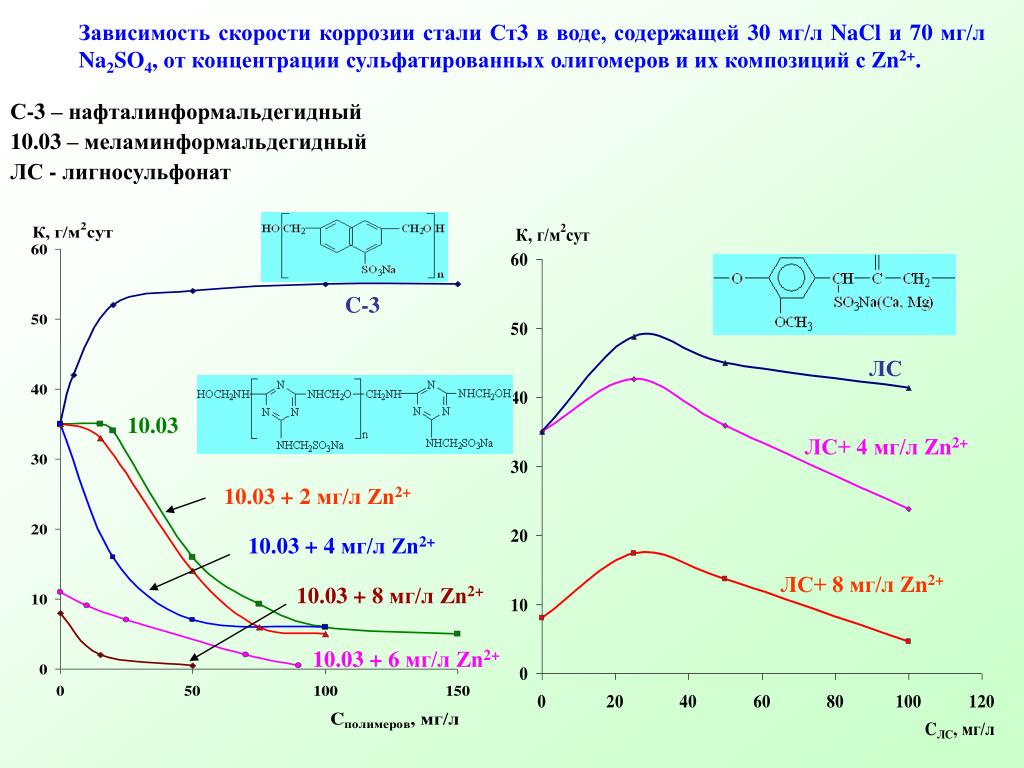 азеотропная, агрессивный E100 топлива (содержит 6% vol. воды и отслеживать количество загрязняющих веществ, смотрите агрессивность топлива выше).
азеотропная, агрессивный E100 топлива (содержит 6% vol. воды и отслеживать количество загрязняющих веществ, смотрите агрессивность топлива выше).
В настоящее время имеют большой потенциал и может сообщить не только о свойствах сред (диэлектрическая проницаемость, электрохимические методы как электрохимических импеданс, измерения поляризационных характеристик, потенциал коррозии, и т.п. Удельное сопротивление), но также о электродные свойства как поляризационного сопротивления и способность двойного слоя. Кроме того электрохимические методы имеют большое значение для измерения в неводных средах. Из-за низкой теплопроводности неводных сред проводимость соли могут применяться к уменьшить сопротивление и повышения теплопроводности окружающей среды, так что электродные свойства (коррозии данных) может быть измерена также. Однако проводимость соли не часто только изменить свойства коррозии сред, но они также могут иметь негативное воздействие на данных полученных коррозии, например, они могут иметь коррозионных или тормозящее свойств. Эти эффекты можно избежать путем выполнения измерений без этих солей в специальных клетках с изменение геометрии, см. шаги 6 и 7, чтобы как можно меньше расстояния между электродами.
Эти эффекты можно избежать путем выполнения измерений без этих солей в специальных клетках с изменение геометрии, см. шаги 6 и 7, чтобы как можно меньше расстояния между электродами.
Рисунок 10 и рис 11 Показать спектров импеданса, измеряется в механизме два электрода. Форма спектров импеданса зависит от проводимости используемых среды (топливо). Когда теплопроводности окружающей среды является низким (бензин, EGBs, содержащих до 10 об. % этанола) спектра состоит из только один полукруг (ВЧ-часть). Это полукруг позволяет оценить свойства, которые характеризуют подержанные окружающей среды только (удельное сопротивление, ВЧ-емкость для расчета диэлектрическая проницаемость). Полностью отсутствует часть низкой частоты, характеризующие свойства электродов. При достаточно высокой теплопроводности окружающей среды, спектры состоят из обеих частей высокой и низкой частоты, которые образуют два относительно хорошо разделенных полукруги, см. Рисунок 11. Опять же, высокочастотной части сообщает о свойствах окружающей среды, тогда как низкочастотные емкостным цикла связанные с ответом электрические двойного слоя на этапе интерфейс и параллельно поляризационного сопротивления, который является количество основных коррозии и характеризует уровень мгновенной коррозии. Спектра может быть оценена в соответствии эквивалентная схема, которая представлена на рисунке 11. Измеренные и оценить результаты для мягкой стали в механизме плоский электрод представлены в таблице 1.
Рисунок 11. Опять же, высокочастотной части сообщает о свойствах окружающей среды, тогда как низкочастотные емкостным цикла связанные с ответом электрические двойного слоя на этапе интерфейс и параллельно поляризационного сопротивления, который является количество основных коррозии и характеризует уровень мгновенной коррозии. Спектра может быть оценена в соответствии эквивалентная схема, которая представлена на рисунке 11. Измеренные и оценить результаты для мягкой стали в механизме плоский электрод представлены в таблице 1.
Механизм 3 электрод позволяет нам оценить характеристики поляризации представлена в таблице 1 (то есть, поляризационного сопротивления, коррозии потенциал, плотность тока коррозии и тафелевских константы катодной и Анодные части кривой поляризации тафелевских). Эти характеристики может использоваться для расчета мгновенной корродирования от Stern-Гири уравнение, шаг 7,5см. Измерения поляризационных характеристик трудно, особенно в средах с низкой проводимости, как по потенциальной потери (iR падение), которая сильно зависит от сопротивление существенно загружается измеренных данных окружающей среды и расстояние между рабочим и справочным электродов. Это потенциальные потери могут быть сведены к минимуму, оценкам и вычитается из поляризации данные, основанные на импедансной спектроскопии, перед измерения поляризации кривой или импедансной спектроскопии после измерения поляризации кривая. Оцененные поляризационного сопротивления от предыдущих спектра импеданс имеет важное значение для расчета скорости коррозии и сопротивление для расчета падения ИК . Рисунок 12 представляет тафелевских кривой мягкой стали в среде агрессивных E85 топлива без добавления ингибитора до и после компенсации падения iR (синий и красный, соответственно). Кроме того эта цифра показывает линейной области катода и анода частей, которые используются для получения тафелевских коэффициенты.
Измерения поляризационных характеристик трудно, особенно в средах с низкой проводимости, как по потенциальной потери (iR падение), которая сильно зависит от сопротивление существенно загружается измеренных данных окружающей среды и расстояние между рабочим и справочным электродов. Это потенциальные потери могут быть сведены к минимуму, оценкам и вычитается из поляризации данные, основанные на импедансной спектроскопии, перед измерения поляризации кривой или импедансной спектроскопии после измерения поляризации кривая. Оцененные поляризационного сопротивления от предыдущих спектра импеданс имеет важное значение для расчета скорости коррозии и сопротивление для расчета падения ИК . Рисунок 12 представляет тафелевских кривой мягкой стали в среде агрессивных E85 топлива без добавления ингибитора до и после компенсации падения iR (синий и красный, соответственно). Кроме того эта цифра показывает линейной области катода и анода частей, которые используются для получения тафелевских коэффициенты. Рисунок 11 также сравнивает тафелевских кривой из мягкой стали, измеряется в среде агрессивных топлива E85, содержащий ингибитор Амин основе, где вся кривая смещается более к катоду потенциалов (для отрицательных значений) и Нижняя плотностях тока, которые ведут к более низкий уровень мгновенной коррозии мягкой стали.
Рисунок 11 также сравнивает тафелевских кривой из мягкой стали, измеряется в среде агрессивных топлива E85, содержащий ингибитор Амин основе, где вся кривая смещается более к катоду потенциалов (для отрицательных значений) и Нижняя плотностях тока, которые ведут к более низкий уровень мгновенной коррозии мягкой стали.
Рисунок 1: воздействия мягкой стали в агрессивной E85 топлива во время статической test. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 2: Схема аппарата лаборатории потока для динамических испытаний: (1) закалки кремния Ванна, фритты для подачи воздуха, (3) предварительный нагрев спирали, Воздухозаборное отверстие (4), (5) образец вешалка, (6) переполнения в колбу хранения, (7) хранения колбу, кулер (8), (9) криостат, (10) Перистальтический насос, термометр (11). Адаптированный с разрешения ссылка14. Авторское право 2013. Факультет экологической технологии, Университет химии и технологии Прага. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Авторское право 2013. Факультет экологической технологии, Университет химии и технологии Прага. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3: Схема аппарата для тестирования коррозионного воздействия масел на строительные материалы в присутствии кислорода при постоянной температуре. (1, 2) охлаждение, (3) рефлюкс, винтовой охладитель с матового стекла совместных и крючок для подвешивания образца (4) термометра, (5) флакон с совместной содержащий образец матового стекла, (6) термостат, (7) фритта с трубки для поставок газа (воздуха), кислорода (8), (9) образца с вешалка. 15 пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 4: Геометрия плоская двухэлектродное механизма с расстоянием электродов около 1 мм и константа ячейки около 0.810-3 см-1. Адаптированный с разрешения ссылка10.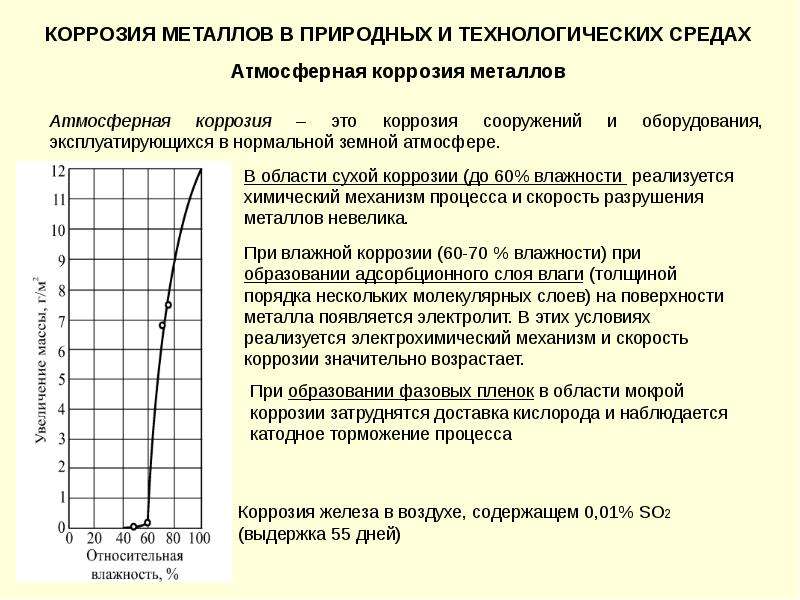 Авторское право 2009. Факультет экологической технологии, Университет химии и технологии Прага. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Авторское право 2009. Факультет экологической технологии, Университет химии и технологии Прага. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 5: геометрическое расположение электродов в измерительной ячейке: () подключение измерительной ячейки потенцио, (b) рабочих электродом (мы), электрод сравнения (RE), счетчик (вспомогательные) электродом (CE). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 6: строительство рабочих электродом: часть (1) Рабочая (измерения), (2) тефлоновые уплотнения с тефлоновой ленты, (3) расширение для подключения электрода с резьбой, изолированные на обоих концах, на стеклянной трубки, (4) гайка для вытягивать электрода и нажав трубка для рабочих электродом через печать. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 7: время эволюции скорости коррозии мягкой стали в загрязненных потерь топлива и коррозии E85 мягкой стали в загрязненных E10 и E85 топлива перед добавлением ингибитора коррозии во время статической test.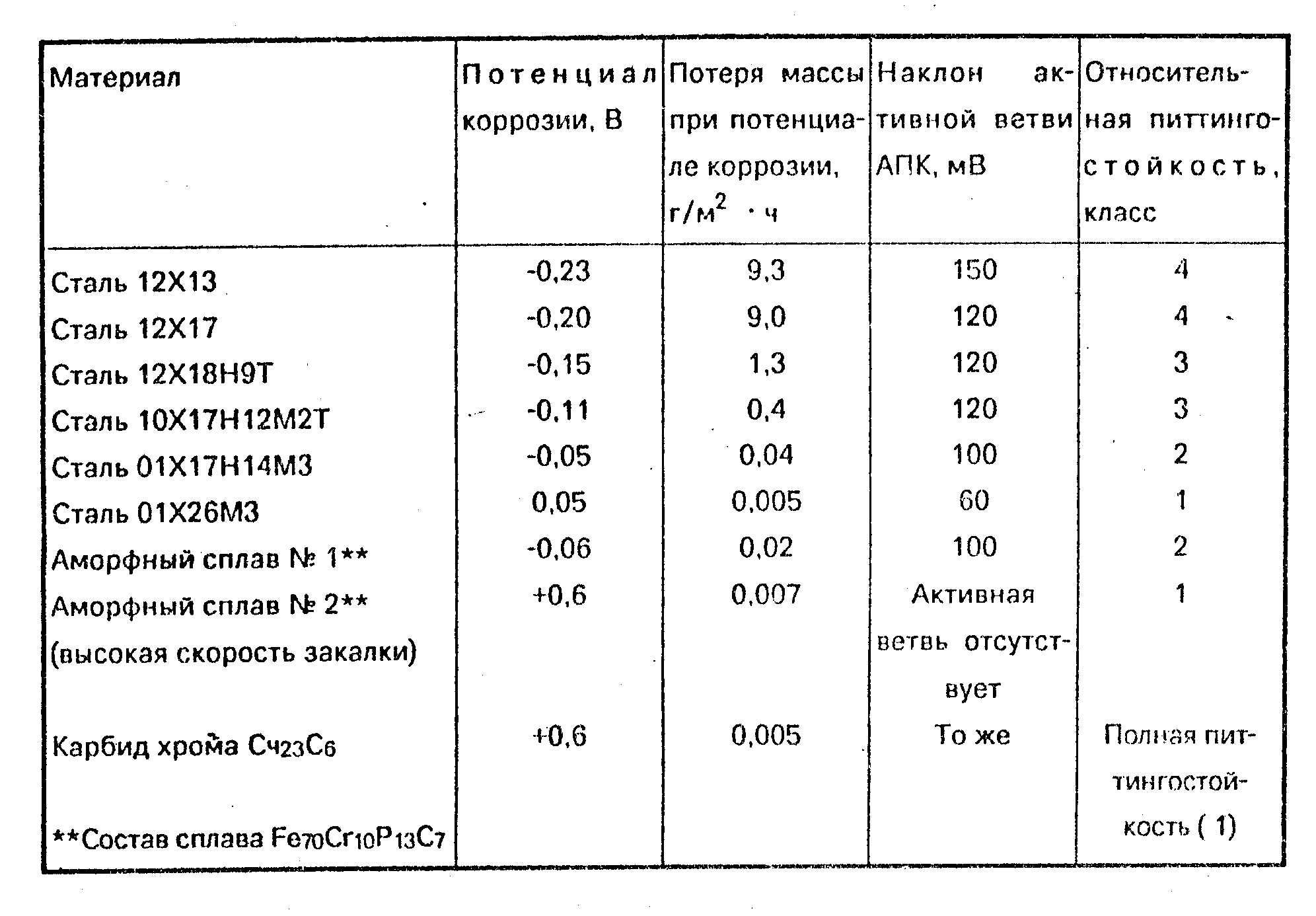 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 8: время эволюции скорости коррозии мягкой стали в загрязненных потерь топлива и коррозии E85 мягкой стали в загрязненных E10 и E85 топлива перед добавлением ингибитора коррозии во время динамического test. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 9: поверхности мягкой стали испытания в условиях агрессивной E85 топлива без коррозии (A, C) и ингибитор (B, D) статические (A, B) и динамического испытания (C, D). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 10: сопротивление спектра измеряется в загрязненных E10 топливо для мягкой стали в механизме Вселенский, двухэлектродное после 30 мин экспозиции и эквивалентной схемы, используемые для оценки (в правом верхнем углу). Rтоплива является устойчивость окружающей среды и CPEтоплива является пространственной емкость среды. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Rтоплива является устойчивость окружающей среды и CPEтоплива является пространственной емкость среды. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 11: сопротивление спектра измеряется в загрязненных Топливо Е85 для мягкой стали в механизме Вселенский, двухэлектродное после 30 мин экспозиции и эквивалентной схемы, используемые для оценки (в правом верхнем углу). Rтоплива является сопротивление среды, CPEтоплива является пространственной емкость среды, Rp поляризационного сопротивления и CPEdl является потеря емкости двойной слой. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 12: поляризации кривые мягкой стали в среде загрязненного топлива Е85 измеряется в механизме тремя электродами.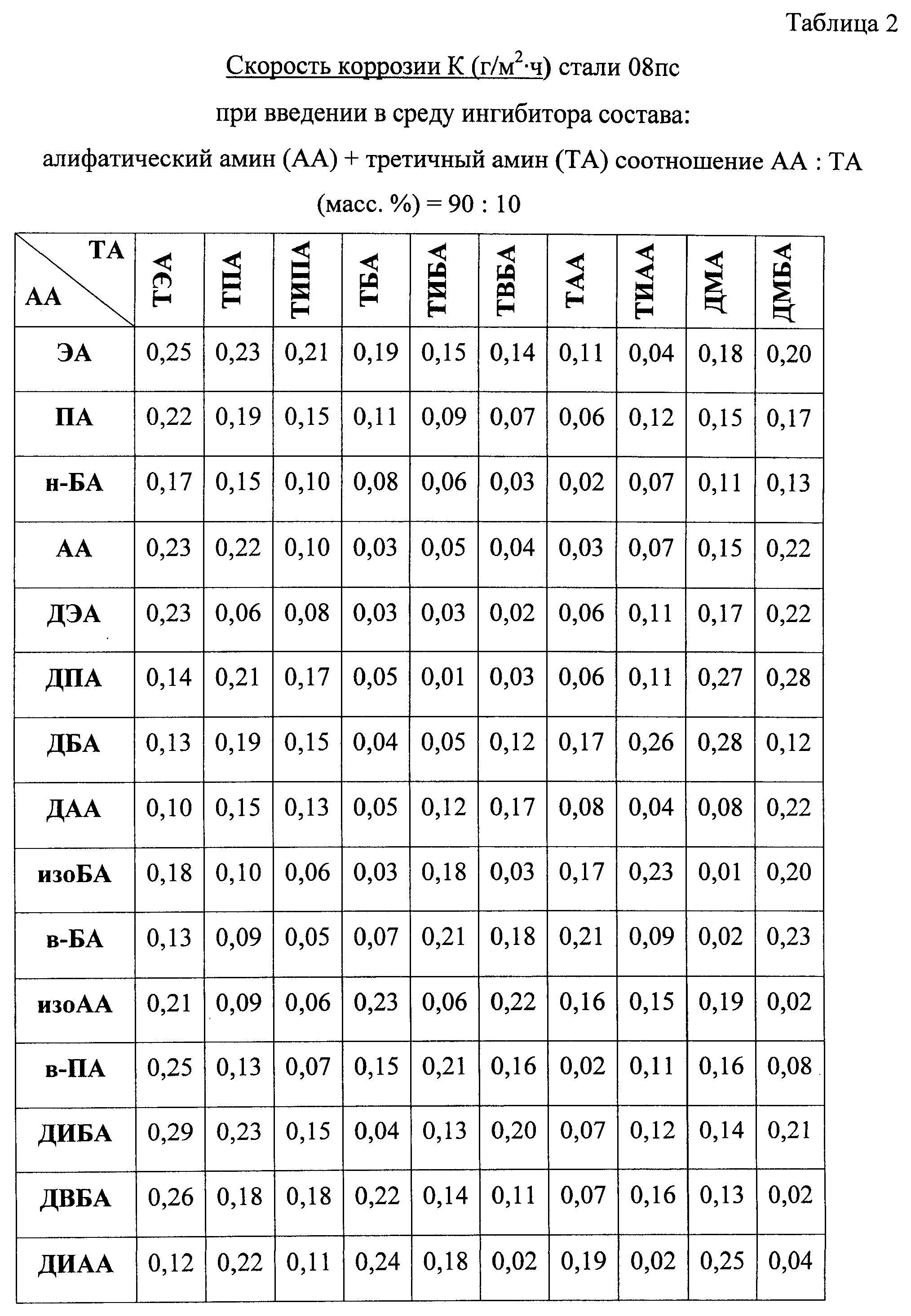 Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Метод | Параметр | E10 + 0.5% H2O | E10 + 0,5% H2O + ингибитор | E85 + 6% H2O | E85 + 6% H2O + ингибитор |
| Статическое испытание | Скорость коррозии перед травления (мм × год-1) | 0.1 | 0,03 | 9.5 | 1.2 |
| Скорость коррозии после травления (мм × год-1) | 5.5 | 1,3 | 17.9 | 3.4 | |
| Эффективность ингибитора (%) | 76,3 | 80,7 | |||
| Динамическое испытание | Скорость коррозии перед травления (мм × год-1) | 1 | 0,6 | 24. 3 3 | 0.1 |
| Скорость коррозии после травления (мм × год-1) | 13.5 | 4,9 | 56,5 | 17.9 | |
| Эффективность ингибитора (%) | 63.4 | 68,4 | |||
| Электрохимии в механизме Вселенский, два электрода | Удельное сопротивление (кВт × m) | 6440 | 6180 | 2,83 | 2,79 |
| Диэлектрическая проницаемость | 2.9 | 3,0 | 21,8 | 21.5 | |
| Поляризационного сопротивления | — | — | 287,5 | 851.3 | |
| (кВт × см2) | |||||
| Мощность электрических двухслойные (mF × см-2) | — | — | 20.4 | 8.1 | |
| Эффективность ингибитора (%) | — | 66.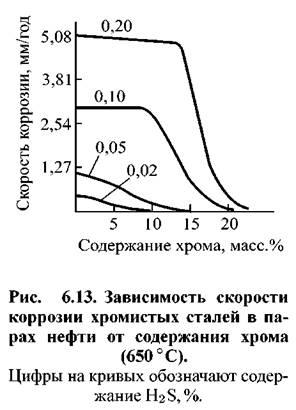 3 3 | |||
| Электрохимии в механизме тремя электродами | Поляризационного сопротивления (кВт × см2) | — | — | 20.4 | 49,6 |
| Тафелевских bk (mV) | — | — | 132,5 | 105 | |
| Тафелевских b (mV) | — | — | 325,1 | 213.6 | |
| Коррозия потенциальных (mV) | — | — | -109.5 | -165.1 | |
| Плотность тока (мА × см-2) | — | — | 2 | 0.6 | |
| Мгновенная скорость (мм × год-1) | — | — | 15.5 | 4.8 | |
| Эффективность ингибитора (%) | — | 69,2 | |||
Таблица 1 : Коррозии данных мягкой стали и эффективности определяется пять различных методов ингибитора.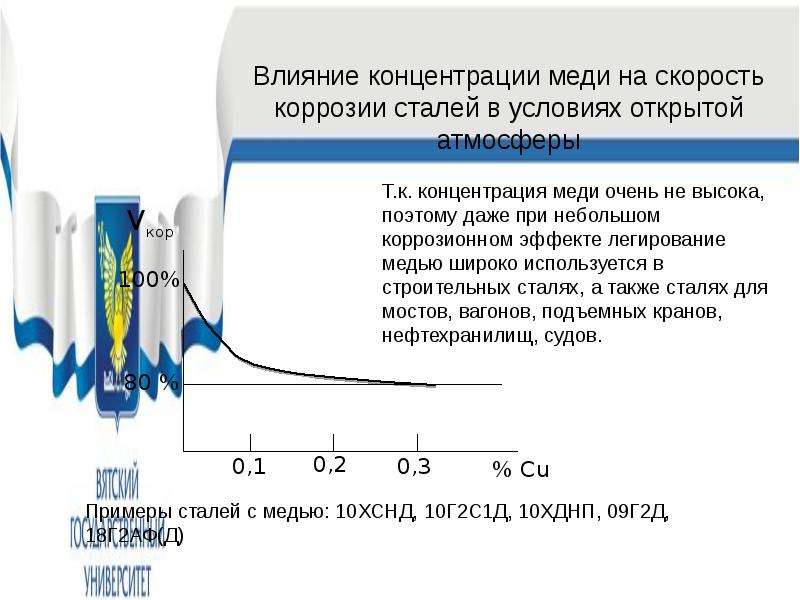
| Материал | Начальный вес (г) | Вес после травления (g) | Область образца (2m) | Скорость коррозии (мкм × год-1) |
| Сталь | 7.8025 | 7.8012 | 0.001 | 2.5 |
| Латунный 1 | 11.8687 | 11.8619 | 0.0012 | 9,9 |
| Латунь 2 | 10.5686 | 10.5645 | 0,002 | 3.6 |
Таблица 2 : Скорость коррозии (после засолки) латуни и стальные образцы подвергаются в среде масла в двигателе, загрязненных с агрессивным E 100 топливо (15 vol.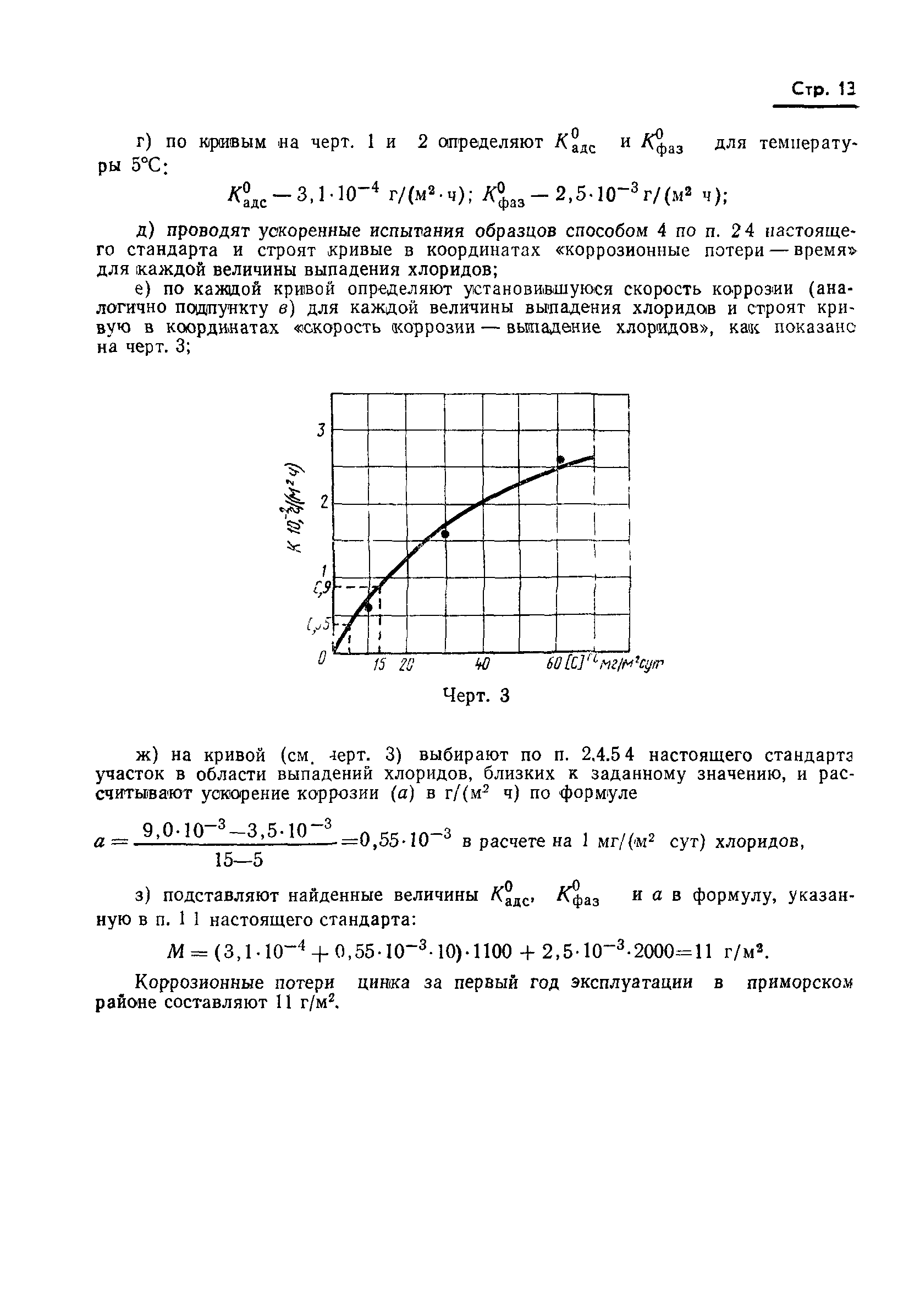 %) в рамках 14 дней после статического испытания под рефлюкс кулер.
%) в рамках 14 дней после статического испытания под рефлюкс кулер.
Subscription Required. Please recommend JoVE to your librarian.
3.3.1. Скорость процесса коррозии. Показатели химической коррозии
Скорость химической коррозии определяют количественно по наблюдениям во времени за изменением какой-либо подходящей для этих целей величины, изменяющейся в процессе коррозии.
Тогда истинная скорость коррозии металлического материала определяется из выражения: , (3.12)
где y − изменяющаяся в процессе коррозии характеристика свойства материала; ф − время коррозии.
Для количественного выражения скорости коррозионных разрушений на практике пользуются показателями коррозии, являющимися, по сути, отражением средней скорости коррозионного разрушения материала:
. (3.13)
Используется ряд показателей коррозии.
Глубинный показатель коррозии:
, (3.14)
где − глубина (средняя или максимальная ) коррозионного разрушения; − время коррозии.
Показатель изменения толщины образующейся на металле пленки продуктов коррозии:
, (3.15)
где — изменение толщины образующейся на металле пленки продуктов коррозии; − время коррозии.
Показатель изменения массы:
, (3.16)
где − изменение массы корродирующего металла; S — поверхность коррозии; − время коррозии.
Объемный показатель коррозии:
, (3.17)
где − объем газа, выделившегося или поглощенного в процессе коррозии и приведенный к нормальным условиям; − время коррозии; S— поверхность коррозии.
Механический показатель коррозии:
, (3.18)
где − относительное изменение характеристики механического свойства; − время коррозии.
Показатель изменения электрического сопротивления:
, (3.19)
где − относительное изменение электросопротивления образца; − время коррозии.
Датчики скорости коррозии
Датчики скорости коррозии
Предназначен для определения коррозионной активности грунтов (грунтовых вод) по отношению к стальным подземным сооружениям (в том числе – подземным трубопроводам), для диагностики и прогнозирования коррозионного состояния наружной поверхности подземных стальных сооружений, а также для определения эффективности системы противокоррозионной защиты путем контроля скорости коррозии встроенных в датчик трех стальных индикаторов разного диаметра. |
Категория: Датчики скорости коррозии Блок пластин-индикаторов скорости коррозии БПИ-2 предназначен для определения опасности коррозии и эффективности действия электрохимической защиты от коррозии подземных стальных сооружений. |
Категория: Анализаторы Анализатор ИКП является портативными микропроцессорными устройством и предназначен для оперативного обслуживания Индикаторов коррозионных процессов ИКП, выпускаемых по ТУ 3435-007-51996521-2009. |
Категория: Индикаторы коррозионных процессов Индикаторы коррозионных процессов серии ИКП предназначены для определения скорости и глубины коррозии (в том числе локальной) стального подземного сооружения. |
Что такое скорость коррозии?
Что означает скорость коррозии?
Скорость коррозии — это скорость, с которой любой металл разрушается в определенных условиях. Его также можно определить как количество потерь от коррозии в год по толщине. Скорость или скорость разрушения зависит от условий окружающей среды, а также от типа и состояния исследуемого металла.
При расчете скорости коррозии любого металла необходимо собрать несколько данных.Обязательные данные включают:
- Потеря веса (уменьшение веса металла за отчетный период).
- Плотность металла.
- Изначально имелась общая площадь.

- Продолжительность затраченного времени.
Corrosionpedia объясняет скорость коррозии
Скорость коррозии лучше всего выражать в терминах толщины или потери веса, когда поверхность металла подвергается коррозии равномерно по всей открытой области.
Он находится по:
R = d / t выражается в мкм / год , но также может быть выражено в терминах:
- Потеря веса г / м2
- мг / дм2. День
- унций / ft2
- Среди прочего.
Общая потеря толщины в микрометрах равна: d = total. Возникновение убытка t = время в годах.
Эта скорость может изменяться, если скорость, выраженная вышеприведенной функцией, используется для сравнения скорости коррозии за период времени не менее одного года со скоростью, рассчитанной за короткие периоды.Это связано с тем, что краткосрочные ставки подвержены колебаниям окружающей среды от сезона к сезону, а также изо дня в день.
Этот метод включает воздействие на взвешенный образец металла или сплава в определенных условиях в течение определенного времени. Затем следует тщательная очистка для удаления продуктов коррозии и определение веса металла, потерянного из-за коррозии.
Скорость также можно рассчитать следующим образом:
R = KW / (? AT)
Где K = постоянная
W = общая потеря веса
T = время, затраченное на потерю металла
A = площадь поверхности обнаженного металла
? = плотность металла в г / см³
Коррозия железа при водной коррозии может быть использована для объяснения другого метода определения скорости коррозии.Железную пластину погружают в водный раствор, и увеличение количества накапливаемых ионов железа измеряют фотометрическим методом Fe3 +.
Скорость коррозии — обзор
Перед использованием данных скорости коррозии следует понять некоторые общие аспекты. Это значимые десятичные дроби и надежность измерения.
8.4.10b Статистический анализ
В разделе 12.2f обсуждаются ошибки любого измерения. Результаты испытаний на коррозию по своей природе имеют больший разброс, чем результаты любых других испытаний.По этой причине часто проводится статистический анализ. Это позволяет оценить уверенность в результатах тестирования. В этом разделе обсуждаются некоторые часто используемые статистические методы для анализа результатов испытаний на коррозию.
Гистограмма: Гистограмма — это гистограмма для отображения разброса данных. На рисунке 8.65 представлена типичная гистограмма. Он строится путем разделения данных испытаний на коррозию на равные интервалы и представления количества точек данных в каждом интервале в виде столбца.Количество интервалов выбирается таким образом, чтобы каждый интервал содержал не менее трех точек. Подбирается достаточное количество интервалов для изображения формы и симметрии высоты бруска. Таким образом, для построения гистограммы требуется много точек данных.
РИСУНОК 8.65. Типичный пример отображения набора данных в форме гистограммы.
Нормальное распределение: Если распределение нормальное, то оно будет колоколообразным или симметричным (рис. 8.65). Многие статистические анализы предполагают, что распределение точек данных является нормальным, поэтому это проверяется перед проведением статистического анализа; в противном случае анализ приведет к ошибочным выводам.
Документ о нормальной вероятности: Если данные не демонстрируют нормального распределения (т.е. они не демонстрируют распределение, представленное на рис. 8.65), данные могут быть исследованы путем построения графика нормальной вероятности. На рис. 8.66 показан типичный документ с нормальным распределением.
РИСУНОК 8.66. Иллюстрация типичной бумаги для нормального распространения. 106
Воспроизведено с разрешения ASTM.Стандарты, обеспечивающие процедуры для построения графика нормальной вероятности, включают:
- •
ASTM G16, «Стандартное руководство по применению статистики к анализу данных о коррозии»
Другой документ вероятности: Если гистограмма не симметричные и колоколообразные, или если график нормальной вероятности не показывает линейности, данные могут быть преобразованы в другой набор данных, который может быть нормально распределен. Некоторые часто используемые методы преобразования включают анализ Фурье, дисперсионный анализ (ANOVA), ковариацию, скользящее среднее и регрессию. Если преобразованные данные дают приблизительно прямую линию на графике вероятности, то с их помощью можно выполнить статистический анализ. Однако следует понимать доверительные интервалы преобразованных данных и сообщать их вместе со статистическим анализом.
Некоторые часто используемые методы преобразования включают анализ Фурье, дисперсионный анализ (ANOVA), ковариацию, скользящее среднее и регрессию. Если преобразованные данные дают приблизительно прямую линию на графике вероятности, то с их помощью можно выполнить статистический анализ. Однако следует понимать доверительные интервалы преобразованных данных и сообщать их вместе со статистическим анализом.
Неизвестное распределение: Когда точек данных коррозии недостаточно или когда распределение не может быть определено с помощью обычного статистического анализа, точки данных считаются имеющими неизвестное распределение.Неизвестные точки данных распределения могут быть проанализированы либо путем предположения, что они следуют шаблону схожих типов данных, либо с использованием непараметрических методов, которые не используют данные эффективно. В обоих случаях следует понимать, что результат анализа неточен.
Анализ экстремальных значений: Для определения вероятности локальной коррозии, особенно точечной коррозии или растрескивания (SSC и SCC), статистические инструменты для анализа нормальных распределений бесполезны. В этом случае используется статистический анализ экстремальных значений, такой как анализ экстремальных значений Вейбулла и Гамбеля. 105
В этом случае используется статистический анализ экстремальных значений, такой как анализ экстремальных значений Вейбулла и Гамбеля. 105
Стандарты, содержащие руководящие принципы для анализа данных о питтинговой коррозии, включают:
- •
Стандарт ASTM G 46, «Стандартное руководство по исследованию и оценке питтинговой коррозии»
Ошибки во время эксперимента, регистрация поля данные или при расчете коррозии могут помешать статистической обработке данных или привести к ошибочным выводам, если они включены в анализ.Иногда статистический анализ может выявить ошибки, указав, что вероятность получения определенного результата очень мала. С другой стороны, если скорость коррозии является функцией нескольких независимых переменных, и с этими переменными связаны ошибки, ошибку скорости коррозии можно оценить с помощью специального статистического метода, называемого «методом распространения дисперсии».
Стандарты, содержащие руководящие принципы статистического анализа, включают:
- •
ASTM G 16, «Стандартное руководство по применению статистики для анализа данных о коррозии»
|
| ||||||||||||||||||||||||||||
Факторы, влияющие на скорость коррозии
Введение Есть несколько факторов, влияющих на скорость коррозии, включая диффузию, температуру, проводимость, тип ионов, значение pH и электрохимический потенциал. Скорость коррозии можно контролировать или снижать путем нанесения антикоррозионных покрытий или методов защиты от коррозии, включая композитные ремонтные составы, шпатлевки для ремонта металла и армирующую пленку. Здесь мы исследуем различные факторы, влияющие на скорость коррозии.
Скорость коррозии можно контролировать или снижать путем нанесения антикоррозионных покрытий или методов защиты от коррозии, включая композитные ремонтные составы, шпатлевки для ремонта металла и армирующую пленку. Здесь мы исследуем различные факторы, влияющие на скорость коррозии.
В большинстве случаев скорость коррозии металлов контролируется диффузией реагентов к поверхности металла и от нее. Свежеоткрытые стальные поверхности без покрытия подвержены коррозии в большей степени, чем покрытые плотным слоем ржавчины.Скорость коррозии также в значительной степени контролируется диффузией кислорода через воду к стальной поверхности. В областях, где преобладает диффузия кислорода, коррозия, по-видимому, происходит быстрее. Области с большим потоком, например, вблизи горловины раструба, будут иметь тенденцию демонстрировать более высокие скорости коррозии из-за повышенного уровня кислорода, хотя эрозия также является одним из факторов. Области, покрытые тонкой проводящей пленкой влаги, подвержены коррозии быстрее, чем участки, находящиеся под водой. Таким образом, пространство корпуса в верхней части балластных танков и в верхней части танков с двойным дном, где застрял воздух, имеет тенденцию к коррозии быстрее, чем глубоко затопленные области, где имеется меньшая доступность кислорода.
Области, покрытые тонкой проводящей пленкой влаги, подвержены коррозии быстрее, чем участки, находящиеся под водой. Таким образом, пространство корпуса в верхней части балластных танков и в верхней части танков с двойным дном, где застрял воздух, имеет тенденцию к коррозии быстрее, чем глубоко затопленные области, где имеется меньшая доступность кислорода.
Поскольку скорость коррозии определяется диффузией, скорость диффузии также определяется температурой. Сталь и другие металлы корродируют быстрее при более высоких температурах, чем при более низких температурах. В результате области под палубой и области, прилегающие к машинному отделению или к нагретым грузовым танкам, будут подвержены коррозии быстрее или предпочтительнее. Одной из особенностей современного танкера с двойным корпусом и полностью изолированными балластными танками является то, что когда грузовые танки полностью загружены, пустые балластные танки действуют как вакуумная колба или термос и сохраняют тепло в грузе значительно дольше, чем однокорпусная конструкция. Это повышение температуры грузовой / балластной переборки в сочетании с более холодной переборкой внешней оболочки (в подводных областях) создает сложный набор условий коррозии и приводит к увеличению скорости коррозии стали в балластных танках. Скорость коррозии самих грузовых танков также будет выше из-за повышения температуры.
Это повышение температуры грузовой / балластной переборки в сочетании с более холодной переборкой внешней оболочки (в подводных областях) создает сложный набор условий коррозии и приводит к увеличению скорости коррозии стали в балластных танках. Скорость коррозии самих грузовых танков также будет выше из-за повышения температуры.
Электропроводность
Для возникновения коррозии должна быть проводящая среда между двумя частями реакции коррозии.В дистиллированной воде коррозии не будет, и скорость коррозии будет увеличиваться по мере увеличения проводимости из-за присутствия большего количества ионов в растворе. Скорость коррозии стали достигает максимума, близкого к нормальному содержанию ионов в морской воде. Пресная вода вызывает коррозию стали в меньшей степени, чем солоноватая или устьевая вода, при этом морская вода обычно является наиболее коррозионной для стали.
Тип ионов Некоторые типы ионов, присутствующие в морской воде или в грузах, более агрессивны, чем другие.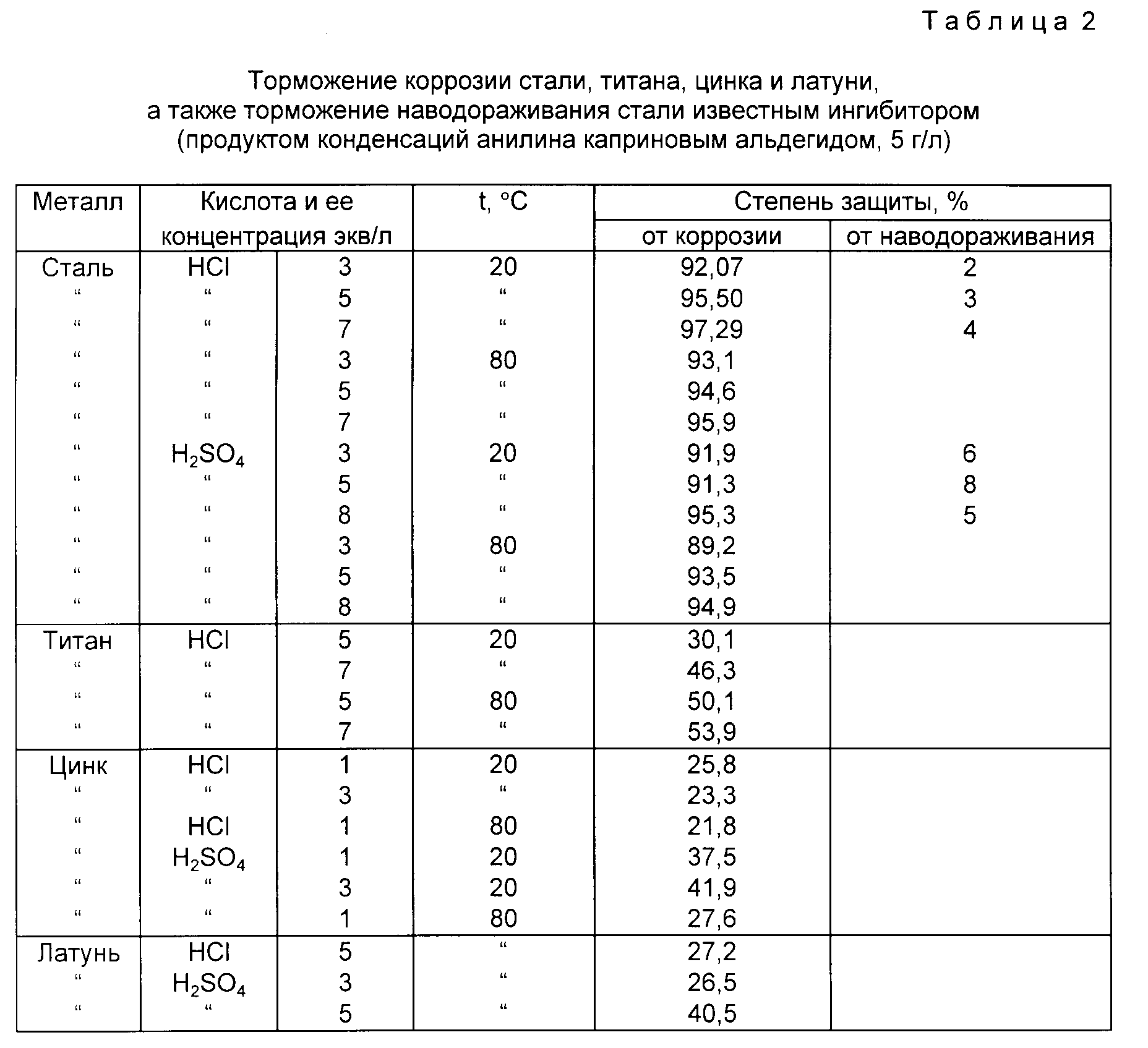 Хлорид-ионы обычно наиболее разрушительны, а сульфат и другие серосодержащие ионы также создают серьезные проблемы. Хлорид-ионы разрушительно влияют на защитные свойства любой ржавчины, предотвращая образование более защитных, плотно упакованных оксидов. Серосодержащие ионы участвуют в дополнительных реакциях генерации электронов внутри самой ржавчины, что, в свою очередь, формирует циклический самовосстанавливающийся процесс. Это может вызвать интенсивную точечную коррозию на внутреннем дне грузовых танков нефтеналивных судов и нефтепродуктовозов.Сера может поступать как из системы инертного газа, так и из грузов, содержащих серу, таких как высокосернистая сырая нефть.
Хлорид-ионы обычно наиболее разрушительны, а сульфат и другие серосодержащие ионы также создают серьезные проблемы. Хлорид-ионы разрушительно влияют на защитные свойства любой ржавчины, предотвращая образование более защитных, плотно упакованных оксидов. Серосодержащие ионы участвуют в дополнительных реакциях генерации электронов внутри самой ржавчины, что, в свою очередь, формирует циклический самовосстанавливающийся процесс. Это может вызвать интенсивную точечную коррозию на внутреннем дне грузовых танков нефтеналивных судов и нефтепродуктовозов.Сера может поступать как из системы инертного газа, так и из грузов, содержащих серу, таких как высокосернистая сырая нефть.
pH — это мера кислотности или щелочности по шкале от 1 до 14. pH 7 является нейтральным. В нейтральной морской воде pH составляет около 7,5, что означает, что ионы водорода (кислота) и ионы гидроксила (щелочь) почти сбалансированы. При таких обстоятельствах реакция, которая уравновешивает растворение железа, представляет собой восстановление растворенного кислорода с образованием гидроксильных ионов.Однако если окружающая среда становится более кислой и pH падает ближе к 1, то в растворе присутствует большее количество ионов водорода, чем гидроксильных ионов. Избыточные ионы водорода могут участвовать в уравновешивающей (катодной) реакции, которая приводит к выделению газообразного водорода. Поскольку и ионы водорода, и газообразный водород могут очень быстро диффундировать, сталь может корродировать быстрее. Это обычное явление при перевозке таких грузов, как нефтяной кокс, сера и высокосернистая нефть. В щелочных условиях, когда имеется избыток гидроксильных ионов и уровень pH стремится к 14, сталь не подвержена коррозии и остается неизменной.Многие блистеры в балластных цистернах, особенно в двойном дне, заполнены жидкостью с высоким pH. Когда блистеры сняты, сталь под ними светлеет. Однако он начнет разъедать после снятия колпачка, поэтому после проверки одного или двух пузырей из группы и определения щелочной жидкости оставшуюся часть пузырей следует оставить нетронутой.
Электрохимический потенциалКаждый металл приобретает определенный электрохимический потенциал при погружении в проводящую жидкость.Этот потенциал называется потенциалом полуячейки, поскольку его можно измерить только путем сравнения его с другим известным опорным потенциалом, создаваемым электродом сравнения. Обычные электроды сравнения — это насыщенный каломельный электрод (SCE), электроды сравнения из серебра / хлорида серебра и меди / сульфата меди. Потенциал, который металл принимает в растворе, может определить, будет ли он подвергаться коррозии и как быстро. Потенциал можно изменить, подключив его к другому непохожему металлу (как при гальванической коррозии или с помощью расходуемых анодов), или путем приложения внешнего потенциала, как это происходит с активной системой катодной защиты того типа, который используется на внешнем корпусе.
Коррозия металлов
Теория коррозии металлов
Коррозия определяется как повреждение материала в результате химическая, часто электрохимическая реакция с окружающей средой. Согласно этому определению термин «коррозия» может применяться ко всем материалы, в том числе неметаллы. Но на практике слово коррозия в основном используется в в сочетании с металлическими материалами.
Почему металлы корродируют? Помимо золота, платины и некоторых других, в чистом виде металлы в природе не встречаются. Они обычно химически связаны с другими веществами в рудах, такими как сульфиды, оксиды и т. д. Энергия должна быть затрачена (например, в доменной печи) для извлечения металлов из сульфиды, оксиды и т. д. для получения чистых металлов.
Чистые металлы содержат больше связанной энергии, представляя собой более высокое энергетическое состояние, чем в природе в виде сульфидов или оксидов.
Энергетическое состояние металла в различных формах
Поскольку весь материал во Вселенной стремится вернуться к своему низкому уровню энергетическое состояние, чистые металлы также стремятся вернуться к своему самому низкому энергетическому состоянию которые у них были в виде сульфидов или оксидов. Один из способов, которыми металлы могут вернуться к низкому уровню энергии за счет коррозии. Продукты коррозии металлы часто представляют собой сульфиды или оксиды.
Химическая и электрохимическая коррозия
Химическая коррозия может рассматриваться как окисление и происходит под действием сухих газов, часто при высоких температурах. С другой стороны, имеет место электрохимическая коррозия. электродными реакциями, часто во влажной среде, например, влажной коррозией.
Все металлы в сухом воздухе покрыты очень тонким слоем оксида, мощностью около 100 (10 -2 м).Этот слой образован химическими веществами. коррозия кислородом воздуха. При очень высоких температурах реакция с кислородом в воздухе может продолжаться без ограничений, и металл быстро превратится в оксид.
Окисление металла при разных температурах
При комнатной температуре реакция останавливается, когда слой становится тонким.Эти тонкие слои оксида могут защитить металл от продолжительного воздействия, например в водный раствор. На самом деле именно эти слои оксида и / или продукты коррозии, образующиеся на поверхности металла, которые защищают металл от продолжающегося воздействия в гораздо большей степени, чем коррозия сопротивление самого металла.
Эти слои оксида могут быть более или менее прочными в вода, например.Мы знаем, что обычная углеродистая сталь быстрее корродирует в воде. чем нержавеющая сталь. Разница зависит от состава и проницаемость их соответственно оксидных слоев. Следующее описание явление коррозии касается только электрохимической коррозии, т.е. влажная коррозия.
Ячейки коррозии
Как металлы корродируют в жидкостях? Проиллюстрируем это, используя явление коррозии, называемое биметаллической коррозией или гальванической коррозией.Биметаллическая коррозионная ячейка может, например, состоят из стальной пластины и медной пластины в электрическом контакте друг с другом и погружены в водный раствор (электролит).
Электролит содержит растворенный кислород из воздуха. и растворенная соль. Если лампа подключена между стальной пластиной и медная пластина, она загорится. Это указывает на то, что ток течет между металлические пластины.Медь будет положительным электродом, а сталь — быть отрицательным электродом.
Ток течет через лампу от медной пластины к стальной пластине
Движущей силой тока является разница в электрическом потенциал между медью и сталью. Цепь должна быть замкнута и следовательно, ток будет течь в жидкости (электролите) от стального листа. к медной пластине.Ток протекает через положительно заряженный атомы железа (ионы железа) покидают стальную пластину, и стальная пластина подвергается коррозии.
Корродирующая металлическая поверхность называется анодом. Кислород и вода расходуются на поверхности медной пластины, а гидроксильные ионы (ОН-), которые имеют отрицательный заряд, образуются. Отрицательные ионы гидроксила «нейтрализовать» положительно заряженные атомы железа.Ионы железа и гидроксила образуют гидроксид железа (ржавчина).
В описанной выше коррозионной ячейке металлическая медь называется катодом. Обе металлические пластины называются электродами, а определение анода и катода дано ниже.
Анод : Электрод, от которого течет положительный ток.
в электролит.
Катод : Электрод, через который проходит положительный электрический ток.
ток уходит из электролита.
Когда положительные атомы железа переходят в раствор из стальной пластины, электроны остаются в металле и переносятся в обратном направлении, в сторону положительный ток.
Предпосылки для
К формированию биметаллической ячейки относятся:
1.Электролит
2. Анод
3. Катод
4. Окислительная среда, например растворенный кислород (O 2 ) или ионы водорода.
(H + ).
Электродный потенциал — гальваническая серия
В приведенном выше примере было показано, что движущая сила для протекания тока и, следовательно, Коррозия — это разность электродных потенциалов.Электродный потенциал металл — это показатель склонности металла к растворению и коррозии. в определенном электролите.
Упоминается также «благородство» металла. Более благородный металла, чем выше потенциал, тем меньше у него тенденция к раствориться в электролите.
Электродные потенциалы различных металлов могут быть указаны в отношение друг к другу в гальваническом ряду для разных электролитов.В гальванический ряд различных металлов в морской воде показан ниже.
| Золото | +0,42 |
| Серебро | +0,19 |
Нержавеющая сталь (AISI 304), пассивное состояние | +0.09 |
| Медь | +0,02 |
| Олово | -0,26 |
Нержавеющая сталь (AISI 304), активное состояние | -0,29 |
| Свинец | -0,31 |
| Сталь | -0.46 |
| Кадмий | -0,49 |
| Алюминий | -0,51 |
| Оцинкованная сталь | -0,81 |
| цинк | -0,86 |
| Магний | -1,36 |
Учитывая сталь-медь Например, из приведенной выше таблицы будет отмечено, что медь имеет более высокий потенциал ( благороднее), чем обычная углеродистая сталь.Сталь будет анодом и корродирует, тогда как медь будет катодом и не подвергнется коррозии.
Коррозия в микроячейках
Сталь-медь пример показал, как происходит коррозия, когда два разных материала соединен в водном растворе. Как происходит коррозия на поверхности из цельного металла? Когда поверхность металла исследуется под микроскопом, будет видно, что это не один однородный металл.Различия в структура и размер зерна возникают на поверхности. Химический состав может варьируются, и могут присутствовать различные примеси.
Если потенциал электрода измеряется через явно однородной поверхности, будет обнаружено, что она значительно варьируется в пределах только доли квадратного миллиметра. Итак, катоды и аноды, возможно, маленькие, но достаточно большой, чтобы вызвать коррозию, может быть сформирован на той же металлической поверхности.В результате анодной и катодной реакций образовалась коррозионная микроячейка. описано ниже.
Анодная часть поверхности корродирована
В случае низкого pH катодная реакция будет: 2e — + 2H + → H 2 . Поверхность катода может быть примеси, такие как оксидные включения, усиление графита или более благородная фаза.
Сопротивление линейной поляризации и скорость коррозии — Магазин приборов для исследования сосны
1 Аннотация Этот документ знакомит с теорией и основами сопротивления линейной поляризации (LPR). измерения и расчет скорости коррозии по данным LPR. Реализация измерений LPR в AfterMath также описан. 2 Общие сведения об измерениях коррозии и предварительная информация 2,1 Сопротивление линейной поляризации| (1) |
| (2) |
| (3) |
| (4) |
| (5) |
| (6) |
| (7) |
| (8) |
| (9) |
В качестве примера рассмотрим двухэлектронное окисление железа:
| (10) |
| (11) |
| (12) |
| Скорость проникновения ( ῡ p ) ед. | i corr ед. | ρ шт. | κ p значение | κ p шт. |
| миль в год | мкА / см 2 | г / см 3 | 0.1288 | МПи⋅г / (мкА⋅см) |
| мм / год (1) | А / м 2 | кг / м 3 | 327,2 | мм⋅кг / (Аммгод) |
| мм / год (2) | мкА / см 2 | г / см 3 | 3,27 × 10 -3 | мм⋅г / (мкА⋅см⋅год) |
| (13) |
| Скорость потери массы ( ῡ м ), ед. | i corr ед. | κ м значение | κ м шт. |
| г / (м 2 ⋅день) | А / м 2 | 0.8953 | г / (день) |
| мг / (дм 2 ⋅день), т.е. , mdd (1) | мкА / см 2 | 0,0895 | мг⋅см 2 / (мкА⋅дм 2 ⋅день) |
| мг / (дм 2 ⋅сут), т.е. , mdd (2) | А / м 2 | 8,953 × 10 -3 | мг⋅м 2 / (Адм 2 ⋅день) |
Выполнение измерения OCP в AfterMath выполняется путем выполнения следующих шагов:
- Запустите AfterMath и перейдите на вкладку Experiments .Выберите Open Circuit Potential (OCP) из раскрывающегося меню.
- Введите соответствующие параметры или нажмите «Автозаполнение» (более ранние версии могут читать «Мне повезет»), чтобы заполнить поле параметрами по умолчанию.
- Щелкните Выполните . AfterMath соберет и отобразит данные OCP. В идеале график зависимости потенциала от времени должен приближаться к нулевому наклону, что указывает на равновесие между раствором и электродами. Обычно наблюдается небольшое отклонение потенциала с течением времени (отклонение 100 мкВ).Это отклонение является нормальным шумом при измерении (см. Рисунок 1).
- Если изменение потенциала слишком велико, для достижения стабильного измерения могут потребоваться более длительные периоды электролиза (200–500 с или дольше). В этом случае просто увеличьте «Период электролиза» и масштабируйте «Число интервалов» вместе с ним, чтобы обеспечить хорошее количество точек данных для измерения.
Рис. 1. Необработанные данные OCP в AfterMath с допустимым шумом
Поскольку измерение OCP обнаруживает очень небольшие изменения потенциала с течением времени, автоматически масштабируемая ось Y часто отображает чрезвычайно маленькое окно потенциала, непропорционально подчеркивая шум в отображаемых данных.Ось Y можно отрегулировать для улучшения внешнего вида данных (см. Рисунок 2). Для настройки масштаба оси Y:
- Дважды щелкните по оси Y графика; Откроется диалоговое окно Axis Properties , которое позволяет изменять ось.
- Под панелью Scale (внизу справа) снимите флажок Auto .
- Вручную настройте пределы и интервалы графика.
Рисунок 2.Данные OCP в AfterMath с масштабированием оси потенциалов и согласованием с линией наилучшего соответствия
3,2 Использование инструментов AfterMath для определения потенциала коррозииС графиком OCP, скорректированным по осям, инструменты, встроенные в AfterMath, можно использовать для поиска базовой линии (также называемой линией наилучшего соответствия регрессии) через сегмент данных OCP в установившемся состоянии.
- Щелкните правой кнопкой мыши данные OCP и выберите Добавить инструмент / базовую линию .
- Должна появиться наиболее подходящая линия с точками розового и черного цветов, которые определяют длину наиболее подходящей линии.
- Выберите розовые контрольные точки и отрегулируйте их в конце графика зависимости потенциала от времени (где потенциал приближается к ответу, подобному устойчивому состоянию).
- Инструмент AfterMath сообщает результирующий наклон и пересечение линии наилучшего соответствия. Значение точки пересечения эквивалентно потенциалу коррозии, E corr (см. Рисунок 2).
Чтобы запустить измерение LPR в AfterMath, необходимо выполнить следующие шаги:
- В раскрывающемся меню Experiments выберите Linear Polarization Resistance (LPR). Окно параметров LPR появится в правой части AfterMath.
- На вкладке Basic Parameters , панели по умолчанию, которая открывается при запросе измерения LPR, можно ввести параметры. При нажатии кнопки «Автозаполнение» (более ранние версии могут читаться как «Мне повезет») будут введены параметры по умолчанию в поля, необходимые для проведения измерения. В качестве альтернативы, общие экспериментальные параметры для измерений LPR можно найти в таблице 3.
- Щелкните Выполните .
| Параметр | Вход |
| Период OCP | от 10 до 100 секунд |
| Начальный потенциал | от -10 мВ до -20 мВ по сравнению с OCP |
| Конечный потенциал | от +10 мВ до +20 мВ по сравнению с OCP |
| Скорость развертки | <1 мВ / с |
| Обнаружение линейной области | «Автоматическое обнаружение» |
| Временной ряд | 1 |
Таблица 3.Общие параметры для измерений LPR
AfterMath выполнит серию измерений, начиная с OCP, а затем продолжит, выполнив трехсегментную линейную развертку, измеряя ток как функцию от приложенного потенциала. Измерения LPR обычно занимают несколько минут. По завершении измерения полученные данные отображаются в виде графика зависимости напряжения от тока. Результирующие данные должны быть линейными (или близкими к линейным), а прямая и обратная развертки должны почти перекрывать друг друга (см. Рисунок 3).
Рисунок 3. Данные измерений LPR без дополнительных входов
Помните, что выходные данные, предоставляемые AfterMath для измерений LPR, основаны на информации, предоставленной AfterMath перед экспериментом. Используя только указанные выше входные данные, AfterMath автоматически рассчитает потенциал коррозии и линейное сопротивление при потенциале коррозии. Однако обратите внимание, что нормализация наклона графика напряжение-ток по площади рабочего электрода приводит к поляризационному сопротивлению, поэтому наклон пропорционален поляризационному сопротивлению.Для автоматического расчета поляризационного сопротивления и / или плотности тока коррозии и скорости коррозии в AfterMath исследователь должен предоставить дополнительную информацию до проведения эксперимента (см. Разделы 4.1.2 и 4.1.3, соответственно). 4.1.2 Определение нормированного сопротивления поляризации Чтобы AfterMath автоматически рассчитал нормализованное сопротивление поляризации, вкладка Basic Parameters должна быть заполнена, как в разделе 4.1.1, и должна быть известна площадь рабочего электрода. Чтобы добавить площадь рабочего электрода в AfterMath, перейдите на вкладку Basic Parameters , установите флажок рядом с Normalize By Area и укажите площадь поверхности рабочего электрода в AfterMath на входе Sample Area с помощью выбранные соответствующие единицы (см. рисунок 4). На основе этих данных при измерении LPR будет построен график зависимости плотности тока от потенциала (см. Рисунок 5). Обратите внимание, что добавленный инструмент автоматически вычисляет нормализованное сопротивление поляризации, создавая наиболее подходящую линию для данных.Розовые контрольные точки этого инструмента при необходимости можно настроить вручную для лучшего соответствия данным.Рис. 4. Пример параметров сопротивления линейной поляризации (LPR) в AfterMath
Рис. 5. График линейной поляризации с предоставленной только площадью электрода
4.1.3 Определение плотности тока коррозии и скорости коррозии Чтобы AfterMath автоматически вычислял плотность тока коррозии и скорость коррозии, вкладка Basic Parameters должна быть заполнена, как в Разделах 4.1.1 и 4.1.2, но требуется еще больше входных данных. Установите флажок рядом с полем « Автоматически определять скорость коррозии» на вкладке «Основные параметры » и введите плотность образца, эквивалентный вес и константы Тафеля с соответствующими единицами измерения. С предоставленными входными данными измерение LPR будет генерировать график зависимости плотности тока от потенциала, аналогичный показанному на рисунке 5. К данным автоматически добавляется наиболее подходящая линия, и рассчитываются поляризационное сопротивление, потенциал коррозии и скорость коррозии (см. Рисунок 6).Розовые контрольные точки этого инструмента при необходимости можно настроить вручную для лучшего соответствия данным.Рис. 6. График LPR с плотностью тока коррозии и скоростью коррозии
4,2 Настройка измерения LPR во времени AfterMath имеет встроенную функциональность, которая позволяет расширить единичное измерение LPR до измерения LPR с течением времени. Когда серия измерений LPR выполняется с течением времени, AfterMath генерирует дополнительные графики данных, отображающие параметры коррозии с течением времени.Типы создаваемых графиков определяются информацией, доступной AfterMath об исследуемой системе до сбора данных. По этой причине рекомендуется предоставить AfterMath соответствующую информацию об исследуемой системе перед началом эксперимента, если она доступна. Эти значения могут быть предоставлены в окне основных параметров LPR в правом нижнем углу панели параметров скорости коррозии (см. Рисунок 4 и Раздел 4.1 для подробного обсуждения системных входных данных и выходных данных AfterMath). Чтобы выполнить измерение LPR с течением времени:- В AfterMath выберите Linear Polarization Resistance (LPR ) из раскрывающегося меню Experiments .
- Откроется окно Параметры LPR .
- На вкладке Basic Parameters найдите панель Time Series в верхнем правом углу и введите количество измерений LPR, которые должны быть получены при LPR Series Iterations .
- Время ожидания между измерениями, а также дополнительное время, необходимое для сбора данных, можно ввести в поле Время между итерациями .
- измерений OCP будет выполняться перед каждым сканированием LPR в соответствии с настройками AfterMath по умолчанию, но при желании это можно изменить в параметрах LPR OCP Mode .
LPR на временные измерения может занять несколько часов в зависимости от выбранных параметров. Когда сбор данных завершен, AfterMath построит график данных.Графики будут включать потенциал коррозии в зависимости от времени, сопротивление поляризации в зависимости от времени, а также отдельные измерения LPR и измерения OCP, которые были собраны и использованы для создания графиков времени. Представлен график зависимости сопротивления поляризации образца от времени, созданный AfterMath (см. Рисунок 7).
Рис. 7. Зависящие от времени значения сопротивления поляризации, полученные измерениями LPR в AfterMath
Pine Research также создала рабочий лист (в формате Microsoft Excel), чтобы помочь в определении подходящих значений для параметров эксперимента LPR с помощью AfterMath.Например, часто исследователь может просто знать, что он хочет получать данные LPR «каждый час в течение 16 часов». В подобных случаях рабочий лист полезен для визуализации общего экспериментального потока LPR и расчета правильных значений для каждого шага, показанного в AfterMath. См. Ссылку здесь: 5 Обработка постсбора данных LPR в AfterMathAfterMath предоставляет инструменты, которые можно использовать для обработки и получения дополнительных сведений о данных LPR после их получения.Например, после сбора данных график потенциал-ток можно преобразовать в график плотности потенциала-тока с помощью встроенных функций AfterMath или рассчитать скорость коррозии на основе существующих данных LPR с помощью инструмента LPR Baseline Tool. AfterMath следует за единицами СИ в электрохимических экспериментах, поэтому соответствующие единицы используются и сохраняются вместе с обработанными данными.
5.1 Управление осями графикаОси графика потенциал-ток LPR можно изменять в AfterMath в зависимости от потенциала LPR.график плотности тока (см. рисунок 8). Для примера, представленного на рисунке 8, текущие данные были нормализованы к площади электрода 0,20 см 2 , и данные были добавлены на вторичную ось x (в отличие от замены существующей оси x). Чтобы вручную манипулировать осью такого графика данных, выполните следующие действия:
- Вычислить площадь поверхности рабочего (коррозионного) электрода в м 2 .
- Щелкните данные правой кнопкой мыши и выберите Применить преобразование ↓ Простые математические операции .
- В разделе Функция выберите Деление (/).
- В разделе «Параметры / опции » выберите Выполнить операцию только с X-данными .
- Значение операнда должно быть площадью рабочего электрода в м 2 .
- В разделе Выбор единиц операнда выберите Область из раскрывающегося меню стандартных единиц.
- Площадь нормализуется, поэтому единицы имеют длину 2 .Поэтому в квадратах рядом с Длина (м) следует читать «2/1».
- В разделе «Параметры / параметры » выберите, заменять ли ось x, установив флажок перед Заменить исходную трассу . Если этот флажок не установлен, к существующему графику будут добавлены второстепенные оси. В этом руководстве снимите флажок перед «Заменить исходную трассу».
- Щелкните ОК .
- На полученной вольтамперограмме метка вторичной оси x должна теперь показывать «Плотность тока (А / м 2 )».
- Чтобы изменить значения на оси x, дважды щелкните значения оси x, и должно появиться диалоговое окно с надписью Axis Properties .
- В диалоговом окне в разделе Единицы снимите отметку с Автоматический выбор единиц , а затем рядом с Единицы / единицы выберите ампер на квадратный сантиметр в раскрывающемся меню.
- Префикс метрики также можно изменить, выбрав нужный префикс из раскрывающегося списка в Единицы / метрические единицы Например, выберите микро и нажмите Применить .
- Теперь единицы на графике должны быть (мкА / см 2 ).
- Масштабом оси также можно управлять с помощью параметра Масштаб .
- Нажмите ОК , чтобы сохранить изменения.
Рис. 8. Необработанные данные о токе (красный) и преобразованная плотность тока (синий) LPR в AfterMath
5.2 Инструмент для определения базовой линии LPRAfterMath имеет инструмент LPR Baseline, который позволяет определять сопротивление поляризации и скорость коррозии после сбора данных LPR.Для проведения этих расчетов исследователь должен предоставить инструменту соответствующие константы. Требуемые значения / константы: 1) площадь рабочего электрода, 2) плотность материала рабочего электрода, 3) эквивалентная масса материала рабочего электрода и 4) постоянные Тафеля для исследуемой системы. Ниже приведены пошаговые инструкции по использованию инструмента LPR Baseline:
- Щелкните правой кнопкой мыши данные на графике LPR и выберите Add Tool → LPR Baseline .
- На графике появится наиболее подходящая линия со значениями потенциала коррозии и крутизной линейного сопротивления (если исходные данные не были предоставлены).
- При необходимости розовые контрольные точки можно отрегулировать для более точного соответствия кривой. Длина базовой линии регулируется перетаскиванием черных контрольных точек.
- Значения, используемые для расчета инструмента, можно изменить, щелкнув правой кнопкой мыши текстовое поле инструмента и выбрав Properties , а затем выбрав Baseline Tool Properties .
- Обновите значения в Tafel Data . Обратите внимание, что эти значения зависят от эксперимента и необходимы для расчета скорости коррозии (см. Раздел 2.5 для обсуждения расчетов скорости коррозии).
- Щелкните ОК .
- AfterMath сообщает результирующие сопротивление поляризации и скорость коррозии в текстовом поле на графике LPR. Если в текстовом поле отображается NaN, необходимо ввести / обновить свойства инструмента.
- Повторите шаги 1-6, чтобы обновить значения в Tafel Data .
После выполнения вышеуказанных шагов график LPR должен быть обновлен текстовым полем, в котором указываются расчетный ток коррозии, сопротивление поляризации и скорость коррозии (см. Рисунок 9).
Рис. 9. Данные LPR в AfterMath с помощью инструмента LPR, примененные к данным плотности тока
6 Список литературы- Джонс, Д. А. & nbsp & nbsp Принципы и предотвращение коррозии , 2-е изд.Пирсон: Верхняя Сэдл-Ривер, Нью-Джерси, 1995.
- Стерн, М.; & nbsp Weisert, E. D. & nbsp & nbspASTM Proceeding 1959 — Volume 59., 1959 , 32 , 1280.
- ASTM & nbsp & nbsp Стандартная практика расчета скоростей коррозии и сопутствующая информация по электрохимическим измерениям. & Nbsp & nbsp Американское общество по испытаниям и материалам (ASTM) , 2015 .
| Электрод | Раствор | i (А / см 2 ) | ß c (В) |
| Pt | 1N HCl | 10 -2 | 0.03 |
| 0,1 н. NaOH | 7 × 10 -4 | 0,11 | |
| Pd | 0,6 н. HCl | 2 × 10 -3 | 0,03 |
| Пн | 1N HCl | 10 -5 | 0,04 |
| Au | 1N HCl | 10 -5 | 0,05 |
| Ta | 1N HCl | 10 -4 | 0.08 |
| Вт | 5N HCl | 10 -4 | 0,11 |
| Ag | 0,1 н. HCl | 5 × 10 -6 | 0,09 |
| Ni | 0,1 н. HCl | 8 × 10 -6 | 0,31 |
| 0,12 н. NaOH | 4 × 10 -6 | 0,10 | |
| Би | 1N HCl | 10 -6 | 0.10 |
| Nb | 1N HCl | 10 -6 | 0,10 |
| Fe | 1N HCl | 10 -5 | 0,15 |
| 0,52 Н 2 SO 4 | 2 × 10 -5 | 0,11 | |
| 0,4% NaCl (pH 1-4) | 10 -6 | 0,10 | |
| Cu | 0,1 н. HCl | 2 × 10 -6 | 0.12 |
| 0,15 н. NaOH | 10 -5 | 0,12 | |
| Сб | 2N H 2 SO 4 | 10 -8 | 0,10 |
| Al | 2N H 2 SO 4 | 10 -9 | 0,10 |
| Be | 1N HCl | 10 -8 | 0,12 |
| Sn | 1N HCl | 10 -7 | 0.15 |
| КД | 1N HCl | 10 -6 | 0,20 |
| Zn | 1N H 2 SO 4 | 2 × 10 -10 | 0,12 |
| Hg | 0,1 н. HCl | 7 × 10 -12 | 0,12 |
| 0,1 Н 2 SO 4 | 2 × 10 -12 | 0,12 | |
| 0.1 н. NaOH | 3 × 10 -14 | 0,10 | |
| Pb | 0,01 — 8N HCl | 2 × 10 -12 | 0,12 |
Атмосферная коррозия железа и стали
Железо в различных формах подвергается воздействию различных атмосферных сред.Железо имеет тенденцию к высокой реакционной способности с большинством из них из-за его естественной склонности к образованию оксида железа. Когда он действительно сопротивляется коррозии, это происходит из-за образования тонкой пленки защитного оксида железа на его поверхности в результате реакции с кислородом воздуха.
Эта пленка может предотвратить ржавление на воздухе при относительной влажности 99%, но такие загрязнения, как кислотный дождь, могут нарушить пассивность пленки и способствовать продолжающейся коррозии. Более толстые пленки оксида железа могут действовать как защитные покрытия и через год или около того могут снизить скорость коррозии.
Хотя скорость коррозии стали без покрытия в большинстве случаев имеет тенденцию к снижению со временем, разница в коррозионной активности различных атмосфер для конкретного сплава огромна. Сообщалось, что в некоторых случаях скорость коррозии черных металлов со временем увеличивается, и тщательный анализ условий воздействия обычно показывает, что произошло накопление загрязняющих коррозионных агентов, что изменило серьезность воздействия.
Обычно считается, что стали, содержащие очень небольшое количество меди, особенно подвержены сильной атмосферной коррозии.В одном испытании в течение трех с половиной лет как в морской, так и в промышленной атмосфере, сталь, содержащая 0,01% меди, корродировала со скоростью 80 мкм / год (3,1 млн / год), тогда как увеличение содержания меди в пять раз уменьшало скорость коррозии всего до 35 мкм / год (1,4 млн / год). Дальнейшие добавления небольших количеств никеля и хрома снизили скорость коррозии до ~ 10 мкм / год (0,39 млн / год). Другие тесты, сравнивающие серый чугун, ковкий чугун и низколегированные стали, показали, что их коррозионная стойкость была примерно одинаковой.
Обычный чугун, по-видимому, имеет скорость коррозии примерно вдвое меньше, чем у стали с содержанием меди 0,2% в морской атмосфере. Следует быть осторожным при цитировании таких сравнений, чтобы указать точный состав углеродистой стали (CS), потому что на коррозионное поведение CS очень сильно влияют небольшие изменения содержания меди и фосфора. После пяти лет воздействия в промышленной атмосфере конструкционная CS показала проникновение ~ 20 мкм (0,8 мил), конструкционная сталь из меди ~ 10 мкм (0.4 мил) и низколегированной стали ~ 4 мкм (0,15 мил).
Невозможно определить скорость коррозии стали в атмосфере без определения состава, местоположения и конкретных факторов окружающей среды. Если можно соотнести условия воздействия с описанными в литературе, можно будет сделать довольно хорошую оценку вероятного коррозионного поведения выбранного материала. Однако необходимо учитывать все аспекты воздействия на поверхность металла. Например, высокопрочная низколегированная (HSLA) сталь может показать преимущество в коррозионной стойкости 12: 1 по сравнению с CS при открытом воздействии в мягких условиях.По мере изменения степени или физических условий воздействия, сталь HSLA будет демонстрировать меньшее превосходство, пока в щелях или обратной стороне структурных форм в все более агрессивной атмосфере она не будет не лучше, чем CS.
Очень мало нужно сказать о поведении нержавеющих сталей (типы 200 и 300), которые содержат высокий процент никеля и хрома, за исключением того, что они могут сохранять свой блестящий вид без потускнения в течение многих десятилетий. Стали, содержащие только хром (тип 400) в качестве основного легирующего компонента, имеют тенденцию к поверхностной ржавчине, но другие стали относительно не подвержены поверхностной атмосферной коррозии.Однако многие из этих сплавов подвержены коррозионному растрескиванию под напряжением во многих обычных средах.
 Например, мм/год или масса металла превратившаяся в коррозионный продукт на единицу площади поверхности за единицу времени (потеря в весе, например, г/м2/год).
Например, мм/год или масса металла превратившаяся в коррозионный продукт на единицу площади поверхности за единицу времени (потеря в весе, например, г/м2/год). Скорость … Словарь-справочник терминов нормативно-технической документации
Скорость … Словарь-справочник терминов нормативно-технической документации
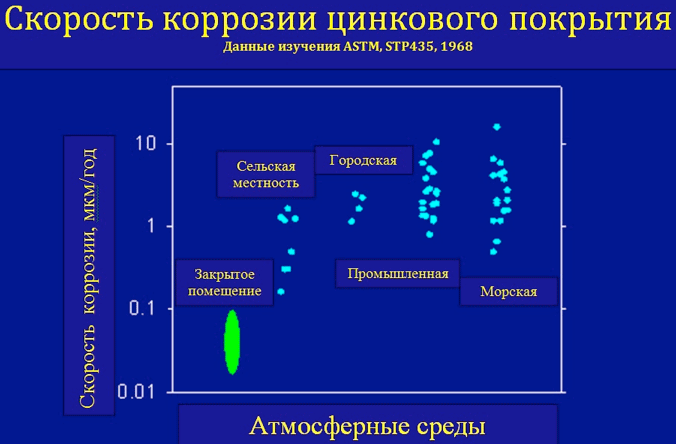 (Смотри: СТ СЭВ 4419 83. Защита от коррозии в строительстве. Конструкции строительные. Термины и… … Строительный словарь
(Смотри: СТ СЭВ 4419 83. Защита от коррозии в строительстве. Конструкции строительные. Термины и… … Строительный словарь Все эти вещества совершенно по-разному влияют и на людей, и на окружающую среду: растения, водоемы, металлы, обувь. Именно поэтому важно знать их свойства и правильно комбинировать, уменьшая негативное воздействие и увеличивая эффективность
Все эти вещества совершенно по-разному влияют и на людей, и на окружающую среду: растения, водоемы, металлы, обувь. Именно поэтому важно знать их свойства и правильно комбинировать, уменьшая негативное воздействие и увеличивая эффективность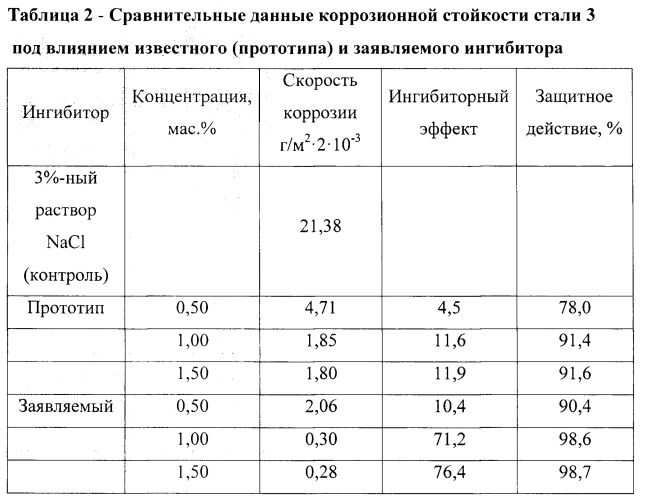 Однако утверждение, что ржавление автомобильных кузовов и дорожных металлических конструкций возникает исключительно из-за реагентов, и если их отменить, то и ржаветь ничего не будет, является утопией.
Однако утверждение, что ржавление автомобильных кузовов и дорожных металлических конструкций возникает исключительно из-за реагентов, и если их отменить, то и ржаветь ничего не будет, является утопией.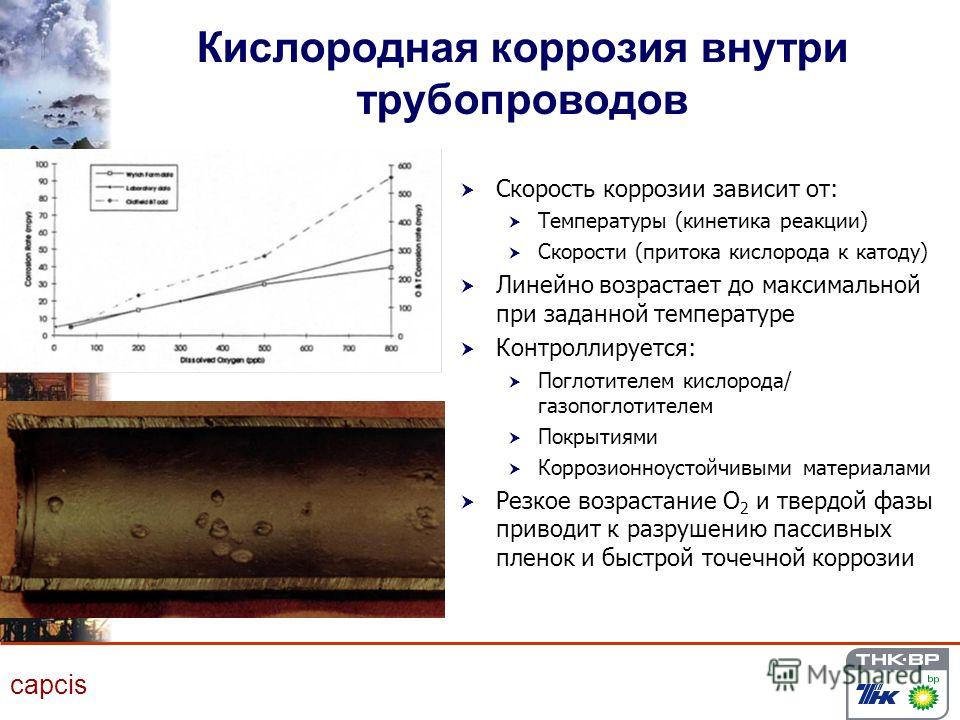
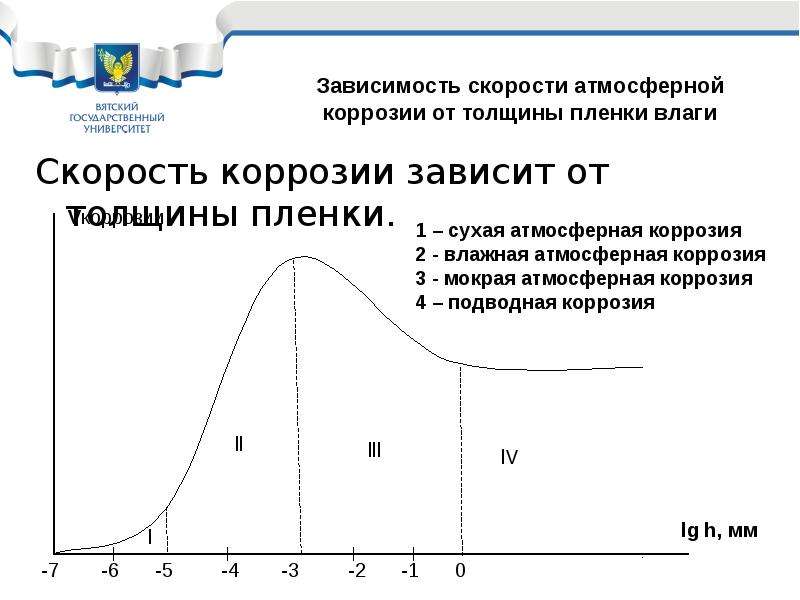

 И их также используют в качестве противогололедных реагентов.
И их также используют в качестве противогололедных реагентов. Однако существуют противогололедные реагенты, коррозионная активность которых ниже, чем у водопроводной воды и снега.
Однако существуют противогололедные реагенты, коррозионная активность которых ниже, чем у водопроводной воды и снега.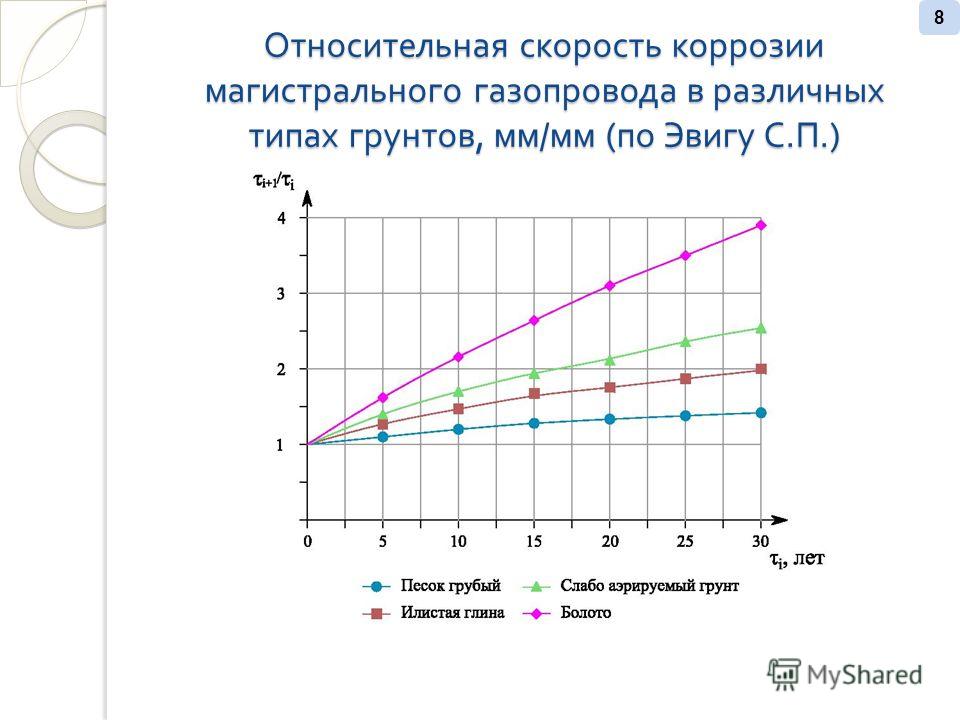 ) нередко возрастают. Производителям удалось добиться смесей, коррозионная активность которых сопоставима с активностью воды. Таким образом, при использовании этих реагентов скорость коррозии кузова автомобиля не выше, чем от простого снега.
) нередко возрастают. Производителям удалось добиться смесей, коррозионная активность которых сопоставима с активностью воды. Таким образом, при использовании этих реагентов скорость коррозии кузова автомобиля не выше, чем от простого снега.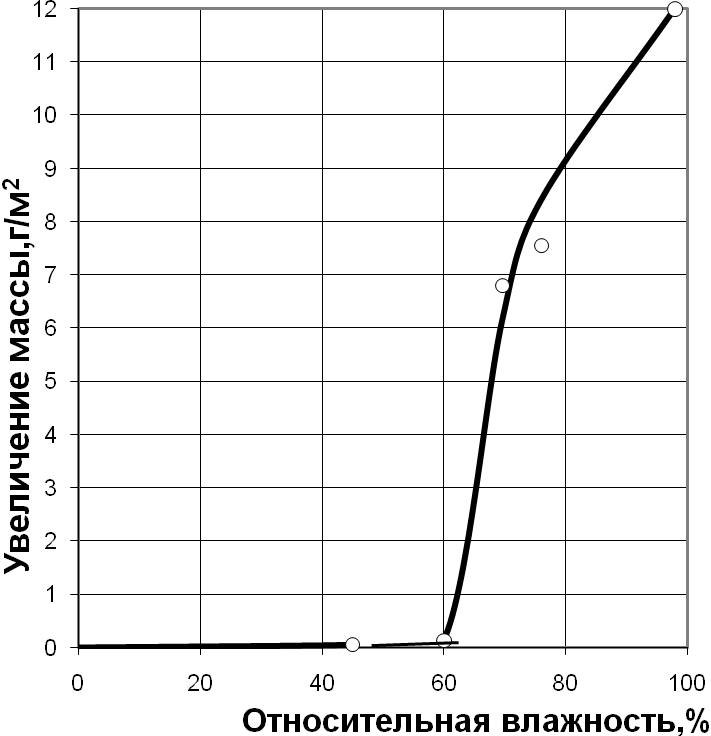 При использовании с Анализатором ИКП (ТУ 3435-008-51996521-2009), значение скорости коррозии отображается в мм/год, глубины коррозии — в мм. Отсчет указанных значений производится с момента установки индикатора.
При использовании с Анализатором ИКП (ТУ 3435-008-51996521-2009), значение скорости коррозии отображается в мм/год, глубины коррозии — в мм. Отсчет указанных значений производится с момента установки индикатора.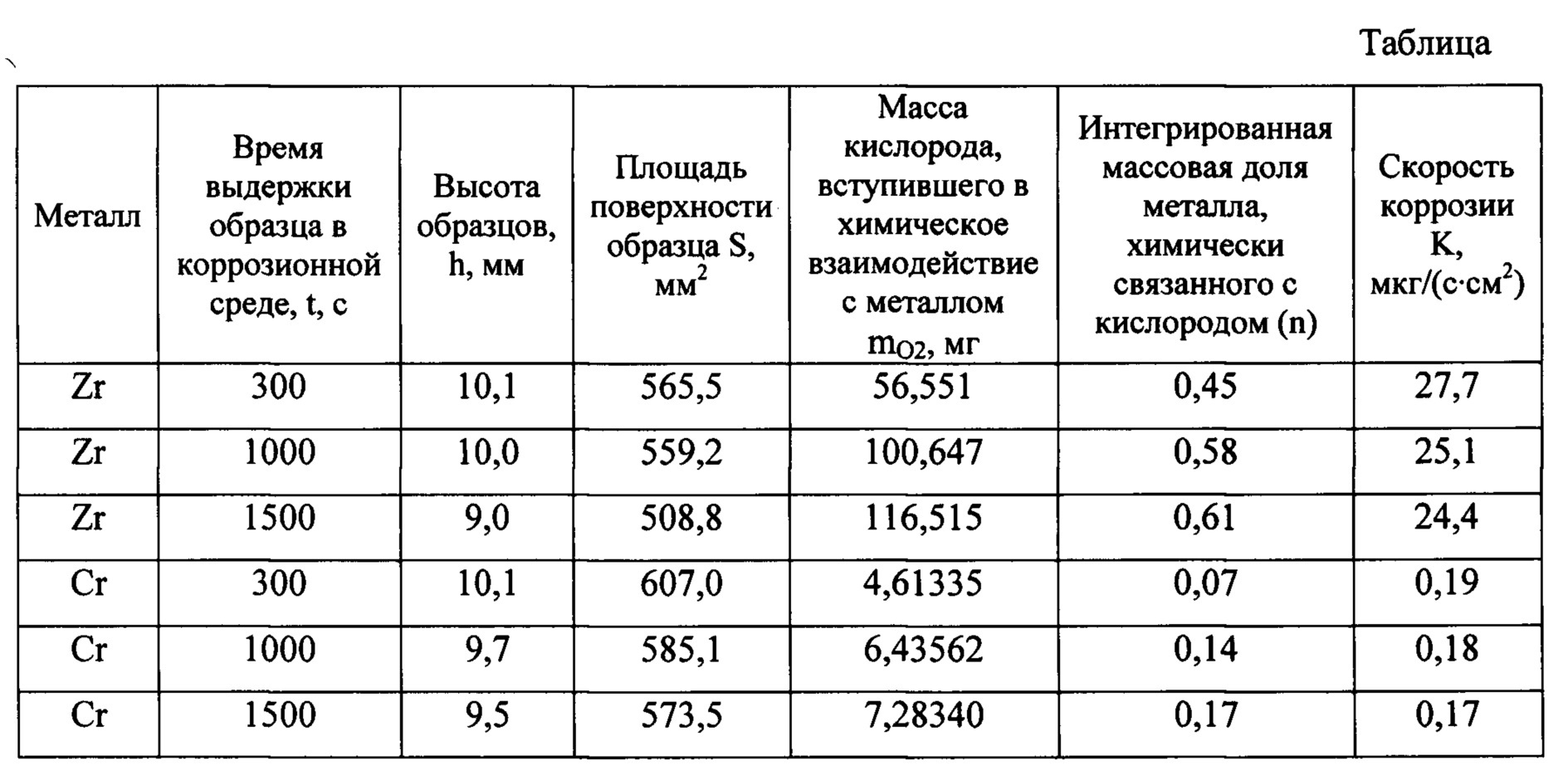
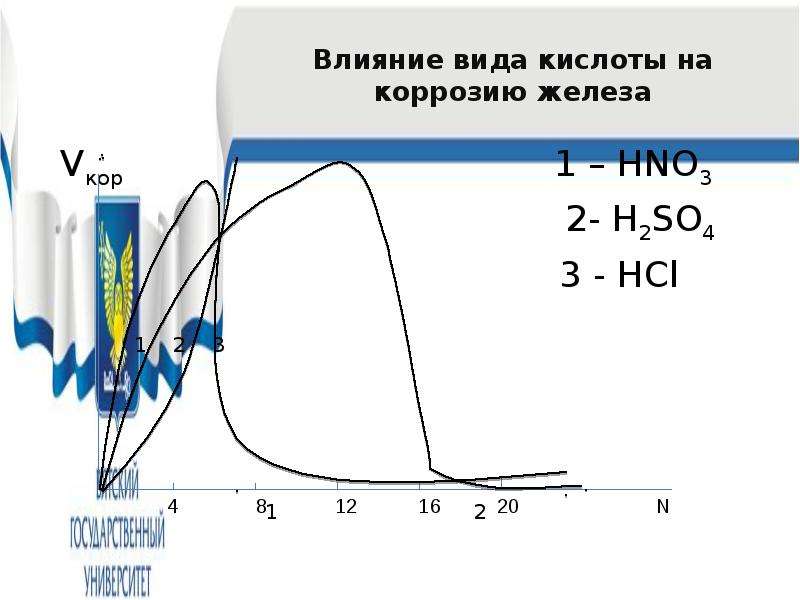 com — Калькулятор скорости коррозии
com — Калькулятор скорости коррозии