Катализатор — все статьи и новости
Катализатор — вещество, которое способствует ускорению химической реакции, однако не входит в состав продуктов этих реакций. С помощью катализатора можно осуществлять быстрые реакции при небольших температурах. Процесс, при котором осуществляется ускорение химических реакций благодаря катализаторам, называется катализ. Этот термин ввел шведский химик Йёнс Якоб Берцелиус в 1835 году. Процесс, при котором катализатором выступает один из продуктов реакции или ее исходных веществ, называют автокатализом.
Катализаторы можно разделить на два типа: гетерогенные и гомогенные. Гомогенные катализаторы находятся в одной фазе с реагирующими веществами. В качестве гомогенных катализаторов используют кислоты и основания. Гетерогенные катализаторы образуют самостоятельную фазу, которая отделена границей раздела от фазы, в которой находятся реагирующие вещества. К гетерогенным катализаторам можно отнести металлы, а также их оксиды и сульфиды.
У всех живых существ метаболизм зависит от биологических катализаторов, которые называются энзимами.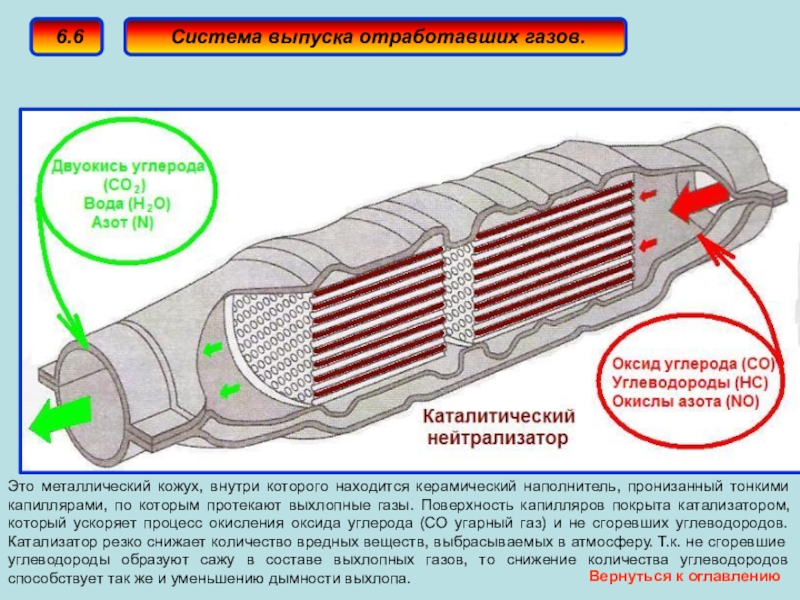 Это молекулы РНК или белковые молекулы, а также их комплексы, которые ускоряют процесс обмена веществ, что является жизненно необходимым для живых организмов.
Это молекулы РНК или белковые молекулы, а также их комплексы, которые ускоряют процесс обмена веществ, что является жизненно необходимым для живых организмов.
На действии катализаторов основываются и многие промышленные процессы. Так, при производстве аммиака в качестве катализатора выступает железо. Катализаторы также широко используются при переработке нефти и создании новых материалов, например пластмассы.
Также катализатором называют деталь выхлопной системы в автомобилях, которая снижает содержание вредных веществ в выхлопных газах. Благодаря такому катализатору происходит химическая реакция, в которой участвуют такие вредные вещества, как окись углерода (CO), углеводород и оксиды азота. В результате реакции образуются оксид углерода (CO₂) и азот (N₂), которые являются менее вредными.
Вещество, которое, наоборот, замедляет реакцию, называют ингибитором.
Фото: Bdyczewski/Pixabay
СОСТАВ И СПОСОБЫ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРА
Ванадиевые катализаторы окисления SO2 производятся и продаются рядом фирм во всем мире. Поэтому активность, срок службы, физические свойства, размеры таблеток, способы приготовления катализаторов и цены на них различаются. Однако химический состав их объема и поверхностного слоя мало отличается для разных образцов. [c.242]
Поэтому активность, срок службы, физические свойства, размеры таблеток, способы приготовления катализаторов и цены на них различаются. Однако химический состав их объема и поверхностного слоя мало отличается для разных образцов. [c.242] Эффективность работы катализатора помимо его химической природы в значительной степени зависит от условий формирования его свойств на равных этапах приготовления, условий эксплуатации, а также конструкции реактора используемые в промышленности способы приготовления катализаторов дегидрирования можно разделить на три основные группы осаждение из растворов солей, пропитка носителей, смешение порошкообразных материалов, причем заключительные стадии — формование и термообработка — могут быть одинаковыми. Фазовый состав катализаторов дегидрирования формируется на основных стадиях приготовления и не претерпевает существенных изменений в процессе эксплуатации катализаторов [11]. Регулирование структуры пор и удельной поверхности осуществляется на разных стадиях приготовления катализатора, эти показатели зависят от дисперсности исходных веществ и условий их термообработки [12, с.
Носителем дегидрирующей функции обычно является металл УН1 группы периодической системы. В качестве дегидрирующего комнонента применяют главным образом платину [12, 36], молибден [61] и никель [13]. Кислотная функция чаще всего присуща носителю, обычно окиси алюминия, которая может быть предварительно подвергнута кислотной обработке. Состав и способ приготовления катализатора, обладающего требуемым оптимальным сочетанием свойств, определяется главным образом характеристиками сырья, которое будет перерабатываться на данной установке. [c.185]
При сильном измельчении, когда размеры частиц начинают приближаться к размерам атомов и молекул, изменяется удельная каталитическая активность катализаторов [10, 25]. Как правило, их удельная активность ниже удельной активности этих компактных веществ [10, с. 79]. При изменении способа приготовления катализатора изменяется не только дисперсность, но и состав катализатора. В зависимости от исходного соединения и типа восстановителя, готовые катализаторы могут содержать водород, серу, фосфор, бор, углерод и другие вещества [10, с. 104]. Платиновые металлы содержат на поверхности примеси углерода, которые удаляются с большим трудом [28, с. 137]. Скелетные катализаторы могут содержать интерметаллиды и оксиды металлов, водород и другие вещества, поэтому удельная активность катализаторов, приготовленных различными способами, может быть различной.
В зависимости от исходного соединения и типа восстановителя, готовые катализаторы могут содержать водород, серу, фосфор, бор, углерод и другие вещества [10, с. 104]. Платиновые металлы содержат на поверхности примеси углерода, которые удаляются с большим трудом [28, с. 137]. Скелетные катализаторы могут содержать интерметаллиды и оксиды металлов, водород и другие вещества, поэтому удельная активность катализаторов, приготовленных различными способами, может быть различной.
Из табл. 24 видно, что изменение природы катализатора и способа его приготовления сильно влияет на величину энергии связи. Для окиси хрома способ приготовления катализатора сравнительно мало сказывается на прочности связи Н—К и сильно на энергиях связи С—К и О—К. В реакциях, где реагирующими атомами будут кислород и углерод, способ приготовления катализатора сильно скажется на величине энергии активации реакции на окиси хрома. Там же, где скорость реакции зависит от связи Н—К, решающую роль будет играть химическая природа катализатора. Химический состав катализатора играет решающую роль в таких каталитических процессах, когда активна вся поверхность катализатора. [c.216]
Химический состав катализатора играет решающую роль в таких каталитических процессах, когда активна вся поверхность катализатора. [c.216]
Анализом продуктов, полученных другими исследователями [21], обнаружено чрезвычайно большое количество вторичных спиртов (табл. 7). Однако в этом случае нет указаний на состав н способы приготовления катализатора, аппаратуру, применявшуюся для синтеза, и концентрацию низших спиртов (метанола, этанола, пропанола). [c.169]
Следует отметить, что состав, а также способ приготовления катализатора, используемого в этом процессе, должны выбираться с учетом характеристики исходного газа и температурного режима. В углеводородной смеси, направляемой на конверсию, могут Находиться метаН, его гомологи и олефины. При конверсии углеводородов возможен их термический распад с выделением углерода. Углерод, откладывающийся на катализаторе, приводит к резкому падению активности последнего.
 Поэтому рассмотрение [c.145]
Поэтому рассмотрение [c.145]Состав и способ приготовления катализатора [c.37]
На выход и качество продуктов крекинга влияют следующие факторы вид сырья, состав и активность катализатора, температура и давление процесса, а также объемная скорость подачи сырья в реактор и продолжительность непрерывного крекинга без регенерации катализатора. При осуществлении каталитического крекинга применяют различные по составу и способу приготовления катализаторы. От качества применяемого катализатора, так же как и от технологического режима процесса крекинга, зависит [c.156]
На выход и качество продуктов крекинга влияют следующие факторы вид сырья, состав и активность катализатора, температура и давление процесса, а также объемная скорость подачи сырья в реактор и продолжительность непрерывного крекинга без регенерации катализатора.
Термодинамический расчет показывает, что дегидрогенизацию бутана следует вести в интервале 525—570°. Данные термодинамического анализа подтверждены результатами многих опытов Н. Д. Зелинского [10]. Температурный оптимум реакции несколько меняется в зависимости от катализатора.
СОСТАВ И СПОСОБЫ ПРИГОТОВЛЕНИЯ КАТАЛИЗАТОРОВ [c.52]
Носители обычно пропитывают раствором соли, содержащим необходимый для катализа металл. Чаще всего применяют соли, анионы которых можно легко удалить при прогреве — нитраты, ацетаты и др. Последующие процессы — сушку, прокаливание, восстановление — проводят на носителе. Недостатком такого способа приготовления катализатора является неравномерность его распределения по поверхности носителя из-за разной доступности пор.
Способы приготовления и составы катализаторов сильно отличались. Синтез велся в одну ступень без циркуляции. Температура синтеза 200° и максимальная 225°, да вление 10 ат, состав синтез-газа 1,25 Нг 1,0 СО с 12% инертных компонентов. Объемная скорость составляла 105—ПО объемов на объем катализатора в час, т. е. была примерно такой же, как и при синтезе над кобальтовым Катализатором. Использованные для испытаний катализаторы могут быть разделены на катализаторы на носителе и на катализаторы без носителя. Катализаторы первого типа аналогичны кобальтовым с той разницей, что на носитель, например кизельгур, наносится вместо кобальта железо. Они имеют значительно меньший насыпной вес, чем катализаторы без носителя.
В связи с этим в настоящей работе рассмотрена возможность создания классификации и номенклатуры катализаторов. В частности, предложено классифицировать катализаторы по способам их приготовления. Предложено также обозначать катализаторы с помощью формул, в которых отражается качественный и количественный состав и основные особенности приготовления катализаторов. Формулу катализатора предложено записывать по определенным правилам, практическое значение которых состоит в том, что они исключают возникающую при этом неопределенность, приводящую к произвольным решениям. [c.54]
Создание новых катализаторов оказалось возможным в результате изучения закономерностей формирования и разрушения фосфатных катализаторов [37—40]. После осаждения компонентов и формования в гранулы эти катализаторы представляют собой рентгеноаморфную массу. В процессе активационной разработки происходит резкое изменение их удельной поверхности, укрупнение пор.
 Фазовый состав при этом практически не изменяется, и катализаторы представляют собой монофазную систему типа твердого раствора замещения. Механическая прочность даже при мягких режимах активационной разработки снижается на порядок. Использование специальных приемов позволило устранить факторы, снижающие прочность гранул, а введение добавок и новый способ приготовления обеспечили высокую активность катализатора.
Фазовый состав при этом практически не изменяется, и катализаторы представляют собой монофазную систему типа твердого раствора замещения. Механическая прочность даже при мягких режимах активационной разработки снижается на порядок. Использование специальных приемов позволило устранить факторы, снижающие прочность гранул, а введение добавок и новый способ приготовления обеспечили высокую активность катализатора. Оптимальный катализатор нельзя получить, изменяя только его состав, так как решающее значение имеет способ приготовления. Медные катализаторы обычно готовят соосаждением металлических компонентов из растворов различных концентраций. Чрезвычайно важно при осаждении поддерживать определенную температуру и значение pH. После сушки и прокаливания отфильтрованного осадка катализатор прессуют, для получения гранул нужного размера. [c.220]
На степень восстановления и величину поверхности металлического никеля влияет способ приготовления, фазовый состав и содержание никеля в катализаторах никель на силикагеле [9]. В образцах, полученных осаждением никеля на гель 5102, никель находится в высокодисперсном состоянии при температурах восстановления 400—500 °С размер кристаллов составляет 1,7—2,2 нм. При повышении температуры до 600 °С размер кристаллов возрастает до 2,5—3,0 нм, однако дисперсность все еще высока. При восстановлении образцов, полученных смешением гидроокисей или пропиткой геля аммиакатом никеля, средний размер кристаллов никеля значительно больше (6,5—7,0 нм при 325—400 °С и при повышении температуры восстановления до 500—600 С он возрастает до 9,5—11,0 нм). [c.29]
В образцах, полученных осаждением никеля на гель 5102, никель находится в высокодисперсном состоянии при температурах восстановления 400—500 °С размер кристаллов составляет 1,7—2,2 нм. При повышении температуры до 600 °С размер кристаллов возрастает до 2,5—3,0 нм, однако дисперсность все еще высока. При восстановлении образцов, полученных смешением гидроокисей или пропиткой геля аммиакатом никеля, средний размер кристаллов никеля значительно больше (6,5—7,0 нм при 325—400 °С и при повышении температуры восстановления до 500—600 С он возрастает до 9,5—11,0 нм). [c.29]
Тип катализатора Способ приготовления Основной состав катализаторов, моль lie i»S f5 О O 6 u S я oS A bu и я а. 2 5 Ся L- x>o U 0 ёФ A о Д о [c.375]
Для получения стабильного автобензина из пироконденсата был разработан другой новый катализатор — ПК-25. Состав и способы приготовления этого катализатора были рассмотрены выше. На установке ЭП-60-2 катализатор ПК-25 проработал свыше 8000 ч в процессе гидростабилизации фракции пироконденсата 30—190 °С в смеси с фракциями С5 и Сд, поступаюш ими [c. 61]
61]
Разработаны рецептура и способы приготовления более совершенных никелевых катализаторов (ГИАП-5, ГИАП-16) для процесса конверсии углеводородных газов в трубчатых печах. Помимо активного компонента (никеля) в состав катализатора входит ряд жароупорных материалов и цемент. [c.157]
Метод является особенно ценным для сопоставительного изучения активности серии образцов алюмосиликатных катализаторов крекинга, отличающихся химическим составом, структурой, способом приготовления и т.д. Однако следует учитывать, что получен -ные в импульсном режиме данные могут относиться к нестационарному сост янию поверхности катализатора. [c.38]
Последующие усовершенствования касались, в основном, способа приготовления катализатора. Так, в патенте [153] рекомендуется — применять в качестве контакта второй секции состав, приготовленный спеканием двух слоев серебра. Верхний слой (высота 10—100 мм) имеет объем пор 75—90%, пористость нижнего слоя (высота 5—20 мм)—65—75%. Также рекомендуется применять сплав серебра с золотом в соотношении А5 Аи = 50 50 и 40 60 при температуре реакции на обеих секциях не выше 600 °С. Максимальное мольное отношение ОаСН3ОН также не превышает 0,5. В этом варианте достигаются следующие показатели конверсия метанола 98,0—98,6%, мольная селективность 88,1—89,6%. В случае проведения процесса с использованием указанного сплава на одной секции конверсия составляла 89,8%, а мольная селективность 91,8%. [c.58]
Также рекомендуется применять сплав серебра с золотом в соотношении А5 Аи = 50 50 и 40 60 при температуре реакции на обеих секциях не выше 600 °С. Максимальное мольное отношение ОаСН3ОН также не превышает 0,5. В этом варианте достигаются следующие показатели конверсия метанола 98,0—98,6%, мольная селективность 88,1—89,6%. В случае проведения процесса с использованием указанного сплава на одной секции конверсия составляла 89,8%, а мольная селективность 91,8%. [c.58]
Проведенные Дануссо и Сианези ([1617] исследования каталитической системы Ti U — А1(С2Н5)з и ее влияния на полимеризацию стирола показали, что способ приготовления катализатора оказывает существенное влияние на процесс полимеризации и на свойства получающегося полимера (стереоизомерный состав, молекулярный вес, растворимость и т. п.). Наилучшая скорость реакции достигается при соотношении алюминий- и титанорганических компонентов катализатора, равном 2,7/4. При этом образуется почти исключительно изотактический полистирол. Показано, что выход изотактического полимера заметно возрастает вплоть до 100 , а выход аморфного резко падает при температуре более низкой. [c.277]
Показано, что выход изотактического полимера заметно возрастает вплоть до 100 , а выход аморфного резко падает при температуре более низкой. [c.277]
Фазовое состояние катализатора не является единственным фактором, определяющим химическую однородность сополимера. На катализаторах, включающих У0С1з или 01, однородные по составу сополимеры могут быть получены, если активные центры в зоне реакции образуются непрерывно и медленно. Это обеспечивается тем, что один из компонентов (или оба) подаются в реактор непрерывно. При таком способе приготовления катализатора, видимо, затрудняется образование высокоорганизованных кристаллов, которые могут образоваться при старении и при быстром смешении концентрированных растворов компонентов катализатора. Широкое распределение по составу сополимеров, полученных на гетерогенных катализаторах, объясняют тем, что на поверхности содержатся различающиеся по активности центры роста. В случае коллоидно-дисперсных катализаторов это подтверждается тем, что сополимеры, синтезированные на свежеприготовленном и подвергнутом старению катализаторах, резко различаются по составу. В таких сополимерах реальное распределение по составу представляет собой суперпозицию многих нормальных распределений. Некоторое влияние на состав сополимеров при сополимеризации на гетерогенных катализаторах может оказывать неодинаковое для обоих сомономеров диффузионное торможение, называемое гель-эффектом Лукача [173]. Появление этого эффекта возможно в том случае, когда скорости диффузии сомономеров через гель сополимера на поверхности частицы существенно различаются. При сополимеризации на гомогенных моноцентровых катализаторах упоминавшиеся факторы не оказывают влияния на состав сополимеров. [c.34]
В таких сополимерах реальное распределение по составу представляет собой суперпозицию многих нормальных распределений. Некоторое влияние на состав сополимеров при сополимеризации на гетерогенных катализаторах может оказывать неодинаковое для обоих сомономеров диффузионное торможение, называемое гель-эффектом Лукача [173]. Появление этого эффекта возможно в том случае, когда скорости диффузии сомономеров через гель сополимера на поверхности частицы существенно различаются. При сополимеризации на гомогенных моноцентровых катализаторах упоминавшиеся факторы не оказывают влияния на состав сополимеров. [c.34]
Алюмохромовые катализаторы, иромотированные ионом калия, имели одинаковый состав (окиси хрома 15, окиси алюминия 82, окись калия Змол. %),несколько отличаясь способом приготовления.Катализаторы 149 и 162 применялись в зернах диаметром 3—5 мм, катализатор 187 в зернах диаметром 0,5—1 и 3—5лш. [c.337]
Нами изучена возможность применения модифицирования для изменения избирательности действия никелевого и кобальтового катализаторов в процессе гидрирования 6-метилгептадиен-3,5-она-2 (диенона). Константы использованных кетонов, состав и способ приготовления катализаторов описаны в [1]. Гидрирование проводили водородом под давлением 50 ат. Катализаты анализировали методом газо-жидкостной хроматографии. [c.202]
Константы использованных кетонов, состав и способ приготовления катализаторов описаны в [1]. Гидрирование проводили водородом под давлением 50 ат. Катализаты анализировали методом газо-жидкостной хроматографии. [c.202]
На качество щелочных алюмооксидных катализаторов синтеза метантиола влияют не только природа активного компонента, но и его содержание на поверхности, а также характеристика носителя — удельная поверхность, пористая структура, фазовый состав, чистота. Хотя обычно упоминают об использовании различных щелочных добавок, на практике, по-видимому, применяют нанесенный на оксид алюминия вольфрамат калия, содержание которого > 10 мае. % [2, 3, 65-67]. Для того, чтобы активный компонент на поверхности был в высокодисперсном состоянии, оксид алюминия должен обладать большой поверхностью — не менее 200 [65-67]. Для уменьшения диффузионных осложнений необходимо наличие в катализаторе значительного количества транспортных пор. Важен также способ приготовления катализатора [1-3]. Активный и селективный алюмокалийвольфрамовый катализатор ИКТ-31-1 для синтеза метантиола из метанола и сероводорода (совместная разработка Института катализа СО РАН и ОАО Катализатор [68]) готовят методами пропитки или смешения [69-72]. Водный раствор щелочного металла наносят в виде аэрозоля на оксидноалюминиевый носитель с удельной поверхностью 300-350 мVг, включающий добавки бора и натрия, с удельным [c.25]
Активный и селективный алюмокалийвольфрамовый катализатор ИКТ-31-1 для синтеза метантиола из метанола и сероводорода (совместная разработка Института катализа СО РАН и ОАО Катализатор [68]) готовят методами пропитки или смешения [69-72]. Водный раствор щелочного металла наносят в виде аэрозоля на оксидноалюминиевый носитель с удельной поверхностью 300-350 мVг, включающий добавки бора и натрия, с удельным [c.25]
Дегидрирование является одной из наименее селективных химических реакций селективность окислительного дегидрирования тоже невелика. Многие реакции термического дегидрирования проводят фактически без катализаторов, тогда как почти во всех реакциях окислительного дегидрирования применяются катализаторы. Может возникнуть впечатление, что если некоторые реакции дегидрирования осуществляются вообще без катализаторов, то ири использовании последних их состав и способы приготовления не играют решающей роли. Но это совсем не так, потому что для обеспечения необходимых превращений и выходов в некоторых процессах окислительного дегидрирования приходится весьма тщательно регулировать степень окисления и иарциальное давление кислорода в системе, а также контролировать состав и методику приготовления катализатора. Хотя вообще реакции дегидрирования не селективны, имеются высокоселективные процессы, для которых следует тщательно соблюдать состав катализаторов и условия их обработки в реакторе, [c.132]
Хотя вообще реакции дегидрирования не селективны, имеются высокоселективные процессы, для которых следует тщательно соблюдать состав катализаторов и условия их обработки в реакторе, [c.132]
Изокрекинг [63], разработанный фирмой Калифорния рисерч , представляет собой нерегенеративный процесс гидрокрекинга, осуществляемый при 200—375° С и давлении 35—105 ат. Срок службы катализатора достигает 6 месяцев и больше, но состав его и способы приготовления не опубликованы. [c.191]
Отдельные образцы серебряного катализатора резко отличаются друг от друга по своим каталитическим свойствам.Рубаник и Гороховатский » установили, что в зависимости от способа приготовления серебряного катализатора различается его удельная активность и селективность. Это объясняется, вероятно, тем, что химический состав поверхности катализатора изменяется вследствие попадания в катализатор в процессе его приготовления различных микропримесей, содержащихся в исходных веществах, в частности галоидов и некоторых элементов V и VI групп периодической системы элементов. После того как образцы катализатора, полученного различными методами, были обработаны водным раствором аммиака (удалены примеси, растворимые в аммиаке), они по активности и селективности стали значительно меньше отличаться друг от друга. [c.223]
После того как образцы катализатора, полученного различными методами, были обработаны водным раствором аммиака (удалены примеси, растворимые в аммиаке), они по активности и селективности стали значительно меньше отличаться друг от друга. [c.223]
Гранулометрический состав. При описании методов приготовления катализаторов в разделе о распылительной сушке были перечислены основные факторы, влияющие на гранулометрический состав цеолитных крекирующих катализаторов. В образце, прошедшем рас-пыЛкИтельную сушку любого типа, распределение частиц по размерам описывается симметричной кривой с максимумом. Однако оптимальное распределение частиц в промышленных установках крекинга нельзя заранее задать какой-то одной кривой, так как оно зависит не только от гранулометрического состава свежего катализатора, но и от конкретных особенностей каждой установки и способа образования кипящего слоя. Поэтому обычно в промышленности катализаторы выпускают с широким фракционным составом. Гранулометрический состав катализаторов определяют разными методами, но наиболее распространен ситовой анализ. Проводится он следующим образом [37]. [c.245]
Гранулометрический состав катализаторов определяют разными методами, но наиболее распространен ситовой анализ. Проводится он следующим образом [37]. [c.245]
Бемит широко распространен в природе, однако для приготовления катализаторов используют более чистый синтетический бемит, который может быть получен различными способами осаждением из растворов солей алшиния основанием или кислотами из алшинатов. Вода, входящая в состав бемита, находится в виде гидрокси 1Ьных групп молекулярная вода не обнаружена. Это дает основание приписать бемиту формулу 0=А1-Ш [Ю]. - [c.3]
Для получения активных катализаторов большое значение имеют способ приготовления и состав сплава. При изготовлении никелевого катализатора практически наиболее приемлемы, по-видимому, сплавы, содержащие от 40 до 60% активного металла. Сплавы, содержащие менее 35% никеля дают быстроутомляющиеся катализаторы и. иовыше-. ние содержания никеля более 60% затрудняет разложение сплава щелочью /12/. [c.24]
Создан новый тип катализаторов для управления продуктами химических реакций
О том, как проходила разработка и какие у неё особенности «Научной России» рассказал один из авторов исследования, заведующий Международной лабораторией нанодиагностики Южного федерального университета Арам Бугаев.
«Конкретно исследование последнего катализатора заняло чуть больше года. Это была долгая непрерывная работа. Палладий – это хорошо известный катализатор. В различных формах он используется во многих реакциях, в промышленном масштабе – в нефтихимии, фармацевтической промышленности. В целом катализаторы различаются на два типа: гомогенные и гетерогенные. В случае гомогенных катализаторы-продукты находятся в одной фазе, например, жидкие продукты и катализатор тоже жидкий. Недостатком тут является то, что сложно отделить потом катализатор, который можно дальше использовать, от продуктов. Особенно важно это для фармацевтической промышленности, когда заявлены высокие требования к чистоте продукта. А гетерогенный катализатор – чаще всего это твердое вещество (порошок или таблетка), а продукты – газообразные или жидкие. Соответственно их легко отделить и катализатор можно использовать несколько раз», – говорит Арам Бугаев.
Заведующий Международной лабораторией нанодиагностики ЮФУ добавил, что новый материал по-настоящему уникальный, ведь он может трансформироваться под любые химические реакции.
«Первое преимущество, которым обладает новый материал, что по своим свойствам и эффективности он напоминает гомогенный катализатор, но при этом в плане практического применения обладает всеми преимуществами гетерогенного катализатора. Это порошок, который можно использовать много раз. Чем он похож на гомогенный? Тем, что все атомы палладия находятся абсолютно в одинаковом состоянии, т.е. какой бы мы не взяли атом палладия, он имеет вокруг себя абсолютно одинаковую атомную структуру», – утверждает Арам Бугаев.
Говоря о преимуществах нового материала, учёный рассказал и о тонкостях всего исследования. Он пояснил, как можно использовать различные продукты для получения интересных экспериментов, и что это главная находка для всех учёных-химиков.
«Новизна этого исследования в том, что в любой реакции мы можем иметь какой-то набор продуктов, он не всегда бывает один. В том классе реакций, что мы исследуем, обычно все продукты образуются с равной долей вероятности, что не совсем хорошо для практического применения, когда нужно получить только один из них. В этом материале атомы палладия, которые и производят продукты, заключены внутри наноразмерных пор, и получается так, что каким-то продуктам легко образовываться внутри этой поры, а каким-то сложно. Т.е. подавляющее большинство продуктов те, молекулы которых подходят по форме пор. Это первый пример в данной области, когда удалось совместить и каталитическую активность палладия, и механические ограничения подложки, где форма пор определяет продукты реакции. Уверен, что в дальнейшем есть большие возможности по поиску более сложных каталитических реакций, где будет большой экономический выигрыш от того, что мы отсекаем все неподходящие по форме продукты. Форму пор также можно варьировать, «играться» с материалами: для экспериментальной работы тут открываются большие перспективы», – добавил Арам Бугаев.
Отметим, что исследование проходило в составе Международной группы учёных из Южного федерального университета и Католического университета Левена (Бельгия) совместно с коллегами из Гентского университета (Бельгия) и Национального института химии Словении. Исследование выполнено в рамках совместного Российско-бельгийского проекта и было опубликовано в журнале Nature Catalysis.
Определение гранулометрического состава продукции АО «СКТБ «Катализатор»
Москва, 23 сен — ИА Neftegaz.RU. Определение гранулометрического состава продукции АО СКТБ Катализатор.Зачем надо знать точные размеры гранул?
Контроль размера получаемых гранул очень важен при производстве порошковых микросферических катализаторов. Особенно остро стоит вопрос для катализаторов кипящего слоя. Гранулометрический (фракционный) состав катализаторов существенно влияет на гидродинамику псевдоожиженного слоя в реакторе. Размер частиц катализатора связан с линейными скоростями газа, которые, в свою очередь, во многом обусловлены геометрическими размерами реактора
Однородность частиц катализатора также влияет на устойчивость режимов взвешивания кипящего слоя в реакторах. Монодисперсные катализаторы предпочтительнее в этом смысле, чем полидисперсные. Пределы существования взвешенного слоя для монодисперсных сферических частиц катализатора соответствуют увеличению линейной скорости от скорости начала взвешивания до уноса в 10-15 раз. Поэтому при обычных рабочих скоростях из слоя уносится только пыль от истирания катализатора. При взвешивании полидисперсного катализатора скорость взвешивания крупных частиц бывает намного больше, чем наиболее мелких, и унос мелкозернистой части катализатора неизбежен.
Оптимальными катализаторами для процесса дегидрирования изобутана в реакторах кипящего слоя, как с точки зрения гидродинамики слоя, так и кинетики процесса дегидрирования являются катализаторы, фракционный состав которых соответствует требуемым линейным скоростям газа и определяется, исходя из индивидуального дизайна блоков дегидрирования (живого сечения решеток, количества подаваемого сырья, диаметра аппарата и т.д.).
Оптимизация размера частиц позволяет предотвратить унос слишком маленьких частиц катализатора с реакционным потоком, а также исключить крупные частицы, не способные к эффективной циркуляции в блоке дегидрирования.
Поэтому для нас постоянный анализ гранулометрического состава является очень важным фактором, качество которого жестко контролируется на разных стадиях производства катализатора дегидрирования изобутана в изобутилен в кипящем слое. Качество катализатора дегидрирования изобутана в изобутилен АОК-73-24Т от партии к партии остается неизменным как по фракционному составу, так и по физико-химическим и каталитическим свойствам. В 2018 году катализатор АОК-73-24Т был удостоен награды лауреата Всероссийского конкурса 100 лучших товаров России.
Определение гранулометрического состава
Анализ гранулометрического состава порошков в АО СКТБ Катализатор проводится с использованием метода лазерной дифракции
В последние годы метод лазерной дифракции стал наиболее распространенным методом определения гранулометрического состава порошков, суспензий, эмульсий и др. материалов, состоящих из мельчайших частиц, как в лабораторных, так и в производственных условиях. Этот метод обладает рядом преимуществ, включая простоту и быстроту измерений, высокую воспроизводимость результатов и широкий динамический диапазон определяемых размеров: от нанометров до миллиметров. В основе метода лежит измерение угловой зависимости интенсивности рассеянного света, при прохождении лазерного луча через диспергированный образец. Крупные частицы рассеивают свет под малыми углами к лазерному пучку, тогда как мелкие частицы под большими углами (рис.2).
Анализ данных угловой зависимости света, рассеянного частицами образца, с использованием определенной модели светорассеяния позволяет получать информацию о распределении частиц по размерам (примеры диаграмм распределения частиц по размерам приведены на рис.3).
Для проведения анализа гранулометрического состава в АО СКТБ Катализатор используется оборудование компании Malvern Panalytical Ltd (UK) одного из флагманов производителей в данной области. В распоряжении аналитического отдела компании находятся анализаторы Mastersizer 2000 и усовершенствованная модель нового поколения Mastersizer 3000, которая отличается быстродействием и расширенным программными возможностями.
Лазерный гранулометр Mastersizer представляет собой универсальный инструментарий для быстрого и точного измерения распределения частиц по размерам. В чрезвычайно компактном корпусе (рис. 3-4) сочетаются исключительные технические характеристики и возможности, простота и высокая точность анализа в широчайшем диапазоне размеров частиц: с сухим диспергатором от 100 нм до 3.5 мм, с гидродиспергатором от 10 нм до 2.1 мм. Высокая надёжность результатов достигается за счёт анализа большого количества частиц в каждом измерении, максимальной автоматизации процесса и исключению влияния оператора. Оборудование линейки Mastersizer также позволяет проводить быстрое и эффективное диспергирование в жидкости, измерение размера частиц хрупких порошков и порошков, склонных к слипанию.
Быстродействие приборов и удобный софт обеспечивает проведение АО СКТБ Катализатор более 1,5 тысяч анализов фракционного состава образцов производства, ОТК и разработчиков.
- Катализ в кипящем слое, под ред. И. П. Мухленова, Л., 1971;
- Промышленное псевдоожижение — Д.Кунии, О Левеншпиль 1976 г;
- Расчеты аппаратов кипящего слоя, под ред. И. П. Мухленова, Б. С. Сажина, В.Ф. Фролова, Л., 1986 и др.
Катализатор — это… Что такое Катализатор?
Схема протекания реакции с катализаторомКатализа́тор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется.
Катализаторы в химии
Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества [1]. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды.
Реакции одного и того же типа могут протекать как с гомогенными, так и с гетерогенными катализаторами. Так, наряду с растворами кислот применяются имеющие кислотные свойства твёрдые Al2O3, TiO2, ThO2, алюмосиликаты, цеолиты. Гетерогенные катализаторы с основными свойствами: CaO, BaO, MgO [1].
Гетерогенные катализаторы имеют, как правило, сильно развитую поверхность, для чего их распределяют на инертном носителе (силикагель, оксид алюминия, активированный уголь и др.).
Для каждого типа реакций эффективны только определённые катализаторы. Кроме уже упомянутых кислотно-основных, существуют катализаторы окисления-восстановления; для них характерно присутствие переходного металла или его соединения (Со+3, V2O5+MoO3). В этом случае катализ осуществляется путём изменения степени окисления переходного металла.
Много реакций осуществлено при помощи катализаторов, которые действуют через координацию реагентов у атома или иона переходного металла (Ti, Rh, Ni). Такой катализ называется координационным.
Если катализатор обладает хиральными свойствами, то из оптически неактивного субстрата получается оптически активный продукт.
В современной науке и технике часто применяют системы из нескольких катализаторов, каждый из которых ускоряет разные стадии реакции [2][3]. Катализатор также может увеличивать скорость одной из стадий каталитического цикла, осуществляемого другим катализатором. Здесь имеет место «катализ катализа», или катализ второго уровня (Имянитов).
В биохимических реакциях роль катализаторов играют ферменты.
Катализаторы следует отличать от инициаторов. Например, перекиси распадаются на свободные радикалы, которые могут инициировать радикальные цепные реакции. Инициаторы расходуются в процессе реакции, поэтому их нельзя считать катализаторами.
Ингибиторы иногда ошибочно считают отрицательными катализаторами. Но ингибиторы, например, цепных радикальных реакций, реагируют со свободными радикалами и, в отличие от катализаторов, не сохраняются. Другие ингибиторы (каталитические яды) связываются с катализатором и его дезактивируют, здесь имеет место подавление катализа, а не отрицательный катализ. Отрицательный катализ в принципе невозможен: он обеспечивал бы для реакции более медленный путь, но реакция, естественно, пойдёт по более быстрому, в данном случае, не катализированному, пути.
Катализаторы в автомобилях
Задачей автомобильного катализатора является снижение количества вредных веществ в выхлопных газах. Среди них:
- окись углерода (СО) — ядовитый газ без цвета и запаха
- углеводороды, также известные как летучие органические соединения — один из главных компонентов смога, образуется за счёт неполного сгорания топлива
- оксиды азота (NO и NO2, которые часто объединяют под обозначением NOx) — также являются компонентом смога, а также кислотных дождей, оказывают влияние на слизистую человека.[4]
Источники
- ↑ 1 2 3 Химическая энциклопедия. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 335, 337. — ISBN 5-85270-035-5.
- ↑ Имянитов Н. С. Системы из нескольких катализаторов в металлокомплексном катализе. // Координационная химия. 1984. — Т. 10. — № 11 — С. 1443—1454. — ISSN 0132-344X.
- ↑ Temkin O.N., Braylovskiy S. M. / The mechanism of catalysis in homogeneous polyfunctional catalytic systems. // Fundamental Research in Homogeneous Catalysis. — Ed. by A.E. Shilov. — New York etc: Gordon and Breach Science Publishers, 1986. — Vol. Two. — P.621- 633.
- ↑ Автомобильный катализатор и его роль в выхлопной системе. AutoRelease.ru. Архивировано из первоисточника 25 августа 2011.
См. также
Ссылки
Каталитический риформинг бензинов, установка и гидроочистка бензиновых фракций
(cправочная информация)
Процесс каталитического риформинга бензиновых фракций (риформинга бензинов) является одним из важнейших процессов современной нефтеперерабатывающей и нефтехимической промышленности. Процесс риформинга предназначен для производства высокооктановых компонентов автомобильных бензинов и для производства легких ароматических углеводородов – бензола, толуола и ксилолов. Весьма важным продуктом процесса риформинга является водородсодержащий газ с высоким содержанием водорода, который используется для гидроочистки широкого ассортимента нефтяных фракций, для процесса гидрокрекинга тяжелых нефтяных фракций и других гидрогенизационных процессов.
Процесс каталитического риформинга является сложным химическим процессом. Это обусловлено, прежде всего, химическим составом исходного сырья процесса – разнообразных бензиновых фракций. В состав так называемой широкой фракции бензина входит более 150 углеводородов. Это углеводороды трех основных групп: парафиновые углеводороды нормального и изостроения, нафтеновые углеводороды с пятичленными и шестичленными циклами с одной или несколькими замещающими алкильными группами и ароматические углеводороды, которые обычно представлены бензолом, толуолом, ксилолами и незначительным количеством более тяжелых алкилбензолов. Среди парафинов преобладают углеводороды нормального строения и монометилзамещенные структуры. Нафтены представлены гомологами циклопентана и циклогексана.
Научные основы процесса каталитического риформинга были подготовлены работами русских учёных. Так ещё в 1911г. Н.Д. Зелинским была показана возможность дегидрогенизации шестичленных нафтеновых углеводородов при температуре выше 300°С над платиновым и палладиевым катализаторами количественно, практически без побочных реакций. В том же году дегидрогенизацию нафтеновых углеводородов при контакте их с оксидом металлов осуществили В.Н. Ипатьев и Н. Довгелевич. В 1936г. в СССР одновременно в трёх лабораториях была открыта реакция непосредственной дегидроциклизации парафиновых углеводородов в ароматические. Б.Л. Молдавский и Г.Д. Камушер в ГИВДс осуществили дегидроциклизацию парафинов на оксиде хрома при температуре 450-470°С. В.И. Каржёв, М.Г. Северьянова и А.Н. Сиова во ВНИГИ наблюдали реакции дегидроциклизации парафинов на меднохромовом катализаторе при температуре 500-550°С. Б.А. Казанский и А.Ф. Платэ в МГУ показали возможность дегидроциклизаци парафиновых углеводородов в присутствии платинированного угля при температуре 300-310°С.
Основой процесса каталитического риформинга бензинов являются реакции, приводящие к образованию ароматических углеводородов. Это реакции дегидрирования шестичленных и дегидроизомеризации пятичленных нафтеновых углеводородов, дегидроциклизация парафиновых углеводородов. Кроме того, второй по значимости в процессе каталитического риформинга является реакция изомеризации углеводородов.
Наряду с изомеризацией пятичленных и шестичленных нафтенов изомеризации подвергаются парафиновые и ароматические углеводороды. Существенную роль в процессе играют реакции гидрокрекинга парафинов, сопровождающиеся газообразованием. При каталитическом риформинге протекают также реакции раскрытия пятичленного кольца нафтенов с образованием соответствующих парафиновых углеводородов.
Типы установок риформинга бензиновых фракций
В настоящее время трудно найти завод, технология переработки нефти на котором не предусматривала бы каталитического риформирования. Развитие процесса каталитического риформинга было обусловлено длительной тенденцией роста октановых чисел товарных бензинов на фоне постепенного отказа от использования тетраэтилсвинца, как октаноповышающей добавки, а также ростом спроса на ароматические углеводороды. Таким образом, каталитический риформинг прочно занял место базового процесса современной нефтепереработки.
Эволюция процесса состояла в увеличении глубины превращения сырья, селективности ароматизации углеводородов и стабильности работы катализаторов. За весь период использования процесса выход ароматических углеводородов и водорода (целевые продукты) увеличился более чем в 1,5 раза, а межрегенерационный цикл работы катализатора — в 4 раза. Эти результаты достигнуты, прежде всего, за счет разработки новых катализаторов, повлекших за собой совершенствование технологии процесса. Сменилось, по меньшей мере, три поколения катализаторов, непременным компонентом которых всегда оставалась платина. Прогресс в технологии процесса выразился в снижении рабочего давления более чем в 10 раз (с 4,0 до 0,35 МПа) и разработке нового типа реакторных устройств непрерывного риформинга (системы CCR).
Технологическое оформление процесса каталитического риформинга определяется по способу проведения регенерации катализатора. Подавляющее большинство установок риформинга описывают тремя разновидностями технологий: полурегенеративный, циклический и процесс с непрерывной регенерацией катализатора. Наибольшее количество установок работает по полурегенеративному варианту. Например, платформинг фирмы ЮОП лицензирован примерно на 600 установках, магнаформинг фирмы Энгельгард осуществляется более чем на 150 установках, процесс ренийформинг фирмы Шеврон используется более чем на 70 установках, наконец, технология Французского института нефти лицензирована более чем на 60 установках мира. В России практически все установки каталитического риформинга (за исключением трех – в Уфе, Нижнем Новгороде и Омске) работают в полурегенеративном варианте.
Технологические параметры работы установок риформинга по полурегенеративному варианту: давление- от 1.3 до 3.0 МПа, температура- от 480 до 530?С, октановое число (ИОЧ) колеблется от 94 до 100, выход риформата от 80 до 88% мас. Межрегенерационный цикл работы катализатора составляет от года до трех лет.
Второй тип технологии – циклический – применяется в основном на заводах США и характеризуется более жесткими условиями проведения процесса (давление 0.9-2.1 МПа, температура 505-550?С) и, как следствие, небольшими межрегенерационными циклами (от 40 до 5 суток). Октановое число риформата (ИОЧ) – от 95 до 103. Катализатор до полной отработки может выдерживать до 600 регенераций. К циклическому варианту относится процесс пауэрформинг фирмы Эксон (около 100 установок) и ультраформинг фирмы Амоко Ойл Ко (~150 установок).
Наконец, третий тип технологии каталитического риформинга представляет собой процесс с непрерывной регенерацией катализатора. Данная технология наиболее прогрессивна, так как позволяет работать в лучших термодинамических условиях (давление – 0.35-0.9 МПа, температура –до 550?С) без остановки на регенерацию (межремонтный пробег установок риформинга достигает 3-х лет и более) и достигнуть максимального октанового числа риформата (ИОЧ=102-104).
Первая установка запущена по лицензии фирмы ЮОП в 1971 году, в 1983году эксплуатировалось 35 установок, а в настоящее время работает 163 установки (в том числе 40 с давлением 0,35 МПа) по лицензии ЮОП и 56 установок по лицензии Французского института нефти.
Классификация промышленных установок риформинга
В России подавляющее большинство установок каталитического риформинга относится к классу полурегенеративного типа. Установки каталитического риформинга состоят из двух блоков. На первой стадии исходное сырье подвергается предварительной гидроочистке бензиновых фракций с целью практически полного удаления присутствующих в нем примесей органических соединений серы, азота, кислорода, хлора и др., являющихся ядами для катализаторов, используемых в процессе каталитического риформинга. На второй стадии гидроочищенное сырье подвергается непосредственно каталитическому риформингу.
Упрощенная принципиальная схема блока каталитического риформинга представлена на рис. 1.
Сырье – стабильный гидрогенизат с блока, где происходит гидроочистка бензиновых фракций поступает на прием сырьевого насоса Н-1, который подает его в тройник смешения на смешение с циркулирующим водородсодержащим газом (ВСГ), поступающим с выкида циркуляционного компрессора ЦК-1. Смесь сырья и ВСГ в теплообменнике Т-1 подогревается газопродуктовым потоком, выходящим из реактора Р-3, подогревается в первой секции печи П-1 и поступает в реактор Р-1, затем подогревается во второй секции П-1, проходит реактор Р-2, затем проходит третью секцию печи П-1 и проходит в реактор Р-3. Газопродуктовая смесь после реактора Р-3 отдает часть своего тепла газосырьевому потоку в теплообменнике Т-1, охлаждается в воздушном холодильнике ВХ-1, в водяном холодильнике Х-1 и поступает в газосепаратор С-1. Здесь происходит отделение водородсодержащего газа от жидкого продукта – нестабильного катализата. Водородсодержащий газ из сепаратора С-1 направляется на удаление избыточной влаги в адсорбер А-1 (или минует его по байпасу) и поступает на прием циркуляционного компрессора ЦК-1, который вновь подает его на смешение с сырьем.
Избыток ВСГ направляется на блок гидроочистки бензиновых фракций или в водородное кольцо завода. Нестабильный катализат из сепаратора С-1 подогревается в теплообменнике Т-2 потоком стабильного катализата и поступает в среднюю часть колонны К-1 на стабилизацию – отделение растворенных в нем газообразных углеводородов. Верхом колонны К-1 выводятся легкие углеводороды до бутанов включительно. Пары охлаждаются и конденсируются в воздушном холодильнике ВХ-2 и водяном холодильнике Х-2 и поступает в емкость орошения Е-1. Жидкий продукт из Е-1 поступает на прием насоса Н-2, который подает его в качестве холодного орошения на верхнюю тарелку колонны К-1. Балансовый избыток выводится на ГФУ или в парк в виде жидкого газа. Несконденсировавшиеся газы из емкости Е-1 сбрасываются в топливную сеть.
Стабильный катализат риформинга выводится снизу колонны К-1, проходит теплообменник Т-2, охлаждается в воздушном холодильнике ВХ-3, водяном холодильнике Х-3 и направляется в парк в качестве готового продукта. Подвод тепла в низ колонны К-1 осуществляется циркуляцией части стабильного катализата через печь П-2 под нижнюю тарелку колонны. Для компенсации уноса части хлора с поверхности катализатора схемой предусмотрена дозированная подача раствора хлорорганического соединения на вход первого либо в каждый из реакторов. Для поддержания водно-хлорного баланса в зоне катализа предусматривается дозированная подача воды в реакторный блок, включая возможность подачи отдельно в каждый реактор.
Для выполнения операции осернения катализатора в пусковой период схемой предусматривается дозированная подача в реакторный блок раствора сероорганического соединения. Схемой предусмотрена также подача в каждый реактор хлорорганического соединения для выполнения операции реактивации катализатора риформинга.
Таблица 2. Установки риформинга для производства бензина (по типовым проектам)
Установки каталитического риформинга, предназначенные для производства компонента автомобильного бензина, состоят из двух основных блоков – блока, где происходит гидроочистка бензиновых фракций и блока риформинга. Исключением является установка Л-35-5/300, которая, являясь первенцем промышленных установок риформинга, первоначально была спроектирована в виде самостоятельного блока каталитического риформинга. Эта установка работает в комплексе с отдельно стоящей типовой установкой гидроочистки Л-24-300.
Таблица 3. Установки каталитического риформинга для производства ароматических углеводородов (по типовым проектам)
Значительно более сложный технологический комплекс представляет собой установка каталитического риформинга, предназначенная для производства ароматических углеводородов. В этот комплекс кроме блока гидроочистки и блока риформинга входит также блок экстракции ароматических углеводородов из катализата риформинга и блок четкой ректификации для разделения ароматического экстракта с получением ароматических углеводородов товарного качества. В табл. 2. представлена краткая характеристика основных типов установок риформинга, предназначенных для производства компонента автомобильного бензина. В табл. 3. представлена краткая характеристика типовых установок риформинга, предназначенных для производства ароматических углеводородов. Представленные данные характеризуют установки по материалам типовых проектов.
Таблица 4. Объем системы установок риформинга
В табл. 4 даны объемы систем блоков гидроочистки и риформинга. Эти данные необходимы для расчетов расхода водородсодержащего газа и технического азота на период пуска установок и регенерации катализатора. Принципиальные технологические схемы блока, где происходит гидроочистка бензиновых фракций и риформинга практически идентичны. Но имеются некоторые отличия, которые заключаются в основном в аппаратурном оформлении отдельных узлов установок, прежде всего, узлов стабилизации нестабильного катализата риформинга. Для установок, предназначенных для производства высокооктанового компонента автобензина характерно увеличение производственной мощности по перерабатываемому сырью с 300 тыс. т/год до 600 тыс. т/год и до 1000 тыс. т/год, что диктовалось необходимостью увеличения производства высокооктановых автомобильных бензинов. Все установки, предназначенные для производства ароматических углеводородов, имели одинаковую производительность – 300 тыс. т/год по сырью. Установки, рассчитанные на переработку высоконафтенистого сырья, имели реакторные узлы, состоящие из четырех реакторов – четырех ступеней реакции. Это установки типа Л-35-12/300, Л-35-12/300А и Л-35-13/300А. Остальные установки этого рода имели реакторные узлы из трех ступеней реакции.
Катализаторы риформинга
В процессе каталитического риформинга используются катализаторы, основой которых является платина, равномерно распределенная на носителе – оксиде алюминия, промотированном хлором (в редких случаях фтором). Природа активной поверхности катализаторов риформинга базируется на модели бифункционального их действия, предложенной в 1953г. Маилсом. Диспергированная на поверхности носителя платина является катализатором реакций гидрирования-дегидрирования, а носитель – галоидированный оксид алюминия – катализатором реакций кислотно-основного типа – изомеризации, циклизации, крекинга.
Новейшими исследованиями, выполненными в последнее время, было обнаружено, что часть высокодисперсной нанесенной на носитель платины по своим физическим, адсорбционным и химическим характеристикам не соответствует характеристикам металлической платины. Эта платина получила название электронодефицитной и обозначается символом Ptσ в отличие от металлической платины, которая обозначается символом Pt?. Характерной особенностью электронодефицитной платины является ее способность образовывать прочную хемосорбционную связь с молекулами воды. По этому признаку все поверхностные атомы платины на катализаторе различаются на два состояния: Pt? и Ptσ. Эта же характерная особенность электронодефицитной платины позволяет оценивать ее количество на поверхности катализатора.
Главной характерной особенностью электронодефицитной платины Ptσ является ее высокая активность в реакции дегидроциклизации парафиновых углеводородов – основополагающей реакции процесса каталитического риформинга бензиновых фракций. Скорость реакции дегидроциклизации парафиновых углеводородов с участием платины Ptσ в десять-пятнадцать раз выше скорости с участием металлической платины Pt?. Электронодефицитная платина Ptσ входит в состав поверхностных комплексов PtClxOyLz, являющихся продуктами сильного взаимодействия предшественника платины с поверхностными группами и дефектами γ- или η-оксидов алюминия,являющегося основным носителем катализаторов риформинга. Характерными признаками состояния Ptσ являются предельная дисперсность, ионные состояния платины, наличие лигандов L, связанных с носителем, отсутствие связи Pt-Pt,высокая устойчивость к спеканию. Установлена линейная зависимость между константой скорости дегидроциклизации парафинового углеводорода и содержанием платины Ptσ в катализаторе, что дает основание отнести Ptσ к активным центрам ароматизации парафинов, обладающих комплексом свойств, обуславливающих высокую активность и селективность действия в сложной реакции дегидроциклизации парафиновых углеводородов.
Разработанные технологии приготовления современных катализаторов риформинга направлены на получение катализаторов с максимальным содержанием электронодефицитной платины Ptσ. Наиболее активные и стабильные современные промышленные катализаторы содержат в своем составе до 55 % Ptσ от общего содержания платины в катализаторе.
Большинство промышленных катализаторов риформинга приготовлено с использованием в качестве носителя γ-Al2O3, обладающей большей термической стабильностью.
Для усиления и регулирования кислотной функции оксид алюминия промотируют галоидом – фтором или хлором. Фторсодержащие катализаторы используются весьма ограниченно, в случаях, когда процесс риформинга осуществляют без предварительной гидроочистки сырья или при высокой влажности. Абсолютное большинство катализаторов риформинга приготовлены на основе хлорированного оксида алюминия. Преимуществом катализаторов, приготовленных на хлорированном оксиде алюминия, является возможность регулирования содержания хлора на поверхности катализаторов, а, следовательно, и уровень их кислотности, непосредственно в условиях эксплуатации. Это объясняется тем, что хлор является подвижным промотором, он слабо связан с поверхностью носителя и легко замещается гидроксилами воды.
Количество хлора на поверхности оксида алюминия определяется равновесием реакции:
Это обстоятельство привело к необходимости во время эксплуатации поддерживать над поверхностью катализатора вполне определенную концентрацию паров воды, при которой в катализаторе содержится оптимальное количество хлора, и которое, как правило, находится в пределах 0,9-1,2 масс. %. Содержание хлора на поверхности катализатора является функцией мольного отношения вода: хлор в зоне реакции, удельной поверхности Al2О3 и прочности удерживания хлора на катализаторе.
Высока роль хлора в создании активной поверхности катализатора, в создании поверхностных комплексов, обеспечивающих стабильную работу катализаторов в жестких условиях процесса. Поверхностные комплексы имеют примерный состав PtσnClxOyLz, где σ=2; n≥1; x+y+z≤4; в качестве лигандов L могут быть ионы S, углеводородные радикалы (влияние реакционной среды).
Наконец, без хлора невозможно восстановление высокой дисперсности платины на носителе в период реактивации платиновых катализаторов.
В настоящее время в промышленной практике используются модифицированные би- и полиметаллические катализаторы риформинга, приготовленные на хлорированном оксиде алюминия, в которых наряду с платиной содержатся другие элементы периодической системы. Модификаторами для катализаторов риформинга являются рений, олово, титан, германий, иридий, свинец, цирконий, марганец.
Основным преимуществом модифицированных полиметаллических катализаторов риформинга является их высокая стабильность, выражающаяся в том, что снижение активности в условиях процесса происходит значительно медленнее, чем у монометаллических платиновых катализаторов.
Поскольку основной причиной дезактивации катализаторов риформинга в цикле реакции является их закоксовывание, повышение стабильности при введении модифицирующих металлов связано с воздействием на процесс коксоотложения. Характер этого воздействия, его механизм зависит от природы применяемого модификатора.
В промышленной практике процесса риформинга наибольшее распространение получили алюмоплатиновые катализаторы, модифицированные рением – платинорениевые катализаторы, в отдельных случаях с добавками третьего компонента.
Информация данного раздела приведена исключительно в справочных целях. Информацию о продукции и услугах ООО «НПП Нефтехим» Вы найдете в разделах Главное меню/Разработки и Услуги.
Химики РУДН разработали новые катализаторы для термокаталитической переработки пластиковых отходов
Химики РУДН синтезировали и исследовали каталитическую активность ванадатов и ванадитов некоторых редкоземельных металлов (РЗМ) в процессах термокаталитической переработки полиолефиновых пластиковых отходов. Оказалось, что применение катализатора значительно увеличивает количество и меняет состав образующихся газов, которые выделяются в ходе пиролиза. При этом выбор катализатора позволяет с высоким выходом получать легкие олефины (этилен, пропилен, бутилен и др.) либо кардинально изменять природу образующихся конечных продуктов (синтез-газ). Результаты исследований могут быть использованы для создания современных технологий переработки полимерных отходов с целью получения важных продуктов и полупродуктов для химического и нефтехимического синтеза.
Вопросы обращения с пластиковыми отходами одни из самых актуальных в современной науке и технологии. При этом сжигание и захоронение пластиковых отходов не являются эффективными методами их переработки. Например, в результате сжигания полимерных отходов может быть получено полезное тепло, но при этом полностью уничтожаются органические составляющие, которые могли быть более эффективно использованы при реализации термокаталитических технологий. Действительно, разложение пластика в присутствии определенных катализаторов без кислорода при умеренной температуре и давлении способно дать значительное количество газообразных и жидких продуктов, которые могут быть применены в качестве исходного сырья для синтеза химической продукции или моторного топлива. Химики РУДН экспериментально выяснили, что использование ванадатов и ванадитов редкоземельных металлов в качестве катализаторов значительно увеличивает выход легких олефинов, а также способно кардинально менять состав конечных продуктов переработки.
«Большинство пластмасс не поддаются биологическому разложению. Поэтому для переработки пластиковых отходов необходимо внедрять новые технологии, снижающие их негативное воздействие на окружающую среду. Один из вариантов полезного использования пластиковых отходов может быть достигнут за счет применения термокаталитических технологий. Мы активно занимаемся синтезом новых катализаторов на основе различных соединений редкоземельных металлов и вопросами их практического использования с целью увеличения эффективности переработки полимерных отходов в полезные химические продукты. Полученный нами результат свидетельствует о возможности реализации этой стратегии», — рассказал руководитель проекта, доктор химических наук Александр Чередниченко, заведующий кафедрой физической и коллоидной химии РУДН.
В эксперименте химики РУДН исследовали четыре типа наиболее известных пластиковых отходов: полиэтилен (ПЭ), полипропилен (ПП), полиэтилентерефталат (ПЭТ) и поливинилхлорид (ПВХ). Эти полимерные материалы часто используются для изготовления продукции промышленного и бытового назначения. В ходе эксперимента предварительно измельченный пластик загружали в кварцевый реактор вместе с катализатором и нагревали в потоке азота, постепенно поднимая температуру с 25 °С до 750 °С. Образующиеся в ходе реакции продукты анализировали и сравнили с аналогичными результатами для пиролиза без катализатора.
Оказалось, что применение ванадатов и ванадитов редкоземельных металлов меняет состав газовых отходов пиролиза. Например, без катализатора при пиролизе полиэтилена выделяется около 5% пропилена, а при термокаталитическом процессе — до 15%. Пиролиз ПЭТ без катализатора дает около 75% ацетальдегида. В присутствии определенных катализаторов состав конечных продуктов синтеза кардинально меняется и основным продуктом реакции становится синтез-газ (смесь водорода и монооксида углерода). Синтез-газ, в свою очередь, может быть использован для получения разнообразной химической продукции или водорода для энергетики. Таким образом, в ряду синтезированных катализаторов появляется возможность регулировать состав продуктов пиролиза различных пластиковых отходов.
«Результаты наших исследований с использованием ванадатов и ванадитов редкоземельных металлов дают возможность управлять термокаталитическими процессами переработки пластиковых отходов и получать важные химические продукты», — прокомментировала кандидат химических наук Екатерина Маркова, доцент кафедры физической и коллоидной химии РУДН.
Результаты исследования опубликованы в журнале Catalysis Today.
Влияние состава катализатора и конфигурации реактора на окисление бензола в комбинированном реакторе нетепловой плазмы и катализатора
https://doi.org/10.1016/j.cattod.2018.07.055Получить права и содержаниеОсновные моменты
- •
загрузка оксидов металлов в реактор с поверхностным разрядом способствовала окислению бензола.
- •
Оксиды марганца, нанесенные на цеолит Y, показали наибольшую активность при плазменном облучении.
- •
Катализатор внутри разрядного реактора может использовать не только озон, но и короткоживущие частицы.
- •
Циклы предварительной абсорбции бензола и постплазменного облучения эффективны для подавления CO.
Реферат
Система плазменного катализа, включающая реактор с поверхностным разрядом (SDR) и катализаторы, была сконструирована и испытана для разложения бензола. При окислении бензола с SDR конверсия бензола и количество образующегося COx монотонно возрастали с увеличением подводимой энергии, но поведение разложения бензола не было связано с образованием озона.Загрузка оксидов металлов, Al 2 O 3 , TiO 2 и CeO 2 в SDR в значительной степени способствовала окислению бензола и образованию CO 2 . Наибольшая активность была получена у оксидов марганца, диспергированных на ультрастабильном цеолите Y (Mn / USY). В диапазоне низкой входной мощности количество образующегося озона увеличивается с входящей мощностью, и озон может эффективно потребляться при окислении бензола путем загрузки катализатора Mn / USY во второй части SDR. В более высоком диапазоне мощности, где количество озона уменьшалось с увеличением мощности, загрузка катализатора Mn / USY внутри реактора была более эффективной, поскольку для окисления бензола использовались не только озон, но и короткоживущие частицы, образующиеся в SDR.Добавление водяного пара к реакционному газу не влияло на конверсию бензола и образование COx с каталитической системой SDR-Mn / USY. Предварительно адсорбированный бензол на катализаторе Mn / USY может быть окислен до CO 2 с высокой селективностью по сравнению с гомогенным окислением бензола в SDR.
Ключевые слова
Реактор с поверхностным разрядом
Озон
Бензол
Полное окисление
Рекомендуемые статьи Цитирующие статьи (0)
Полный текст© 2018 Опубликовано Elsevier B.V.
Рекомендуемые статьи
Цитирование статей
Произошла ошибка при настройке вашего пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, нажмите кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файлах cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Анализ состава катализатора in situ во время выращивания нанопроволок GaAs, катализируемого золотом.
Guo, Y. N. et al. Структурные характеристики нанопроволочных гетероструктур GaSb / GaAs, выращенных методом химического осаждения из газовой фазы. Заявл. Phys. Lett. 89 , 231917 (2006).
ADS Google ученый
Larsson, M. W. et al. Картирование деформаций в отдельно стоящих гетероструктурных нанопроволоках InAs / InP вюрцита. Нанотехнологии 18 , 015504 (2006).
ADS Google ученый
Caroff, P. et al. Нанопроволоки с гетероструктурой InSb: рост MOVPE при экстремальном рассогласовании решеток. Нанотехнологии 20 , 495606 (2009).
PubMed PubMed Central Google ученый
Persson, A. I. et al. Твердофазный диффузионный механизм роста нанопроволок GaAs. Nat. Матер. 3 , 677–681 (2004).
ADS CAS PubMed PubMed Central Google ученый
Jacobs, B. W. et al. Электронные и структурные характеристики двухфазных гомоструктурных нанопроволок GaN с вюрцитом цинковой обманки. Nano Lett. 7 , 1435–1438 (2007).
ADS CAS PubMed PubMed Central Google ученый
Джойс, Х. Дж., Вонг-Леунг, Дж., Гао, К., Тан, Х. Х. и Джагадиш, К. Фазовое совершенство нанопроволок цинковой обманки и вюрцита III-V с использованием основных параметров роста. Nano Lett. 10 , 908 (2010).
ADS CAS PubMed PubMed Central Google ученый
Dick, K. A. et al. Управление кристаллической структурой нанопроволок III-V путем настройки параметров роста. Semiconductor Sci. Technol. 25 , 024009 (2010).
ADS Google ученый
Sukrittanon, S. et al. Рост и характеристика разбавленного нитрида GaN x P 1- x нанопроволок и GaN x P 1- x / GaN y P 1- y нанопроволоки ядро / оболочка на Si (111) методом молекулярно-лучевой эпитаксии из газового источника. Заявл. Phys. Lett. 105 , 072107 (2014).
ADS Google ученый
Намази, Л., Галаместани, С.Г., Леманн, С., Замани, Р.Р. и Дик, К.А. Прямое зародышеобразование, морфология и настройка состава InAs 1- x Sb x нанопроволоки на подложках InAs (111) B. Нанотехнологии 28 , 165601 (2017).
ADS Google ученый
Дубровский В.Г. Уточнение теории зародышеобразования парожидкостных твердых нанопроволок. Кристалл. Рост Des. 17 , 2589–2593 (2017).
CAS Google ученый
Шварц, К. В. и Терсофф, Дж. Элементарные процессы в росте нанопроволоки. Nano Lett. 11 , 316–320 (2011).
ADS CAS Google ученый
Небольсин В.А., Щетинин А.А. Роль поверхностной энергии в росте кремния пар – жидкость – твердое тело. Inorg. Матер. 39 , 899–903 (2003).
Google ученый
Krogstrup, P. et al. Успехи теории динамики роста нанопроволок III-V. J. Phys. D: Прил. Phys. 46 , 313001 (2013).
Google ученый
Глас, Ф. Химические потенциалы роста нанопроволок III-V с помощью золота из пара, жидкости и твердого тела. J. Appl. Phys. 108 , 073506 (2010).
ADS Google ученый
Дубровский В.Г. Чувствительный рост пар-жидкость-твердое тело V группы катализируемых Au и самокатализируемых нанопроволок III-V. J. Cryst. Рост 440 , 62–68 (2016).
ADS CAS Google ученый
Plante, M.C. & LaPierre, R.R. Аналитическое описание роста нанопроволок III-V с помощью металла: осевой и радиальный рост. J. Appl. Phys. 105 , 114304 (2009).
ADS Google ученый
Рамдани, М. Р., Харманд, Дж. К., Глас, Ф., Патриарх, Г. и Трэверс, Л. Пути мышьяка в самокатализирующемся росте нанопроволок GaAs. Кристалл. Рост Des. 13 , 91–96 (2013).
CAS Google ученый
Дубровский В.Г. и др. Контролируемый диффузией рост полупроводниковых нанопроволок: давление пара по сравнению с осаждением в высоком вакууме. Surf. Sci. 601 , 4395–4401 (2007).
ADS CAS Google ученый
Glas, F., Harmand, J. C. & Patriarche, G. Почему вюрцит образуется в нанопроволоках полупроводников из цинковой обманки III-V групп? Phys.Rev. Lett. 99 , 146101 (2007).
ADS Google ученый
Дубровский В.Г., Сибирев Н.В., Харманд Дж. К. и Глас Ф. Кинетика роста и кристаллическая структура полупроводниковых нанопроволок. Phys. Ред. B 78 , 235301 (2008).
ADS Google ученый
Йоханссон, Дж., Занолли, З. и Дик, К. А. Политипная достижимость в полупроводниковых нанопроводах III-V. Кристалл. рост Des. 16 , 371–379 (2015).
Google ученый
Торнберг, М., Дик, К. А. и Леманн, С. Термодинамическая стабильность роста нанопроволок InAs с использованием золота. J. Phys. Chem. С 121 , 21678–21684 (2017).
CAS Google ученый
Panciera, F. et al. Контроль роста нанопроволок за счет деформации капли катализатора под действием электрического поля. Nat. Commun. 7 , 12271 (2016).
ADS CAS PubMed PubMed Central Google ученый
Дубровский В.Г. Моно- и полинуклеация, атомистический рост и кристаллическая фаза нанопроволок III-V при изменении потока V группы. J. Chem. Phys. 142 , 204702 (2015).
ADS CAS Google ученый
Krogstrup, P. et al. Влияние формы жидкой фазы на структуру нанопроволок III-V. Phys. Rev. Lett. 106 , 125505 (2011).
ADS Google ученый
Algra, R.E. et al. Формирование нанопроволок InP вюрцита объясняется жидкостным упорядочением. Nano Lett. 11 , 44–48 (2011).
ADS CAS Google ученый
Дубровский В.Г., Сибирев Н.В. Общий вид зависимостей скорости роста нанопроволоки от радиуса нанопроволоки. J. Cryst. рост 304 , 504–513 (2007).
ADS CAS Google ученый
Fröberg, L.E., Seifert, W. & Johansson, J. Скорость роста нанопроволок InAs, зависящая от диаметра. Phys. Ред. B 76 , 153401 (2007).
ADS Google ученый
Li, N., Li, W., Liu, L. & Tan, T. Y. Модель зародышеобразования-роста нанопроволок, полученных с помощью процесса пар-жидкость-твердое тело. J. Appl. Phys. 114 , 064302 (2013).
ADS Google ученый
Боргстрём, М. Т., Имминк, Г., Кетелаарс, Б., Алгра, Р. и Баккерс, Э. П. А. М. Синергетический рост нанопроволоки. Nat. Nanotechnol. 2 , 541 (2007).
ADS PubMed PubMed Central Google ученый
Ли А., Сибирев Н. В., Эрколани Д., Дубровский В. Г., Сорба Л. Рост массивов гетероструктурных нанопроволок InAs / InSb с помощью реадсорбции. Кристалл. Рост Des. 13 , 878–882 (2013).
CAS Google ученый
Борг, Б. М., Йоханссон, Дж., Сторм, К. и Депперт, К. Геометрическая модель газофазной эпитаксии металлоорганических соединений плотных массивов нанопроволок. J. Cryst. Рост 366 , 15–19 (2013).
ADS Google ученый
Эк, М. и Филлер, М. А. Хореография роста нанопроволок пар-жидкость-твердое тело в атомном масштабе. В соотв. Chem. Res. 51 , 118–126 (2018).
CAS Google ученый
Киркхэм, М., Ван, З. Л. и Снайдер, Р. Л. Отслеживание процесса катализируемого роста нанопроволок с помощью дифракции рентгеновских лучей in situ. Дж.Прил. Phys. 108 , 014304 (2010).
ADS Google ученый
Schroth, P. et al. Эволюция политипизма в нанопроволоках GaAs во время роста, обнаруженная с помощью дифракции рентгеновских лучей in situ с временным разрешением. Phys. Rev. Lett. 114 , 055504 (2015).
ADS Google ученый
Krogstrup, P. et al. Рентгеновские исследования in situ образования вюрцита в нанопроволоках GaAs. Заявл. Phys. Lett. 100 , 093103 (2012).
ADS Google ученый
Сиварам, С. В., Хуэй, Х. Й., де ла Мата, М., Арбиол, Дж. И Филлер, М. А. Поверхностный водород обеспечивает субэвтектический рост полупроводниковых нанопроволок пар – жидкость – твердое тело. Nano Lett. 16 , 6717–6723 (2016).
ADS CAS Google ученый
Сиварам, С. В., Шин, Н., Чоу, Л. В. и Филлер, М. А. Прямое наблюдение переходных поверхностных частиц во время роста нанопроволок Ge и их влияние на стабильность роста. J. Am. Chem. Soc. 137 , 9861–9869 (2015).
CAS Google ученый
Шин, Н., Чи, М. и Филлер, М. А. Взаимодействие между распространением дефектов и поверхностным водородом в сверхструктурах с перегибами кремниевых нанопроволок. ACS nano 8 , 3829–3835 (2014).
CAS PubMed PubMed Central Google ученый
Чернычева М., Харманд Дж. К., Патриарх Г., Траверс Л. и Цирлин Г. Е. Температурные условия формирования нанопроволок GaAs методом молекулярно-лучевой эпитаксии с использованием Au. Нанотехнологии 17 , 4025–4030 (2006).
ADS CAS Google ученый
Xu, T. et al.Огранка, состав и эволюция кристаллической фазы в гетероструктурах антимонидных нанопроволок III-V, выявленные с помощью комбинирования методов микроскопии. Нанотехнологии 23 , 095702 (2012).
ADS Google ученый
Джо, Дж., Чоэ, Й., Йи, Г. С. и Ким, М. Определение характеристик в реальном времени с использованием режима передачи ДБЭ на месте и ПЭМ для исследования поведения роста наноматериалов. Sci. Rep. 8 , 1694 (2018).
ADS PubMed PubMed Central Google ученый
Хеурлин, М., Антту, Н., Камю, К., Самуэльсон, Л. и Боргстрём, М. Т. Определение размеров нанопроволоки и динамики роста на месте с помощью оптического отражения. Nano Lett. 15 , 3597–3602 (2015).
ADS CAS Google ученый
Клемент, Т., Ингол, С., Кетхаранатан, С., Друкер, Дж. И Пикро, С. Т. Исследования роста полупроводниковых нанопроволок in situ с использованием оптической рефлектометрии. Заявл. Phys. Lett. 89 , 163125 (2006).
ADS Google ученый
Fernández-Garrido, S., Zettler, JK, Geelhaar, L. & Brandt, O. Мониторинг образования нанопроволок с помощью квадрупольной масс-спектрометрии прямой видимости: всестороннее описание временной эволюции гана. ансамбли из нанопроводов. Nano Lett. 15 , 1930–1937 (2015).
ADS Google ученый
Колибал, М., Пейчал, Т., Виставел, Т. и Сикола, Т. Синергетический эффект адсорбции атомарного водорода и растекания катализатора на ориентацию роста нанопроволок Ge и изгиб. Nano Lett. 16 , 4880–4886 (2016).
ADS Google ученый
Кодамбака, С., Терсофф, Дж., Рейтер, М. К. и Росс, Ф. М. Рост нанопроволоки германия при температуре ниже эвтектической температуры. Наука 316 , 729–732 (2007).
ADS CAS Google ученый
Hofmann, S. et al. Динамика границы раздела катализатора, контролируемая выступом и потоком, во время роста нанопроволок Si. Nat. Матер. 7 , 372–375 (2008).
ADS CAS Google ученый
Wen, C.-Y. и другие. Периодически меняющаяся морфология границы роста в нанопроволоках Si, Ge и GaP. Phys. Rev. Lett. 107 , 025503 (2011).
ADS Google ученый
Гамальский, А. Д., Дукати, К. и Хофманн, С. Циклическое пересыщение и динамика трехфазной границы при росте германиевых нанопроволок. J. Phys. Chem. С. 115 , 4413–4417 (2011).
CAS Google ученый
Chou, Y.-C. и другие. Изменчивость на атомном уровне и контроль кинетики роста нанопроволок III-V. Наука 343 , 281–284 (2014).
ADS CAS Google ученый
Jacobsson, D. et al. Динамика границ раздела и переключение кристаллической фазы в нанопроволоках GaAs. Nature 531 , 317–322 (2016).
ADS CAS PubMed PubMed Central Google ученый
Harmand, J.C. et al. Атомный ступенчатый поток на нанофасете. Phys. Rev. Lett. 121 , 166101 (2018).
ADS CAS Google ученый
Гамальский, А. Д., Терсофф, Дж. И Стах, Е. А. Атомное разрешение in situ визуализации двухслойного многоступенчатого режима роста в нанопроволоках нитрида галлия. Nano Lett. 16 , 2283–2288 (2016).
ADS CAS Google ученый
Дубровский В.Г., Соколова З.В., Рылкова М.В., Жиглинский А.А. Состав и угол смачивания капель Au-III-V поверх нанопроволок III-V, катализируемых золотом. Mater. Phys. Мех. 36 , 1–7 (2018).
Google ученый
Дубровский, В. Г., Греценков, Ю. Зельдович Скорость зародышеобразования, перенормировка самосогласования и кристаллическая фаза нанопроволок GaAs, катализируемых Au. Кристалл. Рост Des. 15 , 340–347 (2015).
CAS Google ученый
Дубровский В.Г. Влияние элемента V группы на химический потенциал и кристаллическую структуру нанопроволок III-V, катализируемых Au. Заявл. Phys. Lett. 104 , 053110 (2014).
ADS Google ученый
Лещенко Е.Д., Гасеми М., Дубровский В.Г.И Йоханссон, Дж. Состав с ограничением зародышеобразования тройных нанопроволок III-V, формируемых из жидких сплавов на основе четвертичного золота. CrystEngComm 20 , 1649–1655 (2018).
CAS Google ученый
Harmand, J. C. et al. Анализ механизма пар-жидкость-твердое тело в росте нанопроволок GaAs с помощью Au. Заявл. Phys. Lett. 87 , 203101 (2005).
ADS Google ученый
Якобссон, Д., Леманн, С. и Дик, К. А. Улучшение границы раздела цинковая обманка и вюрцит за счет загрузки группы III в нанопроводах GaAs с затравками из золота. Phys. status solidi (RRL) Rapid Res. Lett. 7 , 855–859 (2013).
ADS CAS Google ученый
Терсофф, Дж. Стабильный автокаталитический рост нанопроволок III-V. Nano Lett. 15 , 6609–6613 (2015).
ADS CAS Google ученый
Тизей, Л. Х. Г., Кьярамонте, Т., Угарте, Д. и Котта, М. А. Рост полупроводниковых нанопроволок III-V: диффундирует ли мышьяк через катализатор в виде металлических наночастиц. Нанотехнологии 20 , 275604 (2009).
CAS Google ученый
Glas, F., Ramdani, M. R., Patriarche, G. & Harmand, J. C. Прогностическое моделирование самокаталитического роста нанопроволок III-V. Phys. Ред. B 88 , 195304 (2013).
ADS Google ученый
Мартенсон, Э. К., Леманн, С., Дик, К. А. и Йоханссон, Дж. Моделирование роста нанопроволок GaAs и кристаллической структуры. Nano Lett. 19 , 1197–1203 (2019).
ADS Google ученый
Chatillon, C., Hodaj, F. & Pisch, A. Термодинамика роста МЛЭ GaAs нанопроволоки с золотыми каплями. Дж.Cryst. Рост 311 , 3598–3608 (2009).
ADS CAS Google ученый
Гасеми М. и Йоханссон Дж. Фазовые диаграммы для понимания роста нанопроволок GaAs и InAs с использованием золота. J. Phys. D: Прил. Phys. 50 , 134002 (2017).
ADS Google ученый
Maliakkal, C. B. et al. Ступенчатый рост слоев нанопроволок III-V.Препринт: https://arxiv.org/abs/1905.08225 (2019).
Tornberg, M. et al. Кинетика разложения нанопроволок GaAs при помощи капель Au – Ga. Nano Lett. 19 , 3498–3504 (2019).
ADS CAS Google ученый
Леманн, С., Якобссон, Д. и Дик, К. А. Контроль кристаллической фазы в нанопроволоках GaAs: противоположные тенденции в режимах роста, ограниченного Ga и As. Нанотехнологии 26 , 301001 (2015).
Google ученый
Dheeraj, D. L. et al. Управление кристаллическими фазами в нанопроволоках GaAs, выращенных методом молекулярно-лучевой эпитаксии с использованием Au. Нанотехнологии 24 , 015601 (2012).
ADS PubMed PubMed Central Google ученый
Дубровский В.Г., Соколова З.В., Рылкова М.В., Жиглинский А.А. Состав и угол смачивания капель Au-III-V поверх нанопроволок Au-C III-V. Mater. Phys. Мех. 36 , 1–7 (2018).
Google ученый
Характеристика и анализ каталитического материала
Malvern Panalytical предлагает ряд дополнительных решений для физического, структурного и элементного анализа материалов катализатора, включая размер частиц, форму частиц, дзета-потенциал, элементный состав и кристаллическую структуру:
X -лучевая флуоресценция
Рентгеновская флуоресценция (XRF) широко используется для анализа элементного состава ряда катализаторов благодаря своей высокой точности и воспроизводимости.Примеры включают Pt, Pd и Rh в каталитических конвертерах; Al, Ni, V, Ti, Fe и S в каталитических процессах FCC; и отношения Si / Al в цеолитах. XRF также можно использовать для обнаружения присутствия и концентрации каталитических ядов, вызывающих химическую дезактивацию, включая Cl, S, Sn и Pb. XRF-анализ может сэкономить много времени и денег по сравнению с альтернативными методами, и Malvern Panalytical предлагает три основных решения: настольные системы EDXRF, такие как Epsilon 4, напольные системы WDXRF, такие как Zetium, и онлайн-решения, такие как Epsilon XFlow.Malvern Panalytical также предлагает несколько решений для подготовки проб для XRF, ICP и AA через свой портфель Claisse.
Дифракция рентгеновских лучей
Рентгеновская дифракция (XRD) является фундаментальным инструментом для проектирования, разработки и производства катализаторов, поскольку она может предоставить информацию об объемной структуре и составе твердых материалов катализаторов, таких как оксиды металлов и цеолиты. Системы XRD обычно используются для мониторинга производства катализаторов FCC, в частности, для анализа размера элементарной ячейки и кристалличности.XRD также можно использовать для определения размера кристаллов либо путем анализа ширины пиков при типичном дифракционном измерении, либо с помощью малоуглового рассеяния рентгеновских лучей (SAXS). Некристаллические материалы также можно изучать с помощью анализа распределения пар (PDF). Malvern Panalytical предлагает два основных решения XRD: настольный дифрактометр Aeris для рутинного анализа и многоцелевой дифрактометр Empyrean для более детального структурного анализа.
Лазерная дифракция
Лазерная дифракция — это широко используемый метод определения размера частиц для материалов размером от сотен нанометров до нескольких миллиметров, который может применяться к влажным или сухим дисперсиям в лаборатории или на технологической линии.Для применения в катализаторах данные о размере частиц, полученные с помощью лазерной дифракции, можно использовать для расчета удельной площади поверхности (SSA) путем преобразования сообщенного распределения объема в распределение площади поверхности. Титрование под давлением также может помочь понять риск истирания, важный фактор для прогнозирования срока службы катализаторов в реакторах с псевдоожиженным слоем. Mastersizer 3000 от Malvern Panalytical является наиболее широко используемым инструментом для определения размера частиц для анализа катализаторов в лабораторных условиях, в то время как Insitec можно использовать для анализа в реальном времени в производственных условиях.
Прочие технологии
В дополнение к методам, упомянутым выше, Malvern Panalytical предлагает несколько других решений для анализа катализаторов, включая Zetasizer, который используется для оценки размера и стабильности дисперсий твердых частиц, и Morphologi 4, который использует анализ изображений для определения частиц. форма и распределение по размерам. Morphologi 4 также доступен со встроенным рамановским спектрометром, который предоставляет химическую информацию для конкретных частиц.
Зарождение и рост углеродных нанотрубок в зависимости от состава катализатора
Аннотация
Зарождение и рост углеродных нанотрубок (УНТ) происходит по механизму пар-жидкость-твердое тело (VLS) и был исследован с акцентом на разновидности катализатора, используемые для инициирования зародышеобразования и поддержания роста. Определенные тенденции в плотности роста, диаметре, длине и скорости роста наблюдались при изменении таких характеристик, как источник катализатора, концентрация и элементный состав.Изученные каталитические системы включают нанокластеры [H xPMo12O40 & sub; h5Mo72Fe 30 (O2CMe) 15O254 (h3O) 98] (FeMoC), спиновые катализаторы и дискретные биметаллические наночастицы. Объединение каталитических свойств отдельных элементов в биметаллические комбинации оказалось эффективным подходом к увеличению выхода нанотрубок и установлению контроля над диаметром и длиной УНТ. Исследования на катализаторе со смесями Fe, Co и Fe / Co показывают, что диаметр и длину нанотрубок можно контролировать, варьируя соотношение двух металлов.Система, богатая кобальтом, дает высокую плотность коротких трубок с узким диаметром, в то время как системы, богатые железом, предпочитают более длинные нанотрубки, меньшую плотность и больший диаметр нанотрубок. Железные катализаторы и смеси Fe / Co также активны в отношении повторного роста нанотрубок, включая новые трубки, усиление нанотрубок, двойной рост и травление при повторном воздействии среды роста во второй раз. Биметаллические комбинации Cu-Fe-O, Co-Fe-O и Mn-Fe-O в виде дискретных наночастиц диаметром ок. Было показано, что 5-7 нм являются каталитически активными по отношению к образованию вертикально ориентированных ковров из УНТ в результате разложения ацетилена.Оценки средних темпов роста были определены для каждой биметаллической комбинации путем измерения высоты ковров, которые они производят. Из этих наблюдений было показано, что наночастицы Cu-Fe-O и Mn-Fe-O способны производить УНТ почти в два раза быстрее, чем для наночастиц Fe в идентичных условиях роста. Синтез ок. Наночастицы Co-Fe-O размером 5 нм из металлоорганических прекурсоров также были исследованы как путь к производству прекурсоров катализаторов с однородным размером и составом для роста нанотрубок.Изучая свойства биметаллических катализаторов одинакового размера, мы смогли лучше понять динамику роста УНТ.
Цитата
Крауз, Кристофер Алан. «Зарождение и рост углеродных нанотрубок в зависимости от состава катализатора». (2008) доктор наук, Университет Райса. https://hdl.handle.net/1911/22184.
Влияние состава катализатора DOC и CDPF на характеристики выбросов легкового дизельного двигателя с системой DOC + CDPF + SCR
Образец цитирования: Zhang, J., Лу Д., Сан Ю., Тан П. и др. «Влияние состава катализатора DOC и CDPF на характеристики выбросов легкого дизельного двигателя с системой DOC + CDPF + SCR», Технический документ SAE 2018- 01-0337, 2018 г., https://doi.org/10.4271/2018-01-0337.Загрузить Citation
Автор (ы): Цзин Чжан, Димин Лу, Юйцзэ Сунь, Пицян Тан, Чжиюань Ху, Чэн Хуан
Филиал: Университет Тунцзи, Академия наук об окружающей среде
Страницы: 11
Событие: Опыт Всемирного конгресса WCX
ISSN: 0148-7191
e-ISSN: 2688-3627
.