Регулировка фар на Лада Гранта своими руками: видео и фото
Лада Гранта стала одним из наиболее доступных автомобилей нашего времени. Именно это сделало его настолько популярным. Улучшает ситуацию и факт наличия неплохих технических характеристик, включая и качественную оптику независимо от комплектаций (стандарт, норма, люкс).
Проверка и настройка фар Лада Гранта
Поговорим о регулировке фар, которая схожа с тем, как проводится регулировка на других моделях автомобилей. Проводить данную процедуру нужно, как на полностью новом автомобиле, так и после движении по неровной дороге.
Если у Вас перестал гореть ближний свет фар, то виной тому может стать реле или предохранитель. А если наоборот, ближний свет не выключается, то, скорее всего у Вас «залипло реле«.
Для регулировки нам потребуется обзавестись крестовидной отвёрткой типа «Филипс», стандартным инструментом, а также запасным колесом и полным баком бензина (по возможности). Последние пункты нужны для того, чтобы обеспечить полную загрузку транспортного средства.
- Автомобиль нужно установить на ровную поверхность полностью горизонтального типа.
Проверка горизонтальности установки автомобиля
- После этого автомобиль заводится и работает на холостом ходу. Чтобы зафиксировать его положение, выжимается ручной тормоз. В случае не подтянутого или не работающего ручного тормоза под задние колёса можно установить противооткатный «башмачок».
- Проверьте давление в колёсах. Если оно не соответствует норме, то подкачайте или спустите их.
- Далее перед машиной устанавливается специальная стенка, высота которой достигает двух метров, а расстояние к ней равно около трём метрам. В принципе, стенку можно изготовить и самому из ДСП или фанеры, а также других доступных материалов.
 Либо автомобиль ставят перед ровной стеной, ка которую наносят разметку.
Либо автомобиль ставят перед ровной стеной, ка которую наносят разметку.Регулировочная схема для настройки фар
- На водительское кресло кладется груз весом до семидесяти килограммов, что необходимо для выравнивания линии фар. Можно попросить сесть за руль напарника.
- Дабы снять колебания кузова, а также его амортизаторов, автомобиль аккуратно раскачивается.
- Далее переводим регулятор гидрокорректора света Лада Гранта в положение «один человек». Именно это положение соответствует грузу в машине на водительском кресле.
Гидрокорректор в положении «0»
- Включаем ближний свет, изучая выход и реальное отклонение лучей фар на машине.
Настройка фары (барашки для регулировки)
Барашек служит для регулировки в горизонтальной плоскости, а болт-шестигранник регулирует положение пучка света по вертикали.
На фото два барашка регулировки фар
Самый труднодоступный болт регулировки в вертикальном положении
Считается, что оптика правильно отрегулирована тогда, когда лучи выходят прямо на места необходимых проекций, заранее нанесённых на стену, согласно правилам эксплуатации машины.
Теперь проводится, так называемый, тестовый заезд. Это нужно сделать для того, чтобы закрепить регулировку фар, а также проверить, была ли сделана работа правильно. Следите за тем, чтобы пучки света не ослепляли водителей, которые едут вам навстречу.
Улучшаем качество проделанной работы
Чтобы добиться оптимального результата, необходимо проверить, чтобы кузов автомобиля не располагал теми или иными деформациями, иначе настроить фары будет крайне трудно, и свет от них будет светить, как будто, в разброс.
Проверьте и то, чтобы стекло оптических приборов было максимально чистым. Удалить пыль и некоторые другие виды грязи можно при помощи пылесоса, не демонтируя фару.
Даже не вооружённым глазом видно царапины на фаре автомобиле
Если автомобиль эксплуатируется уже длительное время, тем более на грунтовых дорогах, то стекло фар могло получить повреждения в виде небольших царапин. Менять фары совсем необязательно. Достаточно будет просто отполировать их.
Некоторые проблемы могут случаться и при повреждении отражателя или при нарушении его геометрии. Тут помочь уже сложно, так как зеркальная поверхность восстанавливается крайне сложно. Придётся заменить отражатель новым. Обнаружить дефекты на нём совсем несложно, так как равномерность искривлений картинки на отражателе будет нарушена.

Выводы
Как можно заметить, процедура регулировки фар на Лада Гранта своими руками совсем не сложная. Вся процедура, при наличии готовой «стены» займёт не более двадцати минут.
Правая фара буквально «свалилась» вниз, так ездить опасно
Как правило, оптика не располагает чётким временем эксплуатации. Длительность использования ничем не ограничивается, так как всё зависит от дорожных условий, а также стиля, в котором водитель водит автомобиль.
Но, даже при нормальных выходных данных, оптика редко выдерживает более ста тысяч километров пробега, так как её поверхность покрывается обилием мелких царапин. Как мы уже сказали, устранить такие царапины можно полиролями или более существенным абразивом, но ресурсы такого восстановления не безграничны.
Уделите немного внимания и мощности галогенной фары. Дело в том, что отклонения в большую или меньшую сторону могут привести к тому, что регулировка фар на Лада Гранта не сможет быть выполнена качественно.
К тому же, у каждой партии авто могут быть свои особенности постановки пучка света, о чём вы можете узнать, просто заглянув в инструкцию по эксплуатации.
Подробная инструкция по регулировке фар Lada Granta своими руками
Лада Гранта – один из популярных автомобилей на отечественном рынке благодаря техническому оснащению, в том числе качественной оптике. Для того чтобы свет отвечал требованиям нужна регулировка фар на Лада Гранта. В статье описана процедура проверки и настройки фар, даны рекомендации по тюнингу, замене гидрокорректора или электрокорректора.
Содержание
[ Раскрыть]
[ Скрыть]
Проверка и настройка фар Лада Гранта
Регулировка фар как левой, так и правой необходима и на новом автомобиле, и после ремонта.
Левая фара Лада ГрантаПрименяемые способы проверки и регулировки света идентичны для различных моделей машин. На Лада Гранта установлены две фары с галогеновыми лампами. Функцию регулировки света ламп из салона в Ладе Гранта выполняет гидрокорректор, есть функция задержки выключения ближнего света после выключения зажигания спустя 45 секунд.
Для проведения регулировки нужно приготовить следующие материалы и инструменты:
- набор ключей;
- крестовую отвертку;
- запасное колесо;
- полный бак бензина.
Последние два пункта нужны, чтобы дать машине полную нагрузку. Для проверки автомобиль нужно установить горизонтально (автор видео — Autonakat).
Далее действия состоят из следующих шагов:
- Сначала нужно завести двигатель и дать ему поработать на холостом ходу. Для фиксации положения нужно машину поставить на ручной тормоз.
- Далее следует проверить давление в шинах и привести его в норму.
- Перед автомобилем на расстоянии около 3-х метров нужно установить специальную стену высотой 1,8-2 м и нанести на нее разметку.
- На водительское сиденье нужно положить груз весом до 70 кг, чтобы выровнять линию ближнего света от лампочек.
- Для снятия колебаний от амортизаторов и кузова, авто следует слегка раскачать.

- Регулятор коррекции света нужно выставить в положение «один человек», что соответствует нагрузке на водительском кресле.
- Далее, нужно включить ближний свет и отрегулировать отдельно левую и правую фары. И левую и правую фары нужно регулировать с помощью корректора. Лучи света от лампочек должны светить согласно разметке.
Также необходимо настроить функцию удерживания выключения света. При желании можно отключить функцию в течение 45 секунд.
Настройка фары (барашки для регулировки)
С помощью барашка выполняется регулировка ближнего света по горизонтали, а с помощью шестигранного болта корректируется свет в вертикальной плоскости. Можно поднять или опустить лучи от фар, если, например, нагружена задняя часть авто. В идеале пучки света должны точно соответствовать нанесенной на стене разметке.
После настройки ближнего света, нужно выполнить тестовый заезд для того, чтобы проверить правильность выполнения регулировки после ремонта. Свет от фар не должен слепить водителей на встречных транспортных средствах.
Свет от фар не должен слепить водителей на встречных транспортных средствах.
Рекомендации по улучшению качества
Для качественной регулировки ближнего света необходимо проверить кузов. На нем не должно быть никаких деформаций, так как они могут сказаться на качестве света, лучи от ламп будут светить в разброс. Если кузов имеет недостатки, нужно выполнить его ремонт. Кроме того, чтобы лампочки светили ярко, нужно проверить чистоту стекол на фарах. Пыль, которая скопилась на них можно убрать с помощью пылесоса.
Во время эксплуатации на стеклах могут появиться царапины. В этом случае не обязательно менять фару, можно отполировать поверхность стекла. Если выявились проблемы с отражателем, то он ремонту не подлежит, его следует заменить новым. Чтобы правильно выполнить регулировку, на машине должны быть установлены лампы одинаковой мощности и размера.
Галогенная лампа для автомобиляВыделить авто из общей массы можно с помощью тюнинга:
- установить реснички;
- затемнить фары;
- установить линзованные фары;
- сделать подсветку из светодиодов.

Самый простой вариант применяемого тюнинга – приобрести готовые реснички и наклеить их верхнюю часть передних фар Лады Гранты. Придать ресничкам желаемую форму можно с помощью канцелярского ножа. Тюнинг можно выполнить ресничками, сделанными самостоятельно. Применяемые для изготовления ресничек материалы могут быть разные, подойдут пленочные.
Можно купить виниловую пленку, вырезать шаблон из бумаги, а затем реснички вырезать из винила. Тюнинг выполняется путем наклеивания ресничек на нанесенный мыльный раствор. Можно выполнить тюнинг ресничками из пластика.
Тюнинг — реснички на фарыСуществует множество вариантов тюнинга, применяемых во время ремонта машины. Все зависит от возможностей и фантазии водителя.
Неисправность гидрокорректора
Устройство гидрокорректора несложное. Он состоит из главного цилиндра и двух вспомогательных для левой и правой фары. Все цилиндры гидрокорректора соединены трубками. На приборной доске находится ручка корректора, применяемая для регулировки фар. При повороте ручки корректора изменяется давление в главном цилиндре, которое по трубкам передается рабочим. Усилие действует на поршни отражателя, который меняет угол.
При повороте ручки корректора изменяется давление в главном цилиндре, которое по трубкам передается рабочим. Усилие действует на поршни отражателя, который меняет угол.
В электрокорректоре функцию передачи усилия выполняют моторчики, которые получают электропитание от бортовой сети. Электрокорректор более устойчив к температурным колебаниям, чем гидрокорректор, но стоит намного дороже.
Замена гидрокорректора аналогичным устройством
Причина, по которой может потребоваться ремонт гидрокорректора, чаще всего в заклинивании цилиндра или в нарушении герметичности системы: разрыв уплотнителей или повреждение трубок. В этом случае ремонт малоэффективен, проще выполнить замену своими руками гидрокорректора аналогичным устройством или электрокорректором. Процедуры замены похожи, но имеют отличия.
Для замены гидравлического корректора понадобится головка на «21» и трещотка. Сначала, открутив гайку внутри, следует снять ручку корректора для освобождения главного цилиндра корректора. Цилиндр нужно демонтировать. Затем необходимо снять рабочие цилиндры и трубки. Затем всю конструкцию нужно вытащить через отверстие в салон. Установка нового гидрокорректора осуществляется в обратном порядке.
Цилиндр нужно демонтировать. Затем необходимо снять рабочие цилиндры и трубки. Затем всю конструкцию нужно вытащить через отверстие в салон. Установка нового гидрокорректора осуществляется в обратном порядке.
Замена гидравлического корректора электрическим
Электрокорректор устанавливается аналогично. Снимается гидравлический корректор и вместо рабочих цилиндров устанавливаются электрические аналоги. Затем необходимо положительный провод присоединить к клемме «20», а отрицательный замкнуть на «массу». Соединительные трубки заменяются применяемыми проводами. На последнем шаге нужно присоединить клемму к минусу аккумулятора. Остается проверить, что электрокорректор работает правильно.
Применяемые на современных авто гидро- и электрокорректоры облегчают настройку ближнего света. Правильно отрегулированные фары — безопасность водителя и пассажиров.
Видео «Регулировка фар на автомобиле Лада Гранта»
В этом видео от Сергея Герасимого демонстрируется, как отрегулировать ближний свет на Ладе Гранта.
Лада Гранта регулировка фар своими руками
Во избежание подстерегающей опасности временного ослепления водителя, движущегося во встречном потоке, требуется правильная настройка головной оптики автомобиля. Как должна осуществляться правильно Лада Гранта регулировка фар? Об этом поговорим в данной статье.
Как на Гранте регулировать фары? Имеют место несколько способов, в результате применения которых можно отрегулировать фары в Лада Гранта, а именно:
- собственноручная регулировка фар по мануалам или видеоматериалам;
- обращение в специализированный сервис, где эта операция выполняется с привлечением оборудования.
Если задаться целью в экономии средств, то данную незамысловатую процедуру можно выполнять своими руками. Работа осуществляется в четыре приема.
Перед процессом регулировки оптики вам необходимо:
- точно разметить контрольные точки ламп на стене;
- настроить лампы ближнего освещения;
- выполнить аналогичные действия с дальним светом.

Далее при проверке настоек требуется взять во внимание немаловажные особенности и обеспечить присутствие следующих параметров:
- не допускать различий в диаметре дисков и типоразмере шин;
- проверить состояние пружинных элементов подвески;
- достичь равномерного распределения нагрузки по осям;
- добиться идентичного давления в шинах.
Если у передней оптики Лада Гранта присутствуют дефекты, то добиться корректной установки пучка света будет невозможно. Регулировка фар непосредственно своими руками с достижением правильных параметров следует пользоваться штатным корректором и выполнять процедуру на ровной вертикальной стене, длина которой не менее 7,5 метра, а высота – 2-2,2 м.
Регулировка фар на модели Лада Гранта выполняется в индивидуальном порядке ввиду собственных предпочтений владельца. Не следует выходить за рамки стандартных пределов для углов пучка света.
Гранта Лифтбек объем багажника
Багажник Лада Гранта
Датчик скорости Лада Гранта
Особенности регулировки
Нужно знать, как на Гранте регулировать фары правильно и своими руками. Находим ровную поверхность, чтобы ее сторона подходила к стене. На стене не должно присутствовать выступов и прочих неровностей. Подъезжаем на LADA Granta до упора к стене и намечаем на ней центральные точки осей ламп и сам центр симметрии авто. Чтобы обеспечить корректную разметку, замеряем и фиксируем расстояние от ламп до земной поверхности. Затем прочерчиваем линию, которая располагается в 5 см ниже первых отметок. После отъезжаем на определенное расстояние и размечаем на поверхности стены линию, которая предназначена для соединения центральных точек ламп. Затем наносим вертикальные линии (через те же центры ламп). Теперь вы понимаете принцип, как отрегулировать фары.
Находим ровную поверхность, чтобы ее сторона подходила к стене. На стене не должно присутствовать выступов и прочих неровностей. Подъезжаем на LADA Granta до упора к стене и намечаем на ней центральные точки осей ламп и сам центр симметрии авто. Чтобы обеспечить корректную разметку, замеряем и фиксируем расстояние от ламп до земной поверхности. Затем прочерчиваем линию, которая располагается в 5 см ниже первых отметок. После отъезжаем на определенное расстояние и размечаем на поверхности стены линию, которая предназначена для соединения центральных точек ламп. Затем наносим вертикальные линии (через те же центры ламп). Теперь вы понимаете принцип, как отрегулировать фары.
По завершении процедуры разметки включаем фары и настраиваем углы наклона ламп до совмещения светового пучка с горизонтальной разметкой. Участок подъема светового пятна (верхняя граница) по вертикали вверх должен совпадать с ранее нанесенной пересекающейся линией.
Как отрегулировать фары до идеального пучка следует вращать регулировочные винты, находящиеся в подкапотном пространстве. Оптимальная настройка будет в том случае, когда свет начнет попадать в участок, располагающийся ниже линии отметки центров.
Оптимальная настройка будет в том случае, когда свет начнет попадать в участок, располагающийся ниже линии отметки центров.
Важно! Настройку дальнего и ближнего светового пучка следует осуществлять в раздельном порядке. Параметры разметки будут немного разниться. У ближнего света они идентичны описанной здесь схеме, а у дальнего пучок должен попадать точно в разметку центра.
Рекомендуется воспользоваться специальным оборудованием и изучить видеоматериал как отрегулировать.
Как отрегулировать ПТФ?
Перед процессом регулировки следует позаботиться о дополнительной нагрузке на авто – подойдет любой предмет, который по габаритам сможет разместиться в автомобиле. Заправляем бак и располагаем Лада Гранта максимально вровень с горизонтальным дорожным полотном. На поверхность аналогичной стены наносим линии, выступающие в роли контрольных точек. Размечаем расстояние до центра. Добиваемся разлинованного с двумя контрольными точками полотна.
После нанесения разметки отъезжаем на LADA Granta на 10 м. Далее, воспользовавшись отверткой, выполняем регулировку винтов, чтобы обеспечить достижения фокуса во всех контрольных точках. Теперь вы знаете, как на Гранте регулировать фары. В этом процессе нет ничего сложного.
Далее, воспользовавшись отверткой, выполняем регулировку винтов, чтобы обеспечить достижения фокуса во всех контрольных точках. Теперь вы знаете, как на Гранте регулировать фары. В этом процессе нет ничего сложного.
Регулировка фар, самостоятельно: видео инструкция
Проверка и регулировка фар производится на полностью снаряженном автомобиле, то есть у него должен быть полностью заполнен бак, в нем должен находиться весь инструмент, который автолюбитель возит с собой, и, главное, не забывать про запасное колесо.
Для того, чтобы произвести регулировку, понадобится длинный шестигранник на шесть.
Теперь можно переходить непосредственно к процессу, который состоит из нескольких этапов.
1. Предварительно нужно накачать колеса и проверить давление в шинах.
Стоит обратиться к схеме регулировки света фар. Здесь 1 линия – горизонтальная линия, соответствующая центрам фар; 2 – линия проходящая через центры световых пятен; А, В – вертикальные линии, соответствующие центрам фар; О – осевая линия; h – расстояние от центров фар до пола; d – расстояние между центрами ламп фар
Здесь 1 линия – горизонтальная линия, соответствующая центрам фар; 2 – линия проходящая через центры световых пятен; А, В – вертикальные линии, соответствующие центрам фар; О – осевая линия; h – расстояние от центров фар до пола; d – расстояние между центрами ламп фар
2. На втором этапе необходимо установить авто перпендикулярно гладкой стене, таким образом, чтобы он находился от нее примерно в 5 метрах. На сидение водителя стоит положить груз, который соответствует массе человека, управляющего данным транспортным средством. На стене размещается экран, а на нем рисуются линии 1, 2, А, В, О. d должны располагаться симметрично относительно осевой линии. На высоте h проводится линия 1, а ниже на 55 миллиметров проводится 2.
3. Теперь можно включить зажигание и повернуть ручку корректора фар в положение «0». Оно соответствует тому, когда в машине находится только один водитель.
4. Далее открывается капот и производится регулировка пучка света для каждой фары. Это стоит делать только в том случае, если расположение световых пятен на проекционном экране не совпадает с рисунком.
Это стоит делать только в том случае, если расположение световых пятен на проекционном экране не совпадает с рисунком.
5. Направление светового пятна регулируется отдельно для каждой фары. При этом вторая должна быть закрыта или отключена от источника питания. Это способствует более четкому восприятию всей информации на экране.
6. Свет фар можно считать отрегулированным только в том случае, если верхняя граница левых частей световых пятен совпадает с линией, которая проходит через центры световых пятен. При этом линии А и В должны проходить через точки, в которых пересекаются горизонтальные и наклонные участки световых пятен. Только после проверки, можно считать, что работа выполнена удачно.
Регулировка фар на Ладе Гранта своими руками видео
Чтобы избежать опасности для водителя, который едет по встречной, нужно отрегулировать правильно свет фар автомобиля.
Действенных способов того как проходит регулировка фар гранта существует три: регулировка фар Лада Гранта своими руками видео ролики помогут выполнить ее качественно, регулировка фар Лада Гранта специалистом автосервиса, нужным оборудованием.
При желании немного сэкономить на данной процедуре можно ее произвести самостоятельно. Проводится Лада Гранта регулировка фар в 4 этапа.
Перед тем как отрегулировать фары на гранте Вы должны:
– точно сделать разметки на стене;
– произведите разметку ламп;
– настройте ближний свет;
– настройте дальний свет.
Стоит проверить лада гранта фары и некоторые параметры:
– учесть разницу в объеме шин;
– оценить состояние пружин, которые находятся в подвеске;
– распределение нагрузки;
– давление в шинах.
Когда фары Лада Гранта имеют неисправности, то следовательно угол освещения выставлен будет неправильно, что, скажется на регулировке. Естественно, для правильной регулировки необходим электрокорректор фар на Гранту и вертикальная ровная стена для автомобиля — с длиной 7,5 метров.
Так как у каждого водителя свои предпочтения, то регулировка фар на Гранте подбирается индивидуально. Но существуют стандартные значения как поднять фары на Гранте которые Вы можете использовать для авто.
Схема регулировки
Необходимо найти ровную площадку, со стороной которая упирается в стену. Она должна быть в свою очередь без углов, выступов, различных неровностей, вертикальной. Вплотную подъезжаем к стене, отмечаем центр и центральную ось лампы.
Для правильной разметки стены, необходимо отметить от лампы до пола расстояние. Затем начертить линию, расположенную ниже на 5 см от первой. Далее отъехать от стены и провести горизонтальную линию на стене, которая должна соединить на лампах центральные точки. Потом ведем вертикальные линии.
После осуществления разметки, включаем свет фар, производим настройку, чтобы угол наклона лампы совпадал с горизонтальной линией. А место, где начинает свет подниматься вверх, должно обязательно совпасть с начерченными пересекающимися линиями.
А место, где начинает свет подниматься вверх, должно обязательно совпасть с начерченными пересекающимися линиями.
Чтобы получился самый идеальный пучок света, Вы должны подкрутить винты, которые расположены под капотом. Идеально вариантом будет, когда свет немного ниже чем сама отметка центра.
Важно! Пучки дальнего и ближнего света настраиваются отдельно. Разметка стены будет отличаться — ближний регулируется по описанному выше методу, дальний должен точно падать на центральную разметку. Лучше в таком случае использовать специальное оборудование и посмотреть видео регулировка фар на гранте.
Регулировка ПТФ
Перед регулировкой Вам нужно снабдить свое авто дополнительной нагрузкой — подходит все что угодно, что поместится в Ваше авто. Заправить полный бак, поставить автомобиль так, чтобы он находился максимально ровно к горизонтальной поверхности. На стене нужно начертить линии, которые означают точки. Также отметить расстояние до центра. В итоге получится разлинованное с двумя точками полотно.
На стене нужно начертить линии, которые означают точки. Также отметить расстояние до центра. В итоге получится разлинованное с двумя точками полотно.
После проведения черчения установите авто от стены – 10 метров и отверткой отрегулируйте винты, нужно добиться фокуса света во всех точках. В местах где центр фар будет пересекаться.
Вам также может быть интересно
Автор всех статей на сайте!
Собственный сервис “Нью-Лайн Авто”
Все виды работ.
Специализация: Lada
Регулировка фар Лада Гранта своими руками
Регулировка фар Лада Гранта может быть произведена самостоятельно на всех модификациях этого автомобиля. Принципы проведения работы схожи практически для всех машин. Регулировка фар должна быть сделана и на абсолютно новой машине, так как при езде она от тряски может дать сбой. Чтобы правильно отрегулировать оптику, надо знать технологию проведения такой работы.
Проверка и настройка фар Гранты
Для работы надо взять крестообразную отвертку, ящик с инструментами, запасное колесо и полностью заправить бак бензином. Теперь можно начать:
Теперь можно начать:
- Автомобиль выставляют на горизонтальную поверхность.
- Оставляют двигатель работающим на холостом ходу.
- Выжимают ручной тормоз.
- Надо проверить давление в шинах, и если это нужно, то подкачать их или спустить.
- Перед автомобилем устанавливают искусственную стенку. Она должна быть высотой 1,8-2 метра и находиться на расстоянии 2,8-3,2 м. Ее можно изготовить из ДСП или подобных ей материалов.
- На кресло водителя надо положить груз весом 55-70 килограмм, чтобы выровнять линию фар.
- Затем надо сделать следующие замеры: расстояние между фарами, их высоту над дорожным полотном. Находят середину между ними. Все эти данные надо перенести на искусственную стену при помощи мела. Должна получиться точечная проекция, где будут обозначены края и центры фар Лада.
Для регулировки света необходимо создать давление в кресле т.е. сесть в авто
- Чтобы снять колебания кузова и амортизаторов, надо его слегка покачать.

- Регулятор коррекции света фар Лада надо перевести в положение «один человек». Именно для этой операции положен груз на кресле водителя. Затем надо включить ближний свет. Теперь надо внимательно рассмотреть выход и фактическое отклонение каждого луча фары на Ладе.
- Поднимают капот и находят корректоры. Отверткой выравнивают выход световых пучков. Они должны соответствовать точкам на искусственной стене и по вертикали, и по горизонтали.
- Оптика считается хорошо отрегулированной, если лучи будут выходить прямо на свои проекции на стенке.
- Проводят тестовый заезд для закрепления сделанной регулировки и проверки сделанной работы. Главное, чтобы пучки света от фар автомобиля не ослепляли других водителей.
Если что-то непонятно, то можно посмотреть видео по проведению такой регулировки.
Модернизация оптики на автомобиле
Чтобы не нарушалась геометрия светового потока, надо своевременно устранять деформации кузова автомобиля. Если внутри и снаружи стекол собралась пыль, убрать ее можно пылесосом. Фару при этом снимать не надо, а можно просто выкрутить галоген вместе с проводами. Если замечены дефекты или повреждения в отражателе, то его надо сменить.
Фару при этом снимать не надо, а можно просто выкрутить галоген вместе с проводами. Если замечены дефекты или повреждения в отражателе, то его надо сменить.
Обязательно должны быть установлены лампы равной мощности и габаритов на фарах. Если этого нет, то и регулирование не поможет. Для того чтобы автомобиль выделялся из общей массы машин, можно попробовать изменить его внешность:
- установить реснички на фары Лада;
- укрепить подвеску из светодиодов — так называемые ангельские глазки;
- покрасить фары в темные цвета или затонировать их.
Однако тюнинг фар — работа достаточно сложная, из-за того что надо выполнить требования по безопасности и различные регламенты, установленные государством. Передние фары машины должны светить с вполне определенной яркостью, а это можно достичь только с применением специального оборудования.
Делаем реснички для фар
Реснички можно сделать самостоятельно или купить уже готовые
Наиболее простой вариант — купить готовые реснички на фары Лада и наклеить их на верхнюю часть переднего светильника. Чтобы придать им нужную форму, можно воспользоваться строительным ножом с лезвиями или канцелярским резаком. Реснички можно сделать своими руками из пленочных материалов. Для этого нужно приобрести виниловую пленку. Работа начинается с изготовления шаблона. Вначале его вычерчивают на бумаге, а затем вырезают ресничку по нему из винила. Наклеивается деталь при помощи мыльного раствора. Если одного слоя будет недостаточно, то можно наклеить и второе покрытие.
Чтобы придать им нужную форму, можно воспользоваться строительным ножом с лезвиями или канцелярским резаком. Реснички можно сделать своими руками из пленочных материалов. Для этого нужно приобрести виниловую пленку. Работа начинается с изготовления шаблона. Вначале его вычерчивают на бумаге, а затем вырезают ресничку по нему из винила. Наклеивается деталь при помощи мыльного раствора. Если одного слоя будет недостаточно, то можно наклеить и второе покрытие.
Третий способ — реснички из пластика. Он более сложен, так как понадобится снять оптику. Фары снимают и прикладывают пластик к стеклянному колпаку светильников. Пластмассу нагревают феном и разглаживают по форме фары. Затем их закрепляют изоляционной лентой, чтобы она не сдвинулась, пока не остынет. Нужный контур наносят маркером на пластмассу и вырезают резаком.
Полученные детали окрашивают краской и приклеивают на места. Чтобы познакомиться с другими методами производства таких работ, можно посмотреть многочисленные видео, посвященные этой теме. Для правильной настройки оптики и украшения автомобиля не нужно каких-либо особых навыков или знаний. Это можно сделать самостоятельно и долгое время пользоваться полученным результатом своей работы.
Для правильной настройки оптики и украшения автомобиля не нужно каких-либо особых навыков или знаний. Это можно сделать самостоятельно и долгое время пользоваться полученным результатом своей работы.
Рейтинг статьи:
Загрузка…Поделиться в соцсетях:
Регулировка фар на гранте по вертикали
Данная тема будет актуальна не только для владельцев автомобиля Лада Гранта, но и схожих по конструктивным особенностям моделей ВАЗ. Правильно настроенная оптика позволит безопасно двигаться на транспортном средстве в вечернее и ночное время суток. О том, как произвести регулировку фар, рассказано ниже.
Когда необходима регулировка фар на Гранте. Почему сбивается
Необходимость регулировки фар может быть обусловлена многими факторами, из-за которых в процессе эксплуатации меняется установочный угол оптических приборов и движение на автомобиле становится небезопасным. Причинами для нерегламентированного светового потока могли стать мелкие ДТП, даже когда слегка был задет бампер, езда с большой скоростью по плохим дорогам.
Инструкция для самостоятельной регулировки
Для регулировки понадобится вспомогательный экран
Устройство фары автомобиля Лада Гранта
Устройство фары автомобиля Лада Гранта(со стороны водителя)
1 — регулятор светового потока в горизонтальном направлении;
2 — место под патрон лампочки поворотников;
3 — гнездо главного гидроцилиндра гидрокорректора;
4 — место под патрон лампы дальнего света;
5 — регулятор потока света в вертикальном направлении;
6 — место под патрон лампы габаритов и дневных ходовых огней.
Инструмент и материалы, необходимые для работы своими руками
- шестигранник на «6»;
- лист ДСП 3 на 2 метра;
- мел.
Как отрегулировать свет: механизм работ
- Ставим работающую на холостом ходу машину на ровную поверхность, включаем ручной тормоз;
- Нагружаем автомобиль любыми подходящими грузами для оптимальной балансировки кузова, чтобы его положение было приближено к повседневной эксплуатации;
- Производим контроль давления в шинах;
- В трёх метрах от фар автомобиля ставим подготовленный экран;
- Размечаем экран так, как показано на рисунке.
Таким образом мы делаем разметку экрана для последующей оптимизированной регулировки фар
Противотуманные фары должны работать только с габаритными огнями или ближним светом фар (ПДД, действующая редакция). Свет их регулируется только по высоте.
Видео по работе
Регулировка фар будет считаться законченной, когда лучи света проецируются на экране так, как показано на рисунке. После данной регулировки езда на автомобиле станет ощутимо комфортабельней.
После данной регулировки езда на автомобиле станет ощутимо комфортабельней.
На автомобиль Лада Гранта установлены две фары головного света с галогенными лампами ближнего и дальнего света. Также на автомобиле установлен гидрокорректор, позволяющий при необходимости (при разной нагрузке) изменять направление светового пучка в вертикальной плоскости из салона. В этой статье рассмотрим ситуацию, когда появляется необходимость отрегулировать свет фар Лада Гранта в вертикальной и горизонтальной плоскости своими руками с помощью регулировочных болтов.
Для регулировки света фар потребуется:
- Приготовить крестовую отвертку или шестигранник «на 6».
- Подготовить автомобиль (давление шин должно соответствовать норме, заправить автомобиль до полного бака, проверить наличие запаски в багажнике и разместить вес 75кг. на водительском сиденье).
- Установить автомобиль напротив стены на расстоянии 3м.
- Разместить на стене экран, как показано на схеме.

Схема регулировки фар автомобиля по ГОСТу
Регулировка света фар своими руками:
- Продольная ось симметрии автомобиля должна проходить по линии 0 на экране.
- Вертикальные линии 1 и 2 расположены на равном расстоянии от линии 0.
- Расстояние А между линиями 1 и 2 должно быть равно расстоянию между центрами ламп ближнего света фар.
- Измерьте высоту центров фар от земли – это будет расстояние h на экране.
- Установите гидрокорректор в положение 0 (автомобиль с одним водителем).
- Включите ближний свет фар и на время регулировки одной фары вторую закройте непрозрачным материалом.
- Откройте капот и отрегулируйте свет фары, вращая регулировочные винты через специальное отверстие.
Регулировка фар Лада Гранта считается выполненной если верхние границы левых частей световых пятен совпадают с линией 4, а вертикальные линии 1 и 2 проходят через точки Е1 и Е2 пересечения горизонтальных и наклонных участков световых пятен.
Как отрегулировать фары также показано на видео:
Возможно заинтересует другие инструкции по ремонту Лада Гранта.
Лада Гранта стала одним из наиболее доступных автомобилей нашего времени. Именно это сделало его настолько популярным. Улучшает ситуацию и факт наличия неплохих технических характеристик, включая и качественную оптику независимо от комплектаций (стандарт, норма, люкс).
Проверка и настройка фар Лада Гранта
Поговорим о регулировке фар, которая схожа с тем, как проводится регулировка на других моделях автомобилей. Проводить данную процедуру нужно, как на полностью новом автомобиле, так и после движении по неровной дороге.
Если у Вас перестал гореть ближний свет фар, то виной тому может стать реле или предохранитель. А если наоборот, ближний свет не выключается, то, скорее всего у Вас «залипло реле«.
Для регулировки нам потребуется обзавестись крестовидной отвёрткой типа «Филипс», стандартным инструментом, а также запасным колесом и полным баком бензина (по возможности). Последние пункты нужны для того, чтобы обеспечить полную загрузку транспортного средства.
- Автомобиль нужно установить на ровную поверхность полностью горизонтального типа.
Проверка горизонтальности установки автомобиля
Регулировочная схема для настройки фар
Гидрокорректор в положении «0»
Настройка фары (барашки для регулировки)
Барашек служит для регулировки в горизонтальной плоскости, а болт-шестигранник регулирует положение пучка света по вертикали. По возможности, пучки должны максимально точно соответствовать точкам на изготовленной стене, как в вертикальной, так и в горизонтальной плоскости.
На фото два барашка регулировки фар
Самый труднодоступный болт регулировки в вертикальном положении
Считается, что оптика правильно отрегулирована тогда, когда лучи выходят прямо на места необходимых проекций, заранее нанесённых на стену, согласно правилам эксплуатации машины.
Теперь проводится, так называемый, тестовый заезд. Это нужно сделать для того, чтобы закрепить регулировку фар, а также проверить, была ли сделана работа правильно. Следите за тем, чтобы пучки света не ослепляли водителей, которые едут вам навстречу.
Улучшаем качество проделанной работы
Чтобы добиться оптимального результата, необходимо проверить, чтобы кузов автомобиля не располагал теми или иными деформациями, иначе настроить фары будет крайне трудно, и свет от них будет светить, как будто, в разброс.
Проверьте и то, чтобы стекло оптических приборов было максимально чистым. Удалить пыль и некоторые другие виды грязи можно при помощи пылесоса, не демонтируя фару.
Даже не вооружённым глазом видно царапины на фаре автомобиле
Если автомобиль эксплуатируется уже длительное время, тем более на грунтовых дорогах, то стекло фар могло получить повреждения в виде небольших царапин. Менять фары совсем необязательно. Достаточно будет просто отполировать их.
Некоторые проблемы могут случаться и при повреждении отражателя или при нарушении его геометрии. Тут помочь уже сложно, так как зеркальная поверхность восстанавливается крайне сложно. Придётся заменить отражатель новым. Обнаружить дефекты на нём совсем несложно, так как равномерность искривлений картинки на отражателе будет нарушена.
И, конечно же, учитывайте то, что в оптике должны быть установлены лампы с равной друг другу мощностью, а также с идентичными размерами. Если это не так, то толку от регулировки не будет вовсе.
Выводы
Как можно заметить, процедура регулировки фар на Лада Гранта своими руками совсем не сложная. Вся процедура, при наличии готовой «стены» займёт не более двадцати минут.
Правая фара буквально «свалилась» вниз, так ездить опасно
Как правило, оптика не располагает чётким временем эксплуатации. Длительность использования ничем не ограничивается, так как всё зависит от дорожных условий, а также стиля, в котором водитель водит автомобиль.
Но, даже при нормальных выходных данных, оптика редко выдерживает более ста тысяч километров пробега, так как её поверхность покрывается обилием мелких царапин. Как мы уже сказали, устранить такие царапины можно полиролями или более существенным абразивом, но ресурсы такого восстановления не безграничны.
Уделите немного внимания и мощности галогенной фары. Дело в том, что отклонения в большую или меньшую сторону могут привести к тому, что регулировка фар на Лада Гранта не сможет быть выполнена качественно.
К тому же, у каждой партии авто могут быть свои особенности постановки пучка света, о чём вы можете узнать, просто заглянув в инструкцию по эксплуатации.
Мультиплексирование PKA и ERK1 и 2 киназ FRET биосенсоров в живых клетках с использованием двухцветного сигнала с одной длиной волны возбуждения FLIM
Хантер Т. Сигналинг — 2000 и далее. Cell 100 , 113–127 (2000).
CAS Статья Google Scholar
Дюма, Н. и Марэ, Р. Интеграция сигналов между цАМФ и сигнальными путями RAS / RAF / MEK / ERK. Основано на юбилейной премии лекции Gesellschaft fur Biochemie und Molekularbiologie, прочитанной 5 июля 2003 г. на специальной встрече FEBS в Брюсселе. FEBS J. 272 , 3491–3504 (2005).
и Марэ, Р. Интеграция сигналов между цАМФ и сигнальными путями RAS / RAF / MEK / ERK. Основано на юбилейной премии лекции Gesellschaft fur Biochemie und Molekularbiologie, прочитанной 5 июля 2003 г. на специальной встрече FEBS в Брюсселе. FEBS J. 272 , 3491–3504 (2005).
CAS Статья Google Scholar
Уберсакс, Дж. А. и Феррелл, мл. Дж. Э. Механизмы специфичности фосфорилирования белков. Nat. Rev. Mol. Cell Biol. 8 , 530–541 (2007).
CAS Статья Google Scholar
Хауслей М. Д. и Колч В. Специфическая интеграция межклеточного взаимодействия между киназой, регулируемой внеклеточным сигналом, и передачей сигналов цАМФ. Мол. Pharmacol. 58 , 659–668 (2000).
CAS Статья Google Scholar
Робертс, П. Дж. И Дер, К. Дж. Нацеливание на каскад митоген-активируемых протеинкиназ Raf-MEK-ERK для лечения рака. Онкоген 26 , 3291–3310 (2007).
Онкоген 26 , 3291–3310 (2007).
CAS Статья Google Scholar
Fujita, Y., Komatsu, N., Matsuda, M. & Aoki, K. Основанный на передаче энергии резонанса флуоресценции количественный анализ петель прямой связи и обратной связи в передаче сигналов рецептора эпидермального фактора роста и чувствительности к лекарственным средствам молекулярного таргетинга. FEBS J. 281 , 3177–3192 (2014).
CAS Статья Google Scholar
Витцель, Ф., Мэддисон, Л. и Блютген, Н. Как каркасы формируют сигнализацию MAPK: что мы знаем и возможности для системных подходов. Фронт. Physiol. 3 , 475 (2012).
Артикул Google Scholar
Эбисуя, М., Кондо, К. и Нишида, Э. Продолжительность, величина и компартментализация активности киназы ERK MAP: механизмы обеспечения специфичности передачи сигналов.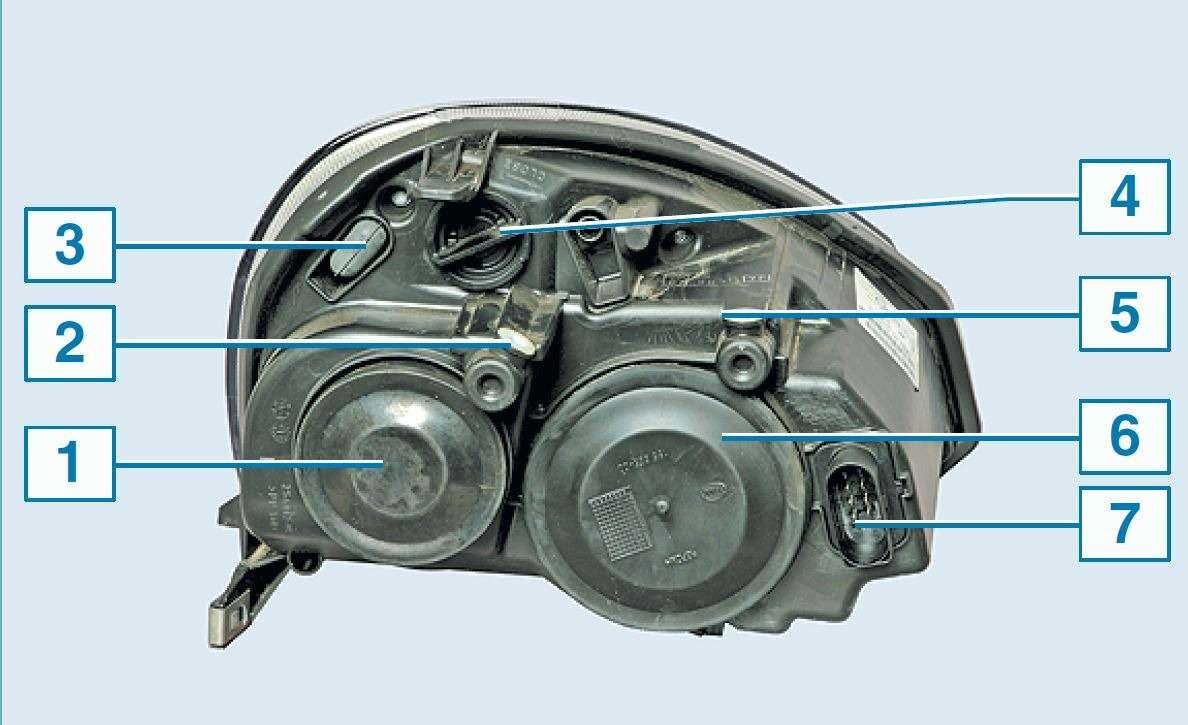 J. Cell Sci. 118 , 2997–3002 (2005).
J. Cell Sci. 118 , 2997–3002 (2005).
CAS Статья Google Scholar
Тейлор, С.S. et al. Динамика сигнализации PKA. Биохим. Биофиз. Acta — Proteins Proteomics 1754 , 25–37 (2005).
CAS Статья Google Scholar
Сторк, П. Дж. С. и Шмитт, Дж. М. Перекрестные помехи между передачей сигналов киназы цАМФ и МАР в регуляции пролиферации клеток. Тенденции в клеточной биологии 12 , 258–266 (2002).
CAS Статья Google Scholar
Гериц, Н., Костенко, С., Ширяев, А., Йоханнесен, М. и Моенс, У. Отношения между митоген-активированной протеинкиназой и цАМФ-зависимыми протеинкиназными путями: товарищество и враждебность. Ячейка. Сигнал. 20 , 1592–1607 (2008).
CAS Статья Google Scholar
Wellbrock, C. , Karasarides, M. & Marais, R. Белки RAF занимают центральное место. Nat. Rev. Mol. Cell Biol. 5 , 875–885 (2004).
, Karasarides, M. & Marais, R. Белки RAF занимают центральное место. Nat. Rev. Mol. Cell Biol. 5 , 875–885 (2004).
CAS Статья Google Scholar
Гериц, Н., Костенко, С. и Моенс, У. Функции митоген-активированных протеинкиназ in vivo: выводы на мышах с нокаутом и нокаутом. Transgenic Res. 16 , 281–314 (2007).
CAS Статья Google Scholar
Смит, Ф. Д., Лангеберг, Л. К. и Скотт, Дж.D. Где и когда происходит закрепление киназы. Trends Biochem. Sci. 31 , 316–323 (2006).
CAS Статья Google Scholar
Smith, F. D. et al. AKAP-Lbc усиливает контроль циклического АМФ каскада ERK1 / 2. Nat. Cell Biol. 12 , 1242–1249 (2010).
CAS Статья Google Scholar
Конти, М. & Биво, Дж. Биохимия и физиология циклических нуклеотидных фосфодиэстераз: важные компоненты в передаче сигналов циклических нуклеотидов. Анну Рев Биохим . 76 , 481–511 (2007).
& Биво, Дж. Биохимия и физиология циклических нуклеотидных фосфодиэстераз: важные компоненты в передаче сигналов циклических нуклеотидов. Анну Рев Биохим . 76 , 481–511 (2007).
CAS Статья Google Scholar
Baillie, G. S., MacKenzie, S. J., McPhee, I. & Houslay, M. D. Селективные действия подсемейства в способности киназы Erk2 MAP фосфорилировать и регулировать активность PDE4-циклических AMP-специфичных фосфодиэстераз. руб. J. Pharmacol . 131 , 811–819 (2000).
CAS Статья Google Scholar
Brown, K. M. et al. Фосфодиэстераза-8A связывается с киназой Raf-1 и регулирует ее. Proc. Natl. Акад. Sci. США 110 , E1533 – E1542 (2013).
CAS Статья Google Scholar
Хохрайтер, Б., Гарсия, А. П. и Шмид, Дж.A. Флуоресцентные белки как генетически кодируемые биосенсоры FRET в науках о жизни. Датчики (Базель) . 15 , 26281–26314 (2015).
Датчики (Базель) . 15 , 26281–26314 (2015).
CAS Статья Google Scholar
Карлсон, Х. Дж. И Кэмпбелл, Р. Е. Генетически кодированные биосенсоры на основе FRET для многопараметрической флуоресцентной визуализации. Current Opinion in Biotechnology 20 , 19–27 (2009).
CAS Статья Google Scholar
Пилич, А.И Шульц, С. Одновременная запись нескольких событий сотовой связи с помощью FRET. ACS Chem. Биол. 3 , 156–160 (2008).
CAS Статья Google Scholar
Ai, H., Hazelwood, K. L., Davidson, M. W. & Campbell, R. E. Пары флуоресцентных белков FRET для ратиометрической визуализации двойных биосенсоров. Nat. Методы 5 , 401–403 (2008).
CAS Статья Google Scholar
Дин, Ю. , Ай, Х. В., Хой, Х. и Кэмпбелл, Р. Э. Форстеровские биосенсоры на основе резонансного переноса энергии для многопараметрической ратиометрической визуализации динамики Ca 2+ и активности каспазы-3 в отдельных клетках. Анал. Chem. 83 , 9687–9693 (2011).
, Ай, Х. В., Хой, Х. и Кэмпбелл, Р. Э. Форстеровские биосенсоры на основе резонансного переноса энергии для многопараметрической ратиометрической визуализации динамики Ca 2+ и активности каспазы-3 в отдельных клетках. Анал. Chem. 83 , 9687–9693 (2011).
CAS Статья Google Scholar
Су, Т., Пан, С., Луо, К. и Чжан, З. Мониторинг двойных биомолекулярных событий с использованием биосенсоров FRET на основе пар флуоресцентных белков mTagBFP / sfGFP и mVenus / mKOκ. Биосенс. Биоэлектрон . 46 , 97–101 (2013).
CAS Статья Google Scholar
Щербакова Д. М., Хинк М. А., Йоосен, Л., Гаделла, Т. В. Дж. И Верхуша, В. В. Оранжевый флуоресцентный белок с большим стоксовым сдвигом для многоцветной визуализации FCCS и FRET при однократном возбуждении. J. Am. Chem. Soc. 134 , 7913–7923 (2012).
CAS Статья Google Scholar
Муракоши, Х. , Shibata, A.C.E., Nakahata, Y. & Nabekura, J. Темно-зеленый флуоресцентный белок в качестве акцептора для измерения резонансной передачи энергии Ферстера. Sci. Отчет 5 , 15334 (2015).
, Shibata, A.C.E., Nakahata, Y. & Nabekura, J. Темно-зеленый флуоресцентный белок в качестве акцептора для измерения резонансной передачи энергии Ферстера. Sci. Отчет 5 , 15334 (2015).
ADS CAS Статья Google Scholar
Щербо Д. и др. Ярко-красные флуоресцентные метки для визуализации белков в живых тканях. Biochem. J. 418 , 567–574 (2009).
CAS Статья Google Scholar
Фриц, Р.D. et al. Универсальный набор инструментов для создания чувствительных биосенсоров FRET для визуализации сигналов во времени и пространстве. Sci. Сигнал . 6 , RS12 (2013).
Артикул Google Scholar
Депри К., Аллен М. Д. и Чжан Дж. Визуализация активности PKA в микродоменах плазматической мембраны. Мол. Биосист. 7 , 52–58 (2011).
CAS Статья Google Scholar
Лере, А. , Падилья-Парра, С., Рул, Дж., Хелиот, Л. и Трамье, М. 827 Пространственно-временная количественная оценка FRET в живых клетках с помощью быстрой временной области FLIM: сравнительное исследование неприспособленных методов. PLoS One 8 , e69335 (2013).
, Падилья-Парра, С., Рул, Дж., Хелиот, Л. и Трамье, М. 827 Пространственно-временная количественная оценка FRET в живых клетках с помощью быстрой временной области FLIM: сравнительное исследование неприспособленных методов. PLoS One 8 , e69335 (2013).
ADS CAS Статья Google Scholar
Padilla-Parra, S. et al. Количественное сравнение различных пар флуоресцентных белков для быстрого получения FRET-FLIM. Biophys.J. 97 , 2368–2376 (2009).
ADS CAS Статья Google Scholar
Ай, Х., Хендерсон, Дж. Н., Ремингтон, С. Дж. И Кэмпбелл, Р. Э. Руководили эволюцией мономерной, яркой и фотостабильной версии голубого флуоресцентного белка Clavularia: структурная характеристика и применение в флуоресцентной визуализации. Biochem. J. 400 , 531–540 (2006).
CAS Статья Google Scholar
Муракоши, Х. , Ли, С.-Дж. И Ясуда, Р. Высокочувствительная и количественная визуализация FRET – FLIM в отдельных дендритных шипах с использованием улучшенного безызлучательного YFP. Brain Cell Biol. 36 , 31–42 (2008).
, Ли, С.-Дж. И Ясуда, Р. Высокочувствительная и количественная визуализация FRET – FLIM в отдельных дендритных шипах с использованием улучшенного безызлучательного YFP. Brain Cell Biol. 36 , 31–42 (2008).
Артикул Google Scholar
Сенгупта, Н., Винод, П. К. и Венкатеш, К. В. Перекрестное взаимодействие между путями цАМФ-PKA и MAP-киназ является ключевым регуляторным дизайном, необходимым для регуляции экспрессии FLO11. Biophys. Chem. 125 , 59–71 (2007).
CAS Статья Google Scholar
Herbst, K.J., Allen, M.D. & Zhang, J. Пространственно-временная регулируемая активность протеинкиназы А является критическим регулятором стимулируемой фактором роста внеклеточной передачи сигналов киназы, регулируемой в клетках PC12. Мол. Клетка. Биол. 31 , 4063–4075 (2011).
CAS Статья Google Scholar
Вандам, П. и другие. Оптимизация биосенсоров активности ERK как для ратиометрических, так и для продолжительных измерений FRET. Датчики 14 , 1140–1154 (2014).
и другие. Оптимизация биосенсоров активности ERK как для ратиометрических, так и для продолжительных измерений FRET. Датчики 14 , 1140–1154 (2014).
CAS Статья Google Scholar
Komatsu, N. et al. Разработка оптимизированной основы биосенсоров FRET для киназ и GTPases. Мол. Биол. Ячейка 22 , 4647–4656 (2011).
CAS Статья Google Scholar
Аллен, М.Д. и Чжан Дж. Субклеточная динамика активности протеинкиназы А, визуализированная репортерами на основе FRET. Biochem. Биофиз. Res. Commun. 348 , 716–721 (2006).
CAS Статья Google Scholar
Zhang, J., Ma, Y., Taylor, S. & Tsien, R.Y. Генетически кодируемые репортеры активности протеинкиназы A показывают влияние связывания субстрата. Proc. Natl. Акад. Sci. США 98 , 14997–15002 (2001).
ADS CAS Статья Google Scholar
Харви, К. Д. и др. Генетически кодируемый флуоресцентный сенсор активности ERK. Proc. Natl. Акад. Sci. США 105 , 19264–19269 (2008).
ADS CAS Статья Google Scholar
Vandame, P. et al. Оптимизация биосенсоров активности ERK как для логометрических, так и для измерения времени жизни FRET. Сенсоры (Базель). 14 , 1140–1154 (2013).
Артикул Google Scholar
Caldwell, G. B. et al. Прямая модуляция протеинкиназы каталитической субъединицы альфа тирозинкиназами рецептора фактора роста. J Cell Biochem 113 , 39–48 (2011).
Артикул Google Scholar
Фишман Д., Галицки Л., Priel, E. & Segal, S. Эпидермальный фактор роста регулирует активность протеинкиназы A в клетках фибросаркомы мышей: различия между метастатическими и неметастатическими вариантами опухолевых клеток. Cancer Res. 57 , 5410–5415 (1997).
Cancer Res. 57 , 5410–5415 (1997).
CAS PubMed Google Scholar
Мюррей, А. Дж. Фармакологическое ингибирование PKA: все может быть не тем, чем кажется. Sci. Сигнал. 1 , re4 (2008).
ADS Статья Google Scholar
Мачачек, М.и другие. Координация активности Rho GTPase во время выпячивания клеток. Природа 461 , 99–103 (2009).
ADS CAS Статья Google Scholar
Woehler, A. Одновременная количественная визуализация живых клеток нескольких биосенсоров на основе FRET. PLoS One 8 , e61096 (2013).
ADS CAS Статья Google Scholar
Пейкер, А., Рокс, О. и Бастиаенс, П. И. Х. Активация изображений двух изоформ Ras одновременно в одной клетке. ChemBioChem 6 , 78–85 (2005).
ChemBioChem 6 , 78–85 (2005).
CAS Статья Google Scholar
Grant, D. M. et al. Мультиплексированный FRET для изображения нескольких сигнальных событий в живых клетках. Biophys. J. 95 , L69–71 (2008).
CAS Статья Google Scholar
Ниино, Ю., Хотта, К. и Ока, К. Одновременная визуализация живых клеток с использованием двойных датчиков FRET с одним возбуждающим светом. PLoS One 4 , e6036 (2009 г.).
ADS Статья Google Scholar
Борнфельдт, К. Э. и Кребс, Э. Г. Перекрестные помехи между протеинкиназой А и сигнальными путями рецептора фактора роста в гладкой мышце артерии. Ячейка. Сигнал. 11 , 465–477 (1999).
CAS Статья Google Scholar
Чардиелло, Ф. & Tortora, G. Взаимодействие между рецептором эпидермального фактора роста и протеинкиназой A типа I: биологическое значение и терапевтическое значение. Clin. Cancer Res. 4 , 821–828 (1998).
& Tortora, G. Взаимодействие между рецептором эпидермального фактора роста и протеинкиназой A типа I: биологическое значение и терапевтическое значение. Clin. Cancer Res. 4 , 821–828 (1998).
CAS PubMed Google Scholar
О’Нил, Э. и Колч, В. Обсуждение специфичности в отношении повсеместного пути передачи сигналов Raf / MEK. руб. J. Cancer 90 , 283–288 (2004).
Артикул Google Scholar
Ван З.и другие. Rap1-опосредованная активация киназ, регулируемых внеклеточными сигналами, с помощью циклического AMP зависит от режима активации Rap1. Мол. Клетка. Биол. 26 , 2130–2145 (2006).
CAS Статья Google Scholar
McPhillips, F. et al. Raf-1 является преобладающей изоформой Raf, которая опосредует стимулируемый фактором роста рост в раковых клетках яичников. Канцерогенез 27 , 729–739 (2006).
Канцерогенез 27 , 729–739 (2006).
CAS Статья Google Scholar
Wu, X., Noh, S.J., Zhou, G., Dixon, J. E. & Guan, K. L. Селективная активация MEK1, но не MEK2, A-Raf из клеток Hela, стимулированных эпидермальным фактором роста. J. Biol. Chem. 271 , 3265–3271 (1996).
CAS Статья Google Scholar
Sipieter, F. et al. Новый репортер для достоверного мониторинга динамики ERK2 в живых клетках и модельных организмах. PLoS One 10 , e0140924 (2015).
Артикул Google Scholar
Падилья-Парра, С. и Трамье, М. Микроскопия FRET в живой клетке: различные подходы, сильные и слабые стороны. BioEssays 34 , 369–376 (2012).
Артикул Google Scholar
Пяткевич К. Д. и др. Мономерные красные флуоресцентные белки с большим стоксовым сдвигом. Proc. Natl. Акад. Sci. США 107 , 5369–5374 (2010).
Д. и др. Мономерные красные флуоресцентные белки с большим стоксовым сдвигом. Proc. Natl. Акад. Sci. США 107 , 5369–5374 (2010).
ADS CAS Статья Google Scholar
Щербакова Д. М., Верхуша В. В. Флуоресцентные белки ближнего инфракрасного диапазона для многоцветной визуализации in vivo . Nat. Методы 10 , 751–754 (2013).
CAS Статья Google Scholar
Padilla-Parra, S., Одуж, Н., Коппи-Мойзан, М. и Трамье, М. Количественный анализ FRET с помощью быстрого сбора данных FLIM во временной области с высоким пространственным разрешением в живых клетках. Biophys. J. 95 , 2976–2988 (2008).
CAS Статья Google Scholar
Количественная коэкспрессия белков на уровне отдельной клетки — применение к мультимерному датчику FRET
Аннотация
Фон
Коэкспрессия белков обычно достигается путем введения двух (или более) независимых плазмид в клетки, каждая из которых управляет экспрессией другого представляющего интерес белка.Однако относительные уровни экспрессии могут сильно различаться между отдельными клетками и не могут контролироваться. В идеале коэкспрессия происходит при определенном соотношении, которое является постоянным среди клеток. Эта функция особенно важна для количественных исследований отдельных ячеек, особенно тех, которые используют бимолекулярные датчики Фёрстеровского резонансного переноса энергии (FRET).
Методология / основные выводы
Были выбраны четыре стратегии коэкспрессии, основанные на котрансфекции, плазмида с двойным промотором, внутренний сайт входа в рибосомы (IRES) и вирусный пептид 2A.Была проведена количественная оценка совместной экспрессии двух спектрально разделяемых флуоресцентных белков в отдельных живых клетках. Показано, что пептидная стратегия 2А может использоваться для устойчивой эквимолярной коэкспрессии, в то время как последовательность IRES допускает экспрессию двух белков в соотношении приблизительно 3: 1. Комбинированные элементы 2A и IRES были использованы для создания единой плазмиды, которая управляет экспрессией трех отдельных белков, которая генерирует датчик FRET для измерения активации гетеротримерного G-белка.Плазмида управляет коэкспрессией донорных и акцепторных субъединиц с пониженной гетерогенностью и может использоваться для измерения активации G-белка в отдельных живых клетках.
Выводы / Значение
Количественная коэкспрессия двух или более белков может быть достигнута при небольшой межклеточной изменчивости. Это открытие делает возможным надежную совместную экспрессию меченных донором и акцептором белков для исследований FRET, что имеет особое значение для разработки новых бимолекулярных сенсоров, которые могут быть экспрессированы из одной плазмиды.
Образец цитирования: Goedhart J, van Weeren L, Adjobo-Hermans MJ, Elzenaar I., Hink MA, Gadella TW Jr (2011) Количественная коэкспрессия белков на уровне отдельных клеток — применение к мультимерному датчику FRET. PLoS ONE 6 (11): e27321. https://doi.org/10.1371/journal.pone.0027321
Редактор: Анна Мария Дельпрато, Европейский институт химии и биологии, Франция
Поступила: 30 мая 2011 г .; Одобрена: 13 октября 2011 г .; Опубликовано: 17 ноября 2011 г.
Авторские права: © 2011 Goedhart et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Эта работа была поддержана инвестиционным грантом Middelgroot (834.09.003) Нидерландской организации научных исследований (NWO). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Генетически закодированные биосенсоры на основе резонансной передачи энергии Фёрстера (FRET) открыли новое понимание пространственных и временных аспектов белковых взаимодействий или конформаций в большом разнообразии клеточных процессов [1], [2]. Эти сенсоры часто состоят из двух взаимодействующих белков или белка и взаимодействующего домена, зажатого между донорным и акцепторным флуорофором.Изменения во взаимодействии или конформации приводят к FRET, который количественно оценивается и используется для считывания. Мономолекулярные сенсоры являются предпочтительными, поскольку (i) они экспрессируются из одной плазмиды и (ii) соотношение YFP и CFP является постоянным среди клеток, что упрощает количественную оценку FRET [3]. Однако мономолекулярные сенсоры требуют, чтобы два взаимодействующих белка или домена были физически связаны, что не всегда возможно из-за структурных ограничений или посттрансляционных модификаций на C- или N-конце [4].В таких случаях два взаимодействующих белка, слитых с донорными и акцепторными флуорофорами, необходимо экспрессировать отдельно. Преимущество бимолекулярных сенсоров состоит в том, что динамический диапазон потенциально больше, поскольку белки физически разделены в отсутствие взаимодействия и, следовательно, нет базового FRET в невзаимодействующем состоянии [5], [6], [7] .
Для достижения совместной экспрессии (флуоресцентных) белков в одной клетке белки обычно экспрессируются из отдельных плазмид, которые просто смешиваются в процедуре трансфекции.Основным недостатком этого подхода является то, что белки экспрессируются в широком диапазоне соотношений, а субпопуляция клеток экспрессирует только одну из двух конструкций, что затрудняет исследования FRET. Другой недостаток состоит в том, что для развития стабильно экспрессирующих клеток или организмов требуется по крайней мере два независимых события трансформации, практически без какого-либо контроля над соотношением донор-акцептор. Чтобы решить эти проблемы, мы решили оценить эффективность нескольких стратегий надежной коэкспрессии белков в определенном соотношении в отдельных живых клетках.Мы обнаружили, что IRES и вирусные пептиды 2A можно использовать для совместной экспрессии белков в фиксированном соотношении на уровне отдельных клеток.
Впоследствии мы использовали эти стратегии для достижения экспрессии мультимолекулярного сенсора FRET, который измеряет активацию гетеротримерного комплекса G-белка из одной плазмиды. Датчик FRET состоит из трех белков (Gαq с меткой CFP, Gβ с меткой YFP и Gγ с меткой YFP), которые ранее экспрессировались с использованием трех отдельных плазмид [4]. Была достигнута устойчивая коэкспрессия субъединиц, меченных CFP и YFP, из одной плазмиды, и ее использовали для измерения активации G-белка в отдельных живых клетках с ограниченными межклеточными вариациями в соотношении FRET.
РезультатыНекоторые стратегии позволяют коэкспрессировать белки в (близком) эквимолярном соотношении, как это было проанализировано с помощью биохимических анализов на популяциях клеток. Поскольку неясно, как эти стратегии работают в отдельных клетках, мы решили коэкспрессировать два почти идентичных репортерных белка CFP и YFP (на 98,6% идентичны на уровне нуклеотидов и на 97,5% на уровне белка), используя несколько стратегий, и оценить их эффективность на уровне одноклеточный уровень. Сначала проводили обычное смешивание равных количеств плазмиды, кодирующей соответственно вариант CFP mTurquoise [8] и вариант YFP mVenus (L68V) [9], с последующей трансфекцией.Количественная оценка флуоресценции отдельных клеток в каналах CFP и YFP показала заметную гетерогенность в соотношении экспрессии CFP и YFP (, фиг. 1A, ). Эти результаты согласуются с предыдущими наблюдениями, и предполагается, что изменение вызвано ограниченным количеством плазмид, которые в конечном итоге окажутся в ядре [10].
Рис. 1. Характеристика различных стратегий коэкспрессии путем количественной оценки синего флуоресцентного белка и желтого флуоресцентного белка флуоресценции из отдельных клеток.
Анализируются четыре различных стратегии коэкспрессии: смешивание двух плазмид (A), двух промоторов на одной плазмиде (B), внутреннего сайта входа в рибосому (C) и последовательности пептида, расщепляемого вирусом 2A (D). В верхнем ряду схематично изображены использованные плазмиды. Вторая и третья строки показывают анализ флуоресценции CFP по сравнению с флуоресценцией YFP на основе отдельных клеток (в произвольных единицах) в двух возможных ориентациях. Точки представляют данные об интенсивности флуоресценции для одной клетки. Набор данных был помещен в линейную линию в качестве наглядного пособия.На графике показан квадрат коэффициента корреляции r 2 .
https://doi.org/10.1371/journal.pone.0027321.g001
Мы пришли к выводу, что экспрессия CFP и YFP из одной плазмиды дает клетки, коэкспрессирующие белки в постоянном соотношении. Сначала была протестирована плазмида с двойным промотором, предназначенная для экспрессии двух индивидуальных белков. Экспрессия CFP и YFP управлялась промоторами CMV и EF-1alpha соответственно. Анализ флуоресценции CFP по сравнению с YFP показал поразительную гетерогенность, которая была подобна той, которая наблюдалась при стратегии смешения плазмид (, фиг. 1B, ).
Последовательность IRES широко используется для совместной экспрессии двух белков с одного промотора. Было известно, что уровень белка, транслируемого с последовательности IRES, ослаблен по сравнению с уровнем экспрессии белка, расположенного выше по течению. Относительное содержание двух белков зависит от используемой последовательности IRES. Сообщается, что ECMV IRES относительно эффективен как при биохимическом анализе с антителами, так и на живых клетках с использованием флуоресцентной микроскопии [11]. Таким образом, ECMV IRES был протестирован в эксперименте по совместной экспрессии.Совместная экспрессия CFP и YFP наблюдалась во всех проанализированных клетках, и уровень белка, экспрессируемого IRES, был снижен. Важно отметить, что существует сильная корреляция между экспрессией CFP и YFP на уровне отдельных клеток ( Рисунок 1C, ).
Вирусные пептиды 2A представляют собой пептидные последовательности из примерно 20 аминокислот, которые используются вирусами для экспрессии двух белков на равных уровнях [12], [13]. Гипотеза заключается в том, что рибосома останавливается во время трансляции, что приводит к неэффективному образованию пептидной связи.Рибосома продолжается, и, следовательно, образуются два отдельных белка вместе с небольшой фракцией слитого белка. Чтобы исследовать, можно ли использовать эту стратегию для совместной экспрессии флуоресцентных белков, мы слили CFP и YFP с пептидным линкером 2A в двух возможных ориентациях, то есть CFP-2A-YFP и YFP-2A-CFP. В качестве контроля была представлена неразборная версия (CFP-XX-YFP и YFP-XX-CFP). Анализ коэкспрессии показал отличную корреляцию между экспрессией CFP и YFP в отдельных клетках (, рис. 1D, ), без явной зависимости от ориентации CFP и YFP.
Разделение белков определяли количественной оценкой эффективности FRET с помощью микроскопии визуализации времени жизни флуоресценции (FLIM). В случае слитого белка должна быть эффективная FRET между CFP и YFP, на что указывает уменьшенное время жизни CFP в возбужденном состоянии, в то время как FRET не ожидается, когда молекулы CFP и YFP не связаны. Действительно, мы наблюдали сокращение срока службы неразъемных элементов управления с эффективностью FRET около 20%. Разделяемые версии, CFP-2A-YFP и YFP-2A-CFP, не показали уменьшения срока службы CFP, что указывает на отсутствие FRET (, таблица 1, ), что согласуется с предыдущими наблюдениями [13].Отсутствие FRET указывает на эффективное разделение CFP и YFP.
Установив, что и IRES, и стратегия вирусного пептида 2A могут использоваться для экспрессии двух белков с сильной корреляцией между их соответствующими уровнями экспрессии, мы определили относительные концентрации этих двух белков. Поскольку сделать это точно с помощью флуоресцентной микроскопии довольно сложно, мы решили использовать FCS для клеточных экстрактов, поскольку он позволяет количественно определить количество флуоресцентных молекул в калиброванном элементе объема.В случае FRET количество молекул донора будет уменьшено, но это не повлияет на количество молекул, которые обнаруживаются в элементе объема.
Мы обнаружили стехиометрическую экспрессию CFP и YFP, когда неразделимые слияния CFP-XX-YFP и YFP-XX-CFP были проанализированы, что свидетельствует о полном созревании обоих белков. Последующий анализ конструкций CFP-2A-YFP и YFP-2A-CFP выявил равную экспрессию CFP и YFP (, таблица 2, ). Анализ взаимной корреляции с помощью FCCS [14] сигналов CFP и YFP показал существенный сигнал для неотделимого контроля CFP-YFP, указывающий на присутствие слитого белка, в то время как в конструкциях 2A и конструкциях IRES не было обнаружено взаимной корреляции, что указывает на экспрессию отдельных белков (данные не показаны).
В случае анализа FCS CFP и YFP, экспрессируемых из плазмид с IRES, наблюдалась четкая ориентационная зависимость с 2,5–3-кратным повышением кэп-зависимой экспрессии флуоресцентного белка по сравнению с нижележащим флуоресцентным белком, который экспрессируется из IRES ( Таблица 2 ). Вместе наши результаты показывают, что последовательности 2A и IRES могут использоваться для совместной экспрессии белков в определенном соотношении в отдельных клетках.
Гетеротримерные белки G состоят из трех субъединиц Gα, Gβ и Gγ в комплексе 1∶1∶1 [15].Несколько групп, включая нашу, показали, что котрансфекция флуоресцентно меченных субъединиц G-белка из трех отдельных плазмид, управляющих экспрессией Gα, Gβ и Gγ, дает гетеротримерный комплекс G-белка. Более того, активацию G-белка можно отслеживать в отдельных клетках с помощью визуализации соотношения FRET [16], [17], [18], [19]. Однако, как наблюдается в любом эксперименте по котрансфекции, флуоресценция CFP по сравнению с YFP широко варьирует в зависимости от субпопуляции, экспрессирующей только одну из двух субъединиц, меченных флуоресцентным белком (, фиг. S1, ).Чтобы облегчить это ограничение, мы исследовали, можно ли экспрессировать три белка из одной плазмиды с использованием вышеупомянутых стратегий. Сначала Gβ1 был связан через вирусный пептид 2A с YFP-Gγ2. Бокс CaaX на C-конце Gγ2 необходим для модификации липидов и не переносит дополнительных аминокислот, что препятствует использованию последовательности 2A в этом сайте. Поэтому мы решили сконструировать плазмиду, которая экспрессирует Gβ1-2A-YFP-Gγ2. Поскольку линкерный пептид 2A может вводить некоторый неотделенный продукт, мы сравнили коэкспрессию Gβ1 и YFP-Gγ2 из отдельных плазмид и из плазмид, экспрессирующих Gβ1-2A-YFP-Gγ2 и неотделимый контроль, Gβ1-XX-YFP. -Gγ2.Локализация с помощью конфокальной микроскопии (, фиг. 2A, ) и вестерн-блоттинга (, фиг. 2B, ) показала, что экспрессия YFP-Gγ2 была неразличима, когда экспрессию отдельных плазмид сравнивали с экспрессией из одного Gβ1-2A-YFP-Gγ2. Обе стратегии экспрессии дали четкую локализацию YFP-Gγ2 на плазматической мембране, помимо некоторого эндомембранного мечения (, фиг. 2A, ). Напротив, неотделимый контроль локализован на эндомембранах, и не наблюдается мечения плазматической мембраны.Кроме того, он плохо выражен (данные не показаны), возможно, из-за быстрой деградации. Кроме того, вестерн-блоттинг обнаруживает слабую высокомолекулярную полосу в образце, который был трансфицирован неотделимой версией Gβ1-XX-YFP-Gγ2 (, фиг. 2B, ). Молекулярная масса соответствует размеру белка, состоящего из Gβ1, слитого с YFP-Gγ2, как и ожидалось от нерасщепляемой последовательности 2A. Низкая интенсивность согласуется с низким уровнем флуоресценции, наблюдаемой в клетках.
Рисунок 2.Анализ коэкспрессии Gβ1 и YFP-Gγ2 из одной плазмиды или отдельных плазмид.
(A) Три репрезентативных изображения локализации YFP-Gγ2 с помощью конфокальной микроскопии, экспрессированных из плазмиды, кодирующей Gβ1-2A-YFP-Gγ2, Gβ1-XX-YFP-Gγ2 или двух отдельных плазмид, Gβ1 + YFP-Gγ2. YFP-Gγ2 локализуется на плазматической мембране и эндомембранах в случае экспрессии Gβ1-2A-YFP-Gγ2 и когда Gβ1 и YFP-Gγ2 коэкспрессируются из отдельных плазмид. Неразделимый контроль Gβ1-XX-YFP-Gγ2 демонстрирует (тусклую) цитоплазматическую и эндомембранную флуоресценцию.Ширина изображений 73 мкм. (B) Вестерн-блоттинг с антителом к GFP подтверждает, что YFP-Gγ2 правильно экспрессируется из плазмиды Gβ1-2A-YFP-Gγ2 и что неотделенный продукт не обнаруживается. Белок, экспрессируемый из Gβ1-XX-YFP-Gγ2, показывает слабую полосу, которая соответствует неотделенному белку.
https://doi.org/10.1371/journal.pone.0027321.g002
Неповрежденные, немодифицированные C- и N-концы необходимы для биофункциональности субъединиц Gα [20] и, следовательно, запрещает использование вирусного пептида 2A.Поэтому мы решили связать экспрессию Gαq-CFP через последовательность IRES с единицей Gβ1-2A-YFP-Gγ2. Мы сконструировали две плазмиды с разной ориентацией: Gα-IRES-Gβ-2A-Gγ и Gβ-2A-Gγ-IRES-Gα. Качественно мы наблюдали улучшенную корреляцию между уровнем экспрессии Gαq-CFP и YFP-Gγ2 для клеток, которые экспрессировали меченые субъединицы из этих плазмид, по сравнению с экспрессией из отдельных плазмид (, фиг.3A, ). Более того, как Gαq-CFP, так и YFP-Gγ2 экспрессировались во всех клетках и правильно локализовались на плазматической мембране.Количественный анализ, в котором флуоресценция YFP по сравнению с флуоресценцией CFP измерялась для YFP-Gγ и Gαq-CFP соответственно, показывает улучшенную корреляцию для систем с одной плазмидой. Наибольшая корреляция между интенсивностью CFP и YFP (r 2 = 0,5) наблюдалась для плазмиды, которая экспрессирует Gβ-2A-Gγ-IRES-Gα (, фиг. S1 ). Следует отметить, что интенсивность флуоресценции CFP в этом эксперименте снижается FRET, и что клеточная аутофлуоресценция вносит вклад как в канал CFP, так и в канал YFP из-за низкой экспрессии субъединиц G-белка.Следовательно, измеренные интенсивности коррелируют с количеством молекул, но не могут быть преобразованы в количество молекул.
Рисунок 3. Характеристика сенсора FRET для мониторинга активации G-белка, экспрессируемого из одной плазмиды или нескольких плазмид.
(A) Gαq-CFP, немаркированный Gβ1 и YFP-Gγ2 были экспрессированы либо путем смешивания трех отдельных плазмид (Gα + Gβ + Gγ), либо из одной плазмиды в двух ориентациях, Gα-IRES-Gβ-2A-Gγ и Gβ. -2A-Gγ-IRES-Gα соответственно. Показаны флуоресцентные изображения клеток, показывающие локализацию и уровни экспрессии Gαq-CFP и YFP-Gγ2.Ширина изображений 177 мкм. (B) Данные визуализации соотношения FRET (возбуждение CFP и измерение YFP по отношению к интенсивности CFP), показывающие изменение среднего соотношения во времени в процентах (сплошная линия) и s.e.m. (серый цвет) клеток, трансфицированных Gα + Gβ + Gγ (n = 13), Gα-IRES-Gβ-2A-Gγ (n = 12) и Gβ-2A-Gγ-IRES-Gα (n = 12). Среднее (± sem) начальное отношение YFP / CFP, которое мы определили, составляет для Gα + Gβ + Gγ 2,1 ± 0,4, для Gα-IRES-Gβ-2A-Gγ 0,76 ± 0,03 и для Gβ-2A-Gγ-IRES-Gα, 1,5 ± 0,1. Клетки HeLa стимулировали 100 мкМ гистамина (t = 20 с), и ответ обращали, добавляя антагонист пириламин (t = 60 с).
https://doi.org/10.1371/journal.pone.0027321.g003
Образование гетеротримеров исследовали путем количественной оценки эффективности FRET с помощью FLIM. FLIM обеих конструкций показал уменьшенное время жизни, что указывает на образование гетеротримерного комплекса (, таблица 3, ). Эффективность FRET конструкции Gβ-2A-Gγ-IRES-Gα была почти вдвое выше по сравнению с конструкцией с обратной ориентацией, Gα-IRES-Gβ-2A-Gγ. Эффективность FRET Gβ-2A-Gγ-IRES-Gα, основанная на времени жизни фазы 27%, была аналогична эффективности FRET, о которой сообщалось ранее при трансфекции отдельных плазмид [4].
Ранее мы использовали пару FRET Gαq-CFP / YFP-Gγ2 для логометрической визуализации для визуализации активации гетеротримерного G-белка. Когда применяется раздельная трансфекция субъединиц, исходное соотношение YFP / CFP широко варьирует между клетками из-за вариации относительного уровня экспрессии Gαq-CFP по сравнению с YFP-Gγ2. Чтобы проверить, является ли соотношение YFP / CFP менее вариабельным в случае экспрессии из одной плазмиды, мы измерили отношения FRET в клетках, трансфицированных Gα-IRES-Gβ-2A-Gγ или Gβ-2A-Gγ-IRES-Gα, и заметили сильно уменьшенная вариация, как следует из уменьшенной стандартной ошибки среднего (, рис. 3В, ).
Мы попытались измерить относительную экспрессию Gαq-CFP и YFP-Gγ2 с помощью FCS на клеточных экстрактах, но уровни флуоресценции были слишком близки к фону. В будущих исследованиях будет рассмотрена стехиометрия комплекса G-белка в отдельных живых клетках.
Затем мы отслеживали активацию G-белка, отслеживая соотношение FRET и стимуляцию клеток гистамином, агонистом рецептора h2. Измерения субъединиц, экспрессируемых из нескольких плазмид, показывают наибольшую вариацию в соотношении, в то время как стратегии с одной плазмидой показывают пониженную гетерогенность (, фиг. 3B, , ). Среднее изменение соотношения было близко к 20% для образца Gα + Gβ + Gγ и Gβ-2A-Gγ-IRES-Gα, тогда как оно составляло только около 10% для образца Gα-IRES-Gβ-2A-Gγ. Более высокое изменение соотношения Gβ-2A-Gγ-IRES-Gα и более высокая начальная эффективность FRET (, таблица 3, ), скорее всего, обусловлены более благоприятным соотношением донор / акцептор. В заключение, мы демонстрируем, что экспрессия мультимерного сенсора FRET для активации гетеротримерного G-белка из одной плазмиды снижает гетерогенность в соотношении FRET между клетками, сохраняя при этом высокий динамический диапазон.
Обсуждение
Здесь мы демонстрируем, что котрансфекция двух независимых плазмид приводит к совместной экспрессии двух белков с высокими межклеточными вариациями в относительном уровне экспрессии. Подобная гетерогенность наблюдалась, когда два флуоресцентных белка экспрессировались из одного вектора с двумя промоторами. Следует отметить, что альтернативные векторы, не испытанные в этом исследовании, коммерчески доступны для совместной экспрессии двух белков. Эти отчеты предоставляют метод для тестирования их производительности на уровне отдельной ячейки.Наблюдаемые вариации проблематичны для количественных исследований отдельных клеток, особенно тех, которые используют бимолекулярные или мультимерные датчики FRET.
Два разных подхода, вирусный пептид 2A и последовательность IRES, представляют собой решение. Расщепляемый пептид 2A представляет собой элегантный способ совместной экспрессии нескольких белков на эквимолярных уровнях из одного транскрипта. По крайней мере четыре белка были коэкспрессированы с использованием этой стратегии 2A для индукции плюрипотентных стволовых клеток [21], хотя еще предстоит показать, все ли четыре белка экспрессируются на эквимолярных уровнях в отдельных клетках.Возможным недостатком пептидов 2A является небольшая фракция нерасщепленного белка, что нежелательно и может приводить к ложноположительному FRET, хотя мы не наблюдали неотделенный продукт, когда Gβ1 и Gγ2 совместно экспрессировались из плазмиды, кодирующей Gβ1-. 2A-YFP-Gγ2. Возможно, что количество нерасщепленного белкового продукта меньше в случае меченых белков, поскольку они подвержены деградации и, как правило, менее стабильны, чем немаркированные флуоресцентные белки. Другой вопрос, который следует учитывать, — это модификация N- или C-конца вставленным пептидом.
IRES дает два белка, которые полностью физически разделены и не модифицированы на C- или N-конце. Поскольку белок, расположенный выше по течению, экспрессируется примерно в 3 раза выше, чем белок ниже по течению от IRES, возможно экспрессировать донор и акцептор в соотношении 1: 3 или 3: 1. Мы демонстрируем, что эту особенность можно использовать для настройки эффективности FRET гетеротримеров. Комбинируя последовательности IRES и 2A, мы сконструировали мультимерный датчик FRET для активации G-белка, экспрессируемого из одной плазмиды.Хотя мы показываем, что можем контролировать относительные уровни экспрессии Gαq-CFP и YFP-Gγ2, следует отметить, что у нас нет контроля над скоростью деградации белка и посттрансляционных модификаций, что обычно находится вне контроля экспериментатора. Одиночная плазмида, экспрессирующая Gβ-2A-Gγ-IRES-Gα, показывает лучшее улучшение со сниженной гетерогенностью в соотношении FRET по сравнению с экспрессией из трех отдельных плазмид в сочетании с хорошим диапазоном ответа FRET (изменение 20%) на G -белковая активация.
В совокупности наше исследование показывает, что стратегии, основанные на 2A и IRES, обладают большим потенциалом для количественной совместной экспрессии множества белков с небольшой межклеточной изменчивостью. Эти данные будут полезны для разработки бимолекулярных генетически кодируемых сенсоров FRET, экспрессируемых из одной плазмиды. Этот тип подходов требует несколько более сложных стратегий клонирования, но упростит трансформацию клеток или организмов для стабильной экспрессии множества белков. В целом, надежные подходы коэкспрессии будут важными инструментами для количественных исследований отдельных клеток и для приложений мультиплексирования, в которых необходимо одновременно экспрессировать и визуализировать как можно больше (помеченных) белков.
Методы
Конструкция плазмиды
Для анализа коэкспрессии мы использовали два ярко видимых флуоресцентных белка (VFP), mTurquoise [8] и mVenus (L68V) [9], которые обозначены как CFP и YFP соответственно.
Вектор pBUD-CE4 был от Invitrogen (Breda, Нидерланды) и использует маркер устойчивости к зеоцину. VFP были вырезаны с использованием HindIII и XbaI из вектора VFP-N1 (Clontech) и вставлены позади промотора CMV pBUD, который был разрезан теми же ферментами.
Чтобы вставить VFP ниже EF1a, VFP амплифицировали с использованием 5′-GGAAGATCTCCACCATGGTGAGCAAGG-3 ‘и праймера rv-EF 5′-GGAAGATCTGTCGCGGCCGCTTTACTTG-3’ с плазмой VFP-N1 в качестве матрицы VFP-N1.
Продукт был разрезан с помощью BglII и вставлен в pBud, разрезанный с помощью BglII. Таким образом были изготовлены две конструкции; CMV: CFP-EF1a: YFP и CMV: YFP-EF1a: CFP.
Конструирование плазмид 2A было описано ранее [8]. Линкер 2A вставлен между кодирующими последовательностями VFP, кодирующих пептид EGRGSLLTCGDVEENPGPGS.Две плазмиды сконструированы CFP-2A-YFP и YFP-2A-CFP. Мутировавший нерасщепляемый линкер кодирует EGRGSLLTCGDVEENAAPGS, и две плазмиды на основе этого линкера обозначены как CFP-XX-YFP и YFP-XX-CFP.
Вектор pPRIG-IRES [11], который несет последовательность ECMV IRES, был получен от Патрика Мартина. Последовательность IRES амплифицировали с помощью ПЦР с использованием праймера fw-IRES 5′-CTAGCTAGCGCCACCATGGAGATCTGGGCCCCTATAGTGTCAC-3 ‘и праймера rv-IRES 5′-CGCGGATCCGGTTGTGGCCATATTATC-3’. Вектор Clontech-C1 и амплифицированный IRES разрезали с использованием рестрикционных ферментов NheI и BamHI и лигировали.VFP вырезали из вектора pBUD с использованием BglII и лигировали перед IRES и вырезали из плазмидного вектора 2A с использованием BamHI и лигировали ниже IRES. Были созданы две конструкции CFP-IRES-YFP и YFP-IRES-CFP.
Gαq-mTurquoiseΔ6, Gβ1 и YFP-Gγ2 были описаны ранее [4] и использовались в качестве компонентов для одной плазмиды, экспрессирующей эти три белка. Клонирование плазмид, экспрессирующих Gβ1-2A-YFP-Gγ2 и Gβ1-XX-YFP-Gγ2, основано на ПЦР. Впоследствии были сконструированы две плазмиды, кодирующие либо Gαq-mTurquoiseΔ6-IRES-Gβ1-2A-YFP-Gγ2 (Gα-IRES-Gβ-2A-Gγ), либо Gβ1-2A-YFP-Gγ2-IRES-Gαq-mTurquoiseΔ6 (Gβ-2A- Gγ-IRES-Gα).Последовательности и подробные процедуры построения этих плазмид доступны по запросу.
Культура клеток и трансфекция
клеток HeLa были получены из Американской коллекции культур тканей (ATCC; Манассас, Вирджиния, США) и культивированы в среде DMEM + глутамакс (Invitrogen, # 61965), 10% FBS, пенициллин (100 Ед / мл) и стрептомицин (100 мкг / мл). мл). Клетки трансфицировали с использованием 1-2 мкл липофектамина (Invitrogen), 0,5 мкг плазмидной ДНК и 50 мкл OptiMEM на чашку 35 мм, содержащую покровное стекло Ø # 1 диаметром 24 мм.
Вестерн-блот
Через два дня после трансфекции клетки из одной лунки 6-луночного планшета лизировали добавлением 200 мкл лизирующего буфера (PBS, 1% Triton X-100, 0,5% дезоксихолат натрия, 0,1% додецилсульфат натрия) и собирали соскабливанием. . После центрифугирования 15 мкл супернатанта использовали для SDS-PAGE. Иммуномечение проводили с использованием 1-2000 антиGFP-сыворотки (Invitrogen, A6455) и 1-10 000 козьего анти-кроличьего IgG (H&L) -HRP конъюгата (Biorad, 170-6516) в качестве вторичных антител.Обнаружение проводили с помощью системы обнаружения вестерн-блоттинга Amersham (GE Healthcare RPN2132) и Hyperfilm ECL (288).
Флуоресцентная визуализация
Покровные стекла с клетками помещали в камеру для клеток Attofluor (Invitrogen) и погружали в среду для микроскопии (20 мМ HEPES (pH = 7,4), 137 мМ NaCl, 5,4 мМ KCl, 1,8 мМ CaCl 2 , 0,8 мМ MgCl 2 и 20 мМ глюкозы). Эксперименты по визуализации флуоресценции проводили на инвертированном флуоресцентном микроскопе Zeiss 200M с использованием Zeiss Plan-Neofluar 40 × / 1.30 Ph4 масляный объектив. Свет возбуждения от ксеноновой дуговой лампы Cairn отбирался с помощью монохроматора (Cairn Research). Для голубого флуоресцентного белка использовали возбуждающий свет 420 нм (щель 30 нм), а в случае желтых флуоресцентных белков применяли возбуждающий свет 500 нм (щель 30 нм). Дополнительная фильтрация проводилась с помощью фильтра возбуждения CFP E460SP (375-460) и фильтра возбуждения YFP E520SP (375–520). Дихроичное зеркало 455DCLP и эмиссионный фильтр BP470 / 30 использовали для CFP, а дихроичное зеркало 515DCXR и эмиссионный фильтр BP535 / 30 использовали для флуоресценции YFP.Программное обеспечение Metamorph использовалось для управления оборудованием. Время экспозиции обычно составляло 100 мс для канала CFP и 50 мс для канала YFP. Получение изображений отношения FRET было выполнено при 37 ° C, как описано ранее, по крайней мере на 3 различных образцах [4].
Данные визуализации с соотношениемFRET были обработаны с помощью ImageJ (http://rsbweb.nih.gov/ij/) путем количественного определения средней интенсивности флуоресценции отдельных клеток в канале CFP и YFP и вычитания фона, полученного из интересующей области без клетки.Эти данные интенсивности использовали для расчета отношения YFP / CFP. Отношение кривых времени по крайней мере для 12 ячеек не нормализовалось, а непосредственно усреднялось, и вычислялась стандартная ошибка среднего. Впоследствии данные были масштабированы для отображения изменения отношения FRET в процентах. Эта процедура использовалась для изображения неоднородности измеренных нами соотношений и несколько отличается от обычно выполняемой процедуры обработки, в которой гетерогенность и сворачивание / созревание флуоресцентных белков компенсируется нормализацией отдельных следов CFP и YFP [ 4], [22], [23].
FLIM выполняли, как описано ранее [4], при комнатной температуре.
Коррекция и анализ изображения
Флуоресцентные изображениядля количественного анализа совместной экспрессии были скорректированы по фону и затем скорректированы на затенение с использованием однородного флуоресцентного пластикового предметного стекла (Chroma). Интенсивность флуоресценции отдельных клеток определяли количественно путем построения ROI и измерения средней интенсивности флуоресценции как в каналах CFP, так и в YFP (в произвольных единицах). Все исправления и анализы были выполнены с использованием программного обеспечения ImageJ с плагином ObjectJ и макросами.Графики и аппроксимации средней CFP по сравнению с интенсивностью YFP отдельных клеток были сделаны с помощью KaleidaGraph. Коэффициент корреляции определяли с помощью Excel (функция RSQ).
FCS
Экстрактыклеток были свежеприготовлены из отдельных лунок 6-луночного планшета. Трансфицированные клетки дважды промывали холодным PBS. Клетки лизировали холодным 300 мкл PBS + 1% (об. / Об.) Triton X-100. После центрифугирования (5 мин при 16000 g) собирали 200 мкл супернатанта и экстракты разбавляли в 10–20 раз PBS + 0.01% Тритон Х-100.
Измерения выполняли в 96-луночных планшетах со стеклянным дном (Whatman), помещенных поверх перевернутого лазерного сканирующего микроскопа Fluoview 1000 (Olympus), оборудованного погруженным в воду объективом 60x UPLSApo (NA 1.2). Свет импульсного лазерного диода 440 нм (Picoquant), работающего на частоте 20 МГц, был объединен с линией 514 нм непрерывного лазера Ar + (Melles-Griot) с использованием куба поляризующего луча на пути возбуждения. Через главное дихроичное зеркало 440/514/594 (Chroma) излучаемый свет направлялся через отверстие регулируемого размера в конфокальном блоке обнаружения Olympus в направлении выходного канала волокна.Оптическое волокно было подключено к заказному блоку обнаружения (Picoquant), содержащему два лавинных фотодиодных детектора (MPD). Дихроичное зеркало LP515 (Semrock) было помещено на пути луча для разделения испускаемого света, а эмиссионные фильтры 475/42 (CFP) и 534/30 (YFP) (Semrock) были помещены перед детекторами. Время прихода фотонов регистрировалось прибором Picoharp 300 (Picoquant).
Перед корреляцией сигналов детектора следы необработанных данных были синхронизированы по времени в SymPhoTime 5.1.3 (Picoquant) для предотвращения перекрестных помех красителей. Фотоны, приходящие в канал CFP в течение 25 нс после импульса возбуждения 440 нм, считались истинным сигналом CFP, в то время как фотоны, поступающие в канал YFP через 25–50 нс после импульса возбуждения 440 нм, вносят вклад в сигнал YFP. Сигналы были автокоррелированы, и полученные кривые были проанализированы с помощью стандартной модели триплетной диффузии [24] для получения числа частиц. Контрольные эксперименты проводились с растворами Atto425 (D = 410 м 2 .s −1 ) и Alexa 488 (D = 400 м 2 . s -1 ) для калибровки размера и перекрытия объемов обнаружения CFP, YFP. Полученные числа частиц были скорректированы на фоновый сигнал [24].
Дополнительная информация
Рисунок S1.
Количественный анализ коэкспрессии YFP-Gγ2 по сравнению с Gαq-CFP. Показаны результаты для трех разных плазмид: Gα + Gβ + Gγ (r 2 = 0,004), Gα-IRES-Gβ-2A-Gγ (r 2 = 0.03) и Gβ-2A-Gγ-IRES-Gα (r 2 = 0,5). Значения r 2 в скобках представляют собой квадрат коэффициента корреляции. Точки представляют данные об интенсивности флуоресценции для одной клетки. Набор данных был помещен в линейную линию в качестве наглядного пособия.
https://doi.org/10.1371/journal.pone.0027321.s001
(TIF)
Благодарности
Мы благодарим сотрудников нашей лаборатории за полезные обсуждения и Marten Postma за его помощь в анализе данных.
Вклад авторов
Задумал и спроектировал эксперименты: JG TWJG. Выполнял эксперименты: JG LvW MJWA IE MAH. Проанализированы данные: JG LvW IE MAH. Написал статью: JG TWJG.
Список литературы
- 1. Чудаков Д.М., Лукьянов С., Лукьянов К.А. (2005) Флуоресцентные белки как инструментарий для визуализации in vivo. Trends Biotechnol 23: 605–613.
- 2. Чжан Дж., Кэмпбелл Р. Э., Тинг А. Ю., Цзян Р. Ю. (2002) Создание новых флуоресцентных зондов для клеточной биологии.Nat Rev Mol Cell Biol 3: 906–918.
- 3. Miyawaki A (2003) Визуализация пространственной и временной динамики внутриклеточной передачи сигналов. Dev Cell 4: 295–305.
- 4. Adjobo-Hermans MJ, Goedhart J, van Weeren L, Nijmeijer S, Manders EM, et al. (2011) Визуализация в реальном времени активации гетеротримерного G-белка Gq в живых клетках. BMC Biology 9: 32.
- 5. Мияваки А., Ллопис Дж., Хейм Р., Маккаффери Дж. М., Адамс Дж. А. и др. (1997) Флуоресцентные индикаторы Ca2 + на основе зеленых флуоресцентных белков и кальмодулина.Nature 388: 882–887.
- 6. van der Wal J, Habets R, Varnai P, Balla T, Jalink K (2001) Мониторинг индуцированной агонистом активации фосфолипазы C в живых клетках с помощью флуоресцентного резонансного переноса энергии. J Biol Chem 276: 15337–15344.
- 7. Мияваки А. (2011) Разработка зондов для клеточных функций с использованием флуоресцентных белков и передачи энергии флуоресцентного резонанса. Анну Рев Биохим.
- 8. Goedhart J, van Weeren L, Hink MA, Vischer NO, Jalink K и др.(2010) Ярко-голубые флуоресцентные варианты белков, идентифицированные с помощью скрининга времени жизни флуоресценции. Nat Методы 7: 137–139.
- 9. Kremers GJ, Goedhart J, van Munster EB, Gadella TW Jr (2006) Голубые и желтые суперфлуоресцентные белки с улучшенной яркостью, сворачиванием белка и радиусом Форстера FRET. Биохимия 45: 6570–6580.
- 10. Schwake G, Youssef S, Kuhr JT, Gude S, David MP, et al. (2010) Прогностическое моделирование невирусного переноса генов. Biotechnol Bioeng 105: 805–813.
- 11. Martin P, Albagli O, Poggi MC, Boulukos KE, Pognonec P (2006) Разработка нового бицистронного ретровирусного вектора с сильной активностью IRES. BMC Biotechnol 6: 4.
- 12. de Felipe P (2004) Пропуск проблемы коэкспрессии: новая технология 2A «CHYSEL». Genet Vaccines Ther 2: 13.
- 13. Шимчак А.Л., Уоркман С.Дж., Ван Й., Виньяли К.М., Дилиоглу С. и др. (2004) Коррекция мультигенного дефицита in vivo с использованием одного ретровирусного вектора на основе «саморасщепляющегося» пептида 2А.Nat Biotechnol 22: 589–594.
- 14. Haustein E, Schwille P (2007) Флуоресцентная корреляционная спектроскопия: новые вариации установленной техники. Анну Рев Биофиз Биомол Структура 36: 151–169.
- 15. Wettschureck N, Offermanns S (2005) G-белки млекопитающих и их специфичные для клеточного типа функции. Physiol Rev 85: 1159–1204.
- 16. Bunemann M, Frank M, Lohse MJ (2003) Активация белка Gi в интактных клетках связана с перестройкой субъединиц, а не с диссоциацией.Proc Natl Acad Sci U S A 100: 16077–16082.
- 17. Гибсон С.К., Гилман А.Г. (2006) Субъединицы Gialpha и Gbeta определяют селективность активации G-белка альфа2-адренорецепторами. Proc Natl Acad Sci U S A 103: 212–217.
- 18. Janetopoulos C, Jin T, Devreotes P (2001) Опосредованная рецептором активация гетеротримерных G-белков в живых клетках. Наука 291: 2408–2411.
- 19. Jensen JB, Lyssand JS, Hague C, Hille B (2009) Изменения флуоресценции показывают кинетические этапы модуляции фосфоинозитидов и Kv7, опосредованной мускариновыми рецепторами.2 / 7,3 тыс. + Каналов. J Gen Physiol 133: 347–359.
- 20. Hughes TE, Zhang H, Logothetis DE, Berlot CH (2001) Визуализация функционального слияния флуоресцентного белка Galpha q-green в живых клетках. Связь с плазматической мембраной нарушается мутационной активацией и устранением сайтов пальмитоилирования, но не активацией, опосредованной рецепторами или AlF4. J Biol Chem 276: 4227–4235.
- 21. Каджи К., Норрби К., Пака А., Милейковский М., Мохсени П. и др.(2009) Безвирусная индукция плюрипотентности и последующее удаление факторов репрограммирования. Природа 458: 771–775.
- 22. Gallegos LL, Kunkel MT, Newton AC (2006) Нацеливание репортера активности протеинкиназы C на дискретные внутриклеточные области выявляет пространственно-временные различия в агонист-зависимой передаче сигналов. J Biol Chem 281: 30947–30956.
- 23. Verbeek DS, Goedhart J, Bruinsma L, Sinke RJ, Reits EA (2008) Гамма-мутации PKC при спиноцеребеллярной атаксии типа 14 влияют на доступность домена C1 и активность киназы, приводя к аберрантной передаче сигналов MAPK.J Cell Sci 121: 2339–2349.
- 24. Maeder CI, Hink MA, Kinkhabwala A, Mayr R, Bastiaens PI, et al. (2007) Пространственная регуляция активности киназы Fus3 MAP посредством механизма реакции-диффузии в передаче сигналов феромона дрожжей. Nat Cell Biol 9: 1319–1326.
Разработка быстродействующих флуоресцентных белковых датчиков напряжения путем оптимизации взаимодействий FRET
Abstract
Датчики напряжения белков на основе FRET (Förster Resonance Energy Transfer) могут быть полезны для мониторинга активности нейронов in vivo , поскольку соотношение сигналов между донорной и акцепторной парой снижает общие источники шума, такие как артефакты сердечного ритма.Мы улучшили работу датчиков напряжения на основе генетически кодируемого флуоресцентного белка (FP) на основе FRET, оптимизировав расположение донорных и акцепторных FP, фланкирующих чувствительный к напряжению домен Ciona Кишечник чувствительной к напряжению фосфатазы. Во-первых, мы создали 39 различных конструкций «Nabi1», разместив донорную FP, UKG, в 8 различных местах ниже по потоку от домена, чувствительного к напряжению, и акцепторную FP, mKO, в 6 положениях выше по потоку. Некоторые из этих комбинаций привели к большим сигналам, зависящим от напряжения, и относительно быстрой кинетике.Зонды Nabi1 ответили размером сигнала до 11% ΔF / F для деполяризации 100 мВ и быстрых констант времени отклика как для активации сигнала (~ 2 мс), так и для затухания сигнала (~ 3 мс). Мы улучшили экспрессию в нейрональных клетках, заменив пару mKO и UKG FRET на Clover (донор FP) и mRuby2 (акцептор FP) для создания зондов Nabi2. Зонды Nabi2 также имели большие сигналы и относительно быстрые постоянные времени в клетках HEK293. В первичной культуре нейронов зонд Nabi2 был способен дифференцировать индивидуальные потенциалы действия при 45 Гц.
Образец цитирования: Sung U, Sepehri-Rad M, Piao HH, Jin L, Hughes T, Cohen LB, et al. (2015) Разработка быстрых флуоресцентных белковых датчиков напряжения путем оптимизации взаимодействий FRET. PLoS ONE 10 (11): e0141585. https://doi.org/10.1371/journal.pone.0141585
Редактор: Вадим Э. Дегтяр, Калифорнийский университет, Беркли, США
Поступила: 6 апреля 2015 г .; Одобрена: 9 октября 2015 г .; Опубликовано: 20 ноября 2015 г.
Авторские права: © 2015 Sung et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника
Доступность данных: Все соответствующие данные находятся в пределах документ и вспомогательные информационные файлы к нему.
Финансирование: Эта работа была поддержана: DC005259 и U24NS057631 из Национального института здравоохранения США; www.nih.gov; программа World Class Institute Корейского национального исследовательского фонда, грант номер WCI 2009-003, www.nrf.re.kr/nrf_eng_cms/.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Разработка генетически закодированных флуоресцентных чувствительных к напряжению зондов может предоставить инструменты для оптического обнаружения нейронной информации на уровне отдельных типов нейронов во взаимосвязанной нейронной сети. Чувствительные к напряжению органические красители обнаруживают изменения мембранного потенциала с размером сигнала, линейно зависящим от напряжения, и со скоростью сигнала, более быстрой по сравнению со временем нарастания потенциала действия [1].Однако использование органических красителей ограничено из-за неспецифичности и низкой доступности типов клеток глубже 250 мкм от поверхности. Напротив, датчики напряжения флуоресцентного белка (FP) могут быть нацелены на отдельные типы клеток глубоко внутри мозга млекопитающих.
Микробные датчики напряжения FP на основе родопсина, такие как Arch, генерируют сигналы с быстрой кинетикой и большим фракционным изменением флуоресценции [2–4]. Однако их использование для визуализации in vivo может быть ограничено их очень тусклой флуоресценцией, которая может быть скрыта из-за собственной флуоресценции.Кроме того, они требуют интенсивного освещения для визуализации. Напротив, датчики напряжения FP с FP, такие как суперэклиптический pHluorin [5], в 100 раз ярче, чем датчики напряжения на основе родопсина, и, следовательно, с большей вероятностью будут хорошо работать при измерениях in vivo из мозга млекопитающих [6]. Недавно разработанные датчики напряжения с чувствительным к напряжению доменом из чувствительных к напряжению фосфатаз демонстрируют увеличенный динамический диапазон и быструю кинетику в ответ на потенциалы действия [5, 7–10].Зонды напряжения FRET-opsin (электрохромные FRET) объединяют зонды напряжения на основе родопсина с обычными FP для преодоления тусклой флуоресценции [11, 12]. Однако эти датчики FRET не являются ратиометрическими.
Разработка датчиков напряжения FP, которые используют FRET между двумя FP, может быть полезна для визуализации in vivo , поскольку соотношение сигналов FRET снижает общий шум источника, такой как сердцебиение и артефакты дыхания. Датчики напряжения на основе FRET по своим характеристикам отставали от датчиков напряжения с одним FP по величине сигнала и кинетике [5, 9, 10].Ни один из недавно описанных зондов на основе FRET не дает сигналов, способных разрешать быстрые последовательности потенциалов действия в нейронах [8, 13, 14].
Известно, что чувствительный к напряжению домен чувствительной к напряжению фосфатазы Ciona претерпевает зависимые от напряжения конформационные изменения [15-17]. Недавно описанная кристаллическая структура верхних и нижних состояний чувствительного к напряжению домена Ciona обнаруживает движение спирали S4, сопровождаемое перестройкой спиралей S1 и S3 в верхнюю или нижнюю конформации [17].Эти движения могут изменять расстояние и / или ориентацию между донорными и акцепторными хромофорами, прикрепленными к домену, чувствительному к напряжению, что приводит к изменениям в эффективности FRET. Расположение FP в области, чувствительной к напряжению, может влиять на нацеливание на мембрану и ответы напряжения [8, 13, 18]. В VSFP и Mermaid [7, 18] донорные и акцепторные FP вставляются тандемно после S4. Вариант Mermaid со вставкой 2 FP в тандеме перед S1 продемонстрировал, что конформационные изменения на N-конце также могут влиять на ответы FRET [19].Размещение донорных и акцепторных FP на противоположных сторонах домена S1-S4, как в VSFP Butterfly1.2 [13] и Mermaid2 [8], улучшило амплитуду или кинетику сигнала по сравнению с версиями с FP в тандеме. Датчики напряжения FP с FP в конфигурации VSFP Butterfly1.2 могут привести к большему перемещению FP по сравнению с датчиками с FP в тандеме.
В то время как недавние успехи в создании новых пробников напряжения были достигнуты благодаря рациональной конструкции и мутагенезу [9, 10], мы использовали эмпирический подход, чтобы выявить оптимальные местоположения FP, расположенных во фланкирующих областях домена измерения напряжения Ciona .Мы стремились улучшить размер сигнала, кинетику и широкий диапазон напряжений, в которых возникают флуоресцентные сигналы (V 1/2 ). Комбинаторная библиотека конструкций, названная «Nabi» («бабочка» на корейском языке), была создана с одним FP в 6 разных местах на N-конце, а другой FP в 8 разных местах ниже S4 на C-конце. Мы создали две группы датчиков напряжения на основе FRET: Nabi1 с UKG и mKO в качестве пары FRET [18] и Nabi2 с Clover и mRuby2 в качестве пары [20].Каждый зонд Nabi1 и Nabi2 показал зависимые от напряжения изменения флуоресценции с уникальной кинетикой сигнала и размером. Многие зонды Nabi показали сигналы с улучшенным размером сигнала и более быстрой кинетикой, чем ранее описанные датчики напряжения на основе FRET типа «бабочка», такие как VSFP Butterfly 1.2 [13] и VSFP-CR [20].
Материалы и методы
Молекулярная биология
Мы создали конструкции Nabi1 с помощью ПЦР-амплификации и клонирования, не зависящего от лигирования (InFusion, Clontech). Во-первых, ПЦР использовалась для объединения фрагментов домена, чувствительного к напряжению, и донорного или акцепторного флуоресцентного белка для создания полноразмерных гибридных белков, несущих только один FP.Их клонировали в pUB2.1, которая представляет собой плазмиду экспрессии CMV, снабженную кассетой отрицательной селекции ccdB, которая устраняет только векторный фон (плазмида Addgene 40728: pUB2.1). Праймеры, комплементарные началу кодирующей области, и обратный праймер, комплементарный области, кодирующей домен S4, затем использовали во втором наборе реакций ПЦР для получения продуктов, кодирующих первую половину слитого белка, и прямого праймера, комплементарного к Область S4 была спарена с обратным праймером на стоп-кодоне для получения продуктов ПЦР, которые кодировали вторую половину белка, включая FP.Эти продукты ПЦР затем комбинаторно клонировали в pUB2.1 для создания 39 конструкций Nabi1 (таблица 1). Поскольку пара UKG и mKO FRET плохо экспрессируется в нейронах [21], в восьми комбинациях с многообещающими оптическими сигналами флуоресцентные белки были заменены парой Clover / mRuby2 FRET [20]. Эти конструкции, обозначенные Nabi2, были получены путем замены соответствующих mKO и UKG зондов Nabi1 на Clover (плазмида Addgene 40259) и mRuby2 (плазмида Addgene 40260). Попытки удалить неструктурированную область за пределами ствола FP mRuby2 привели к плохому сворачиванию (Lin MZ, личное сообщение).Неструктурированная область на С-конце mRuby2 может действовать как линкер, увеличивающий физическое расстояние между парами FRET. С другой стороны, карбоксильный конец неструктурированной области Clover может быть усечен [20]. Поэтому мы поместили аминокислоты Clover 1-228 в положение mKO и аминокислот 1-237 mRuby2 в положение UKG. Это привело к переключению позиций донорных и акцепторных FP между Nabi1 и Nabi2. Чтобы слить FP без модификации в основной цепи CiVSP между Nabi1 и Nabi2, для замены использовали двухэтапные реакции ПЦР.Сайты вставки FP и последовательностей Nabi1 и Nabi2 проверяли секвенированием. Мы также провели измерения в клетках HEK293 с помощью VSFP-CR [20] (Addgene 40257) и VSFP-Butterfly1.2 [13].
Таблица 1. Структура и характеристики напряжения датчиков Nabi1.
Nabi1 состоит из N-конца потенциал-чувствительного домена Ciona , mKO (1-218 аминокислот), S1-S4 вольт-чувствительного домена и UKG (1-224 аминокислоты), за которыми следуют стоп-кодон. Датчики Nabi1 оценивались с использованием шагов напряжения 100 мс от удерживающего потенциала -70 мВ до -170 мВ, -20 мВ, +30 мВ и +130 мВ или до -120 мВ, -20 мВ, +30 мВ, + 80 мВ. и +130 мВ в временно трансфицированных клетках HEK293.Мы протестировали 3–21 клетку для каждого зонда Nabi1. Были проанализированы усредненные оптические следы из 16 испытаний. ΔF / F рассчитывали для деполяризаций 100 мВ, взяв среднее значение оптических сигналов от тестируемых клеток для каждого зонда. ΔF / F max было наибольшим значением оптических откликов, наблюдаемых во время любого шага деполяризующего напряжения. V 1/2 (мембранный потенциал на половине максимума ΔF / F) рассчитывали по оптическим сигналам всех тестируемых клеток. Постоянные времени рассчитывались с использованием двойной экспоненциальной аппроксимации 1–6 репрезентативных донорных следов для каждого зонда.
https://doi.org/10.1371/journal.pone.0141585.t001
Культура клеток, трансфекция
КлеткиНЕК 293 поддерживали в среде Игла, модифицированной Дульбекко, с высоким содержанием глюкозы с добавлением 10% фетальной бычьей сыворотки в инкубаторе при 37 ° C на воздухе с 5% CO 2 . Клетки помещали на покровные стекла, покрытые поли-L-лизином, и временно трансфицировали ДНК в чашке 2 см 2 (одна лунка 24-луночного планшета). Трансфекцию проводили с использованием липофектамина 2000 (Invitrogen).Нейроны гиппокампа выделяли из эмбрионов мышей E18. Беременных мышей (C57BL / 6; Koatech) умерщвляли быстрой декапитацией. Обращение с мышами проводилось в соответствии с процедурами, рассмотренными и утвержденными Комитетом по институциональному уходу и использованию животных Йельского университета и Комитетом по этике экспериментов на животных KIST (Корейский институт науки и технологий), и их проводили в соответствии с Руководством . по уходу за лабораторными животными и их использованию № , принятым и опубликованным Национальными институтами здравоохранения.Были приложены все усилия, чтобы свести к минимуму дискомфорт или страдания животных, а также количество используемых животных. Культуру нейронов поддерживали в базальной среде Neuro с 0,5 мМ глутамакс-I и 1 мл добавки B-27 (Invitrogen) на 50 мл культуральной среды. Через семь-десять дней после выделения клеток временную трансфекцию выполняли с использованием 2 мкг ДНК на 35-миллиметровую чашку или 0,4 мкг на 12-миллиметровое покровное стекло в 24-луночном планшете с использованием липофектамина 2000 (5 мкл на 35-миллиметровую чашку или 1 мкл на 12-миллиметровую чашку). мм) или с помощью метода осаждения фосфатом Ca 2+ с набором для трансфекции млекопитающих Calphos (Clonetech, TaKaRa) [9].Нейроны использовали для экспериментов через 1–3 дня после трансфекции.
Электрофизиология
Электрофизиологические записи клеток HEK293 выполнялись в перфузионной камере с температурой бани, поддерживаемой на уровне 33 ° C с помощью регулятора температуры. Раствор для купания представлял собой раствор KRH (Krebs-Ringers HEPES) (120 мМ NaCl, 4,7 мМ KCl, 1,2 мМ KH 2 PO 4 , 1,2 мМ MgSO 4 , 10 мМ HEPES, 2,2 мМ CaCl 2 , и 1,8 мг / мл D-глюкозы, pH 7.4). Мы использовали стеклянные патч-пипетки на 3–5 МОм (капиллярные трубки с внешним диаметром 1,5 / 0,75 мм от World Precision Instruments, Флорида), которые были натянуты на съемник микропипеток типа P-97 Flaming / Brown (Sutter Instrument Company, Калифорния). Пипетка для клеток HEK293 содержала 120 мМ K-аспартата, 4 мМ NaCl, 4 мМ MgCl 2 , 1 мМ CaCl 2 , 10 мМ EGTA, 3 мМ Na 2 АТФ и 5 мМ HEPES, pH 7,2. Раствор пипетки для записи нейронов содержал 120 мМ K-глюконат, 3 мМ KCl, 7 мМ NaCl, 4 мМ Mg-ATP, 0.3 мМ Na-GTP, 20 мМ HEPES и 14 мМ трис-фосфокреатин, pH доведен КОН до pH 7,3 [22] или был таким же, как раствор пипетки для клеток HEK293. Записи с фиксацией напряжения в конфигурации всей клетки выполняли с использованием усилителя Patch Clamp PC-505B (Warner Instruments, CT) или усилителя EPC10 USB Patch Clamp (HEKA Electronik, Германия). Мы изменили мембранный потенциал от удерживающего потенциала при -70 мВ до -170 мВ, -20 мВ, +30 мВ и +130 мВ; или от -70 мВ до -120 мВ, -20 мВ, +30 мВ, + 80 мВ и +130 мВ.Культивированные нейроны гиппокампа регистрировали в режиме фиксации тока с использованием 2-миллисекундной инъекции тока, чтобы вызвать единичный потенциал действия, или инъекций 200 мс, чтобы вызвать серию потенциалов действия. Мы рассчитали [23] потенциал жидкого соединения для пипеточного раствора 120 мМ K-глюконата, 3 мМ KCl, 7 мМ NaCl, 4 мМ Mg-ATP, 0,3 мМ Na-GTP, 20 мМ HEPES и 14 мМ трис-фосфокреатина pH7. .3 быть 16 мВ. Мы рассчитали потенциал жидкостного перехода для пипеточного раствора 120 мМ K-аспартата, 4 мМ NaCl, 4 мМ MgCl 2 , 1 мМ CaCl 2 , 10 мМ EGTA, 3 мМ Na 2 АТФ и 5 мМ HEPES. pH 7.2 должно быть 13 мВ, а измеренное — 16 мВ. Данные микроэлектрода не корректировались на потенциалы жидкого перехода.
Широкоугольная съемка
Цельноклеточный пластырь HEK293 и первичные нейронные клетки на покровном стекле толщиной 0,08–0,13 мм отображали на инвертированном микроскопе Olympus IX71 (Olympus, Япония) с использованием масляного иммерсионного объектива Olympus UPLANSAPO 60x / 1,35 NA и XBP 75 Вт / 2 OFR Ксеноновая лампа с короткой дугой (OSRAM, MI) со стабилизированным источником питания (Cairn Research, Великобритания). Интенсивность освещения составляла 2.5 мВт мм -2 . Для визуализации зондов Nabi1 с парой mKO / UKG мы использовали возбуждающий фильтр 445/20 нм, дихроичное зеркало 458 нм в микроскопе, затем сплиттер (Optosplit II; Cairn Research) с дихроичным 560 нм и 510 / Эмиссионные фильтры 84 нм и 580/60 нм (Semrock, NY). Для визуализации Nabi2 и VSFP-CR с парой Clover / mRuby2 мы использовали возбуждающий фильтр 475/23 нм и дихроичное зеркало 495 нм на микроскопе, за которым следовали дихроичные 560 нм и эмиссионные фильтры 520/40 и 645/75. (Semrock) в сплиттере.Для визуализации VSFP-Butterfly1.2 с помощью пары mCitrine / mKate мы использовали фильтр возбуждения 500/24 нм, дихроичное зеркало 520 нм и фильтры излучения 550/60 и 645/75 нм. Флуоресцентные изображения были уменьшены с помощью системы масштабирования Optem ® A45699 (Qioptiq LINOS Inc., штат Нью-Йорк) и спроецированы на камеру NeuroCCD-SMQ (RedShirtImaging, GA) или на камеру FastCMOS-128x (RedShirtImaging), управляемую программным обеспечением NeuroPlex (RedShirtImaging). ). Изображения записывались с частотой кадров 1000 кадров в секунду с помощью камеры NeuroCCD-SMQ или 500 кадров в секунду с помощью камеры FastCMOS-128x.Для визуализации нейронных культур, в частности данных о потенциале стимулированного действия, мы использовали прямой микроскоп Nikon Eclipse E6000FN с водно-иммерсионным объективом Nikon Fluor 60 × / 1,00 N.A. (Nikon, NY). Свет лазера MLL-FN-473 нм мощностью 50 мВт (Changchun New Industries Optoelectronics Tech. Co., Ltd., Китай) передавался в микроскоп с помощью многомодового оптоволоконного соединителя (Siskiyou, OR), кварцевого световода и световода. Конденсатор ахроматической EPI-флуоресценции (Till Photonics, NY). Фильтры, установленные на OptoSplit II LS Image Splitter (Cairn), были дихроичным зеркалом RR560-Di01-25×36 (Semrock) и эмиссионными фильтрами FF01-534 / 42 (Semrock) и RG610 (Schott).Все изображения нейронов были записаны с частотой кадров 1000 кадров в секунду с помощью камеры NeuroCCD-SMQ.
Конфокальная визуализация
Конфокальные изображения нейронов, трансфицированных Nabi2, получали с помощью конфокального лазерного сканирующего микроскопа Zeiss 780 LSM (Carl Zeiss AG, Германия) с использованием объектива Plan-Apochromat 63 × / 1.40 Oil DIC M27. Возбуждение хромофора осуществлялось аргоновым лазером с длиной волны 488 нм или твердотельным лазером 561 нм. Дихроичные светоделители — MBS 488/561/633 и MBS 458/561, а эмиссионные фильтры — 493–553 нм и 566–685 нм.Получение и обработка изображений производились с помощью программного обеспечения Zeiss Zen 2012.
Анализ изображений, обработка данных и представление данных
Программное обеспечениеNeuroPlex использовалось для просмотра последовательностей изображений и вывода оптических и электрофизиологических записей. Следы представляли собой пространственное среднее значение выходного сигнала всех пикселей, получающих свет от ячейки с заплатками. Следы сигналов Nabi1, Nabi2 и VSFP-CR, показанные на рисунках, относятся к единичным испытаниям. Трасса сигнала VSFP-Butterfly1.2 было показано в среднем по 16 испытаниям. Для всех анализов использовались усредненные кривые 16 испытаний, включая ΔF / F, временные константы и V 1/2 . Значения ΔF / F представляют собой средние значения сигналов от отдельных клеток HEK293 для деполяризации 100 мВ. В таблице 1 также перечислены наибольшие размеры сигнала донора и акцептора, наблюдаемые от любой ячейки во время серии шагов напряжения. Постоянные времени для деполяризации 100 мВ — это средние значения, рассчитанные по 1–6 репрезентативным трассам.
Для расчета% ΔF / F темное изображение вычиталось из всех кадров, среднее значение интересующей области в каждом кадре во время шага напряжения (F) вычиталось из среднего значения области, взятой из десяти кадров до интересующее событие (F 0 ), а затем это значение было разделено на 0 F; расчет был [% ΔF / F = ((F – F 0 ) / F 0 ) * 100].Трассы были импортированы в Origin 8.6 (OriginLab, MA) для анализа постоянных времени (вклад τ1 и τ2), FWHM (полная ширина на полувысоте) и V 1/2 сигналов. Динамика зонда соответствовала либо одному экспоненциальному уравнению [y = A1 * exp (-x / t1) + y0], либо двойному экспоненциальному уравнению [y = y0 + A1 * exp (- (x-x0) / t1) + A2 * exp (- (x-x0) / t2)], где A1 и A2 — амплитуды, а τ1 и τ2 — постоянные времени в мс. Соотношение напряжения сигнала и соответствовало уравнению Больцмана [y = A2 + (A1 − A2) / (1+ exp (x − x 1/2 ) / s)], где x 1/2 — V 1/2 (мембранный потенциал в мВ при половине максимального значения ΔF / F), а s — наклон (исходная точка 8.6). V 1/2 в таблице 1 было оценено путем предположения линейной зависимости оптических сигналов между ступенями напряжения по обе стороны от половины максимального ΔF / F. Статистический анализ выполняли с использованием Origin 8.6, Prism 6 (Graphpad Software Inc., Калифорния) или Excel (Microsoft, Вашингтон). Данные представлены как среднее ± SEM (стандартная ошибка среднего).
Оценка линкерных последовательностей FP в Nabi1 и Nabi2
Выравнивание последовательностей FP проводили с использованием NCBI BLAST, EMBL-EBI Clustal Omega и путем ручной проверки.Аминокислотные последовательности линкеров и β-цепей mKO, UKG, Clover и mRuby2 были выведены на основе выравнивания последовательностей белков и сравнения с кристаллической структурой GFP [24].
Результаты
Датчики напряжения Nabi1 FP
Наша стратегия по улучшению датчиков напряжения FP заключалась в сравнении нескольких местоположений донорных и акцепторных FP в области, чувствительной к напряжению магистрали. Конструкции Nabi1 были разработаны с вставкой UKG и mKO в качестве пары FRET в различных местах в цитоплазматических областях, окружающих потенциал-чувствительный домен Ciona (рис. 1A и 1B).Для вставки UKG (зеленые стрелки на рис. 1B) мы выбрали 8 сайтов ниже по течению на карбоксильном конце S4. Для вставки mKO на N-конце (оранжевые стрелки на рис. 1B) мы ссылались на предыдущие сообщения [13, 19]. Когда FP вставлялся слишком близко к S1, нацеливание на мембрану сенсоров на основе чувствительных к напряжению доменов Ciona было нарушено [13]. Когда FP вставлялся перед 80 -й аминокислотой вольт-чувствительного домена, вольт-амперные характеристики зондов снижались [19].Мы выбрали четыре равномерно расположенных сайта (84 -е , 90 -е , 95 -е и 100 -е ) между 80 -й и 100 -й аминокислотами. Мы также включили 42 -й и 53 -й аминокислот, потому что вставка FP в эти сайты может улучшить нацеливание зондов на мембрану [13]. Мы протестировали в общей сложности 39 различных комбинаций этих сайтов вставки (таблица 1). Каждый зонд Nabi имеет название, состоящее из номера версии 1 или 2, за которым следует десятичная точка и идентификационный номер (Таблица 1).Все зонды Nabi1 оканчивались после UKG, за исключением Nabi1.243, который включал PTEN (гомолог фосфатазы и тензина) -подобный цитоплазматический домен фосфатазы на С-конце (таблица 1).
Рис. 1. Структура и оптические ответы зондов Nabi1 на изменения мембранного потенциала в временно трансфицированных клетках HEK293.
A. Зонды Nabi1 содержат mKO (оранжевый) и UKG (зеленый) в качестве пары FRET во фланкирующих областях чувствительного к напряжению домена Ciona . B. Последовательность потенциал-чувствительного домена Ciona (от 1 st до 259 th аминокислот). Трансмембранные домены S1-S4 подчеркнуты. mKO был вставлен в одно из 6 мест, обозначенных оранжевыми стрелками. UKG был вставлен в одно из 8 мест, обозначенных зелеными стрелками. C. Типичный донорный (UKG, зеленый) и акцепторный (mKO, оранжевый) сигналы 3 выбранных зондов Nabi1. Следы от одиночных испытаний Nabi1.213 (FP на 84 th и 245 th аминокислотах), Nabi1.242 (FP на 95 th и 246 th ) и Nabi1.244 (FP на 95 th и 245 th ) показаны без временной фильтрации. D. Типичный донорный (mCitrine, желтый) и акцепторный (mKate, красный) сигналы VSFP Butterfly1.2 [13]. Кривые представляют собой среднее значение 16 испытаний без временной фильтрации и показаны с использованием масштабных полос ΔF / F 10% и 2%. Для VSFP Butterfly1.2 использовались те же ступени напряжения, что и в C .
https: // doi.org / 10.1371 / journal.pone.0141585.g001
Зонды Nabi1 были оценены путем мониторинга оптических сигналов в ответ на скачки напряжения 100 мс в ячейках HEK293 с использованием протоколов скачков напряжения, описанных в материалах и методах и проиллюстрированных на рис. 1. Анализ сигналы от зондов Nabi1 приведены в таблице 1. На рис. 1С показаны кривые сигналов от отдельных испытаний от 3 репрезентативных зондов Nabi1: Nabi1.213 (ΔF / F = 6%, -4% для акцептора и донора соответственно для деполяризации 100 мВ), Nabi1,242 (ΔF / F = 4%, -3%) и Nabi1.244 (ΔF / F = 2%, -2%). Все три зонда имели как донорные, так и акцепторные сигналы с деполяризацией, в то время как ни один из них не имел значимых оптических сигналов во время гиперполяризации. Мы также измерили сигналы от VSFP Butterfly1.2, недавно разработанного датчика напряжения на основе FRET (рис. 1D) [13]. В отличие от сигналов Nabi1, полученных в результате единичных испытаний, трассы VSFP Butterlfy1.2 представляют собой среднее значение для 16 испытаний. Сигналы VSFP Butterfly 1.2 показаны в двух шкалах. Пробники Nabi1 имеют больший ΔF / F и большее отношение сигнал / шум, чем VSFP Butterfly 1.2. Временной ход сигналов обоих датчиков Nabi1 и VSFP Butterfly1.2 лучше соответствует двойным экспоненциальным функциям, чем одиночным экспонентам.
Размер сигнала.
Размер сигнала (ΔF / F) для деполяризации 100 мВ как функция местоположения FP для зондов Nabi1 перечислены в таблице 1 и схематично проиллюстрированы на рисунке 2A. Расположение FP относительно наибольшего размера сигнала (ΔF / F max ), наблюдаемого во время любого скачка напряжения от -70 мВ, показано на рис. 2B.Ясно, что сайты встраивания mKO и UKG в цитоплазматические N- и C-концы влияют на размер сигнала. Половина протестированных зондов Nabi1 показала ΔF / F, равную или превышающую 4% для деполяризации 100 мВ. В то время как сильные ответчики содержали mKO на 84 -й , 90 -й или 95 -й аминокислотах, расположенных в цитоплазматическом сегменте рядом с S1, и UKG между 245 -й и 257 -й аминокислотами ниже по течению от S4, большие ответы FRET предполагали координацию двух мест.
Рис. 2. Размеры сигналов зондов Nabi1 в клетках HEK293.
Указаны позиции МКО и УКГ. Серые прямоугольники обозначают комбинации, которые не тестировались. Варианты Nabi1 Nabi1.82, Nabi1.102, Nabi1.243 и Nabi1.152 (таблица 1) не включены в этот рисунок или рисунки 3 и 4 (см. Таблицу 1). A. ΔF / F оптических откликов Nabi1 для деполяризации 100 мВ. ΔF / F рассчитывали путем усреднения оптических откликов для деполяризации 100 мВ от 3–21 клетки для каждого зонда.Красные прямоугольники обозначают зонды Nabi1 с ΔF / F сигнала донора или акцептора, равные или превышающие 5%, синие прямоугольники указывают зонды с ΔF / F от 4 до 5%, а зеленые прямоугольники обозначают зонды с ΔF / F <4%. Подробные значения ΔF / F перечислены в таблице 1. B. Максимальное значение ΔF / F при скачках напряжения от -170 мВ до +130 мВ от удерживающего потенциала -70 мВ. Красные прямоугольники обозначают зонды Nabi1 с ΔF / F max донорного или акцепторного сигнала, равного или превышающего 12%, синие прямоугольники указывают зонды с ΔF / F от 7 до 12%, а зеленые прямоугольники обозначают зонды с ΔF / F <7 %.Подробные значения ΔF / F max приведены в таблице 1.
https://doi.org/10.1371/journal.pone.0141585.g002
Кинетика сигнала.
Кинетика сигналов датчиков Nabi1 представлена в таблице 1 и схематически показана как функция положения FP на рис. 3. Как следует из динамики сигналов Nabi1 на рис. 1, реакция на напряжение 100 мс. Шаги всегда лучше всего соответствовали двум экспоненциальным компонентам, обозначенным τ1 и τ2. Несколько зондов Nabi1 давали сигналы τ1 длительностью 2–3 мс (Таблица 1).В то время как многие зонды Nabi1 имели быструю кинетику τ1 (рис. 3A), только некоторые из них имели быструю от кинетики τ1 (рис. 3B). Похоже, что места вставки ближе к трансмембранному домену в аминоконцевом цитоплазматическом сегменте (mKO между 84-й или 100-й аминокислотой) и места вставки ближе к трансмембранному домену в карбоксильном конце цитоплазматического сегмента (UKG на 241 st и 252 nd аминокислота) дает более быстрые значения τ1-off. Несколько зондов Nabi1 со вставкой mKO между 84 -й и 100 -й аминокислот и со вставкой UKG между 241 -й и 252 -й имели быстрые сигналы как для активации, так и для инактивации (рис. 3A и 3B). .Опять же, кинетика сигнала, по-видимому, определяется координацией двух местоположений FP. Например, Nabi1.216 с mKO на 84 th и UKG на 246 th вызвали более быструю активацию сигнала (τ1 на 2 мс) и более быстрое затухание сигнала (τ1 на 5 мс) по сравнению с Nabi1.213 с mKO на 84 th и UKG на 245 th (τ1 на 7 мс; τ1 выключено на 12 мс). (Рис. 3A и 3B, Таблица 1). Несколько зондов Nabi1 со вставкой mKO между 90 -й и 100 -й аминокислот и UKG со вставкой между 249 -й и 259 -й имели сигналы τ2, которые были относительно быстрыми как для активации, так и для инактивации (рис. 3С).
Рис. 3. Константы времени для активации сигнала и затухания донорного сигнала для зондов Nabi1 в ответ на деполяризацию 100 мВ.
Оптические отклики анализировали с использованием двойной экспоненциальной функции. Средние значения были взяты из сигналов 1–5 репрезентативных ячеек. Подробные значения приведены в таблице 1. Указаны положения mKO и UKG. Серые прямоугольники обозначают комбинации, которые не тестировались. A. Быстрые компоненты активации сигнала (τ1 на ).Красные прямоугольники обозначают датчики с τ1 на быстрее или равными 5 мс. Синими прямоугольниками обозначены датчики с τ1 на , равным или быстрее 10 мс, но медленнее 5 мс. Зеленые прямоугольники указывают зонды с τ1 на медленнее, чем 10 мс. B. Быстрые компоненты восстановления сигнала (τ1 от ). Та же цветовая шкала, что и A. C. Сводная информация о кинетике активации и восстановления сигнала для медленных компонентов Nabi1. Красные прямоугольники обозначают зонды с τ2 активации сигнала быстрее или равным 50 мс и τ2 затухания сигнала, равным или быстрее 50 мс.Синие прямоугольники обозначают зонды с τ2 активации, равной или быстрее 50 мс, и τ2 затухания, медленнее 50 мс. Зеленые прямоугольники обозначают зонды с τ2 активации медленнее 50 мс. D. Кинетика затухания сигнала зондов Nabi1 показала обратную зависимость от процента быстрых компонентов (R квадрат = 0,17, p = 0,01).
https://doi.org/10.1371/journal.pone.0141585.g003
Активация сигнала зондов Nabi1 имела 41 ± 2% быструю составляющую для деполяризации 100 мВ во время шага напряжения 100 мс.На долю быстрого компонента активации сигнала не сильно влияло положение FP (данные не показаны). Спад сигнала имел быструю составляющую 28 ± 3%. Некоторые зонды с mKO у 90 -й или 95 -й аминокислоты и с UKG между 240 -й аминокислотой и 252 -й аминокислот показали затухание сигнала с более чем 40% быстрого компонента для 100 мВ. деполяризация (данные не показаны). Значение τ1 off обратно коррелировало с процентным соотношением быстрого компонента (рис. 3D, R квадрат = 0.17, p = 0,01), что указывает на то, что зонды с более быстрым затуханием сигнала имеют тенденцию иметь большую быструю составляющую. Поскольку доля быстрой составляющей зависит от продолжительности скачка напряжения, эти значения не включены в Таблицу 1.
Мы не наблюдали существенной разницы в кинетике донорных и акцепторных сигналов зондов Nabi1. Например, Nabi1.213, Nabi1.242 и Nabi1.244 отображают аналогичные временные константы для сигналов донора и акцептора во время активации и распада (S1 рис.).Nabi1.213 и Nabi1.244 не показали различий в доле быстрого компонента для сигналов донора и акцептора во время активации и распада. Акцепторный сигнал Nabi1.242 имел значительно меньшую долю быстрого компонента по сравнению с сигналом донора во время активации (p = 0,01), в то время как он не показал разницы в процентном отношении быстрого компонента сигналов акцептора и донора во время затухания сигнала.
В
1/2 (мембранный потенциал на половине максимума ΔF / F).Все зонды Nabi1 с V 1/2 ниже -40 мВ имели UKG между 249 -й и 259 -й аминокислотами ниже цитоплазматического конца S4 (рис. 4).Напротив, позиции mKO на N-конце, по-видимому, имели лишь незначительное влияние. Как и ожидалось, зонды с низким V 1/2 показали относительно большие гиперполяризационные ответы (ΔF / F> 2%) по сравнению с другими зондами Nabi1 (данные не показаны). Интересно, что зонды Nabi1 с более гиперполяризованным V 1/2 имели более медленную кинетику затухания сигнала τ1 (рис. 4B справа; R квадрат = 0,38, p <0,01), в то время как они не демонстрировали значимой связи с τ1 on (рис. 4B слева; R квадрат = 0.04, p = 0,22).
Рис. 4. Мембранный потенциал на половине максимума ΔF / F (V 1/2 ) зондов Nabi1 в клетках HEK293.
A. V 1/2 датчиков Nabi1. Указаны позиции мКО и УКГ. Серые прямоугольники обозначают комбинации, которые не тестировались. V 1/2 был рассчитан на основе нормированного донорного ΔF / F 2–14 измерений для каждого зонда (см. Материалы и методы). Подробные значения приведены в таблице 1. Фиолетовые квадраты указывают на датчики с V 1/2 при более отрицательных значениях, чем -40 мВ, зеленые квадраты указывают на датчики с V 1/2 между -40 мВ и -20 мВ, а желтые квадраты указывают на датчики. с V 1/2 , которые более положительны, чем -20 мВ. B. Связь между V 1/2 и постоянными времени оптических откликов. На левой панели показана зависимость для τ1 активации сигнала. Значимой корреляции не было (R квадрат = 0,04, p = 0,22). На правой панели показана обратная зависимость затухания сигнала от τ1. Зонды Nabi1 с более отрицательным значением V 1/2 , как правило, имеют более медленные значения выключения τ1 (R квадрат = 0,38, P <0,01).
https://doi.org/10.1371/journal.pone.0141585.g004
вариантов Nabi1.
Nabi1.243 был идентичен Nabi1.242 за исключением того, что он имеет PTEN-подобный C-концевой домен фосфатазы, следующий за UKG. V 1/2 для Nabi1.243 был смещен в сторону более положительного потенциала (+16 мВ для Nabi1.242; +53 мВ для Nabi1.243). Максимальный размер сигнала для двух датчиков был одинаковым (таблица 1). В дополнение к Nabi1.243, Nabi1.82, Nabi 1.102 и Nabi1.152 (Таблица 1) имели необычные аминокислотные последовательности (см. Легенду Таблицы 1), и данные из них не были включены в анализ рисунков 2, 3 или 4.
Экспрессия нейронов сенсоров Nabi1.
На основании размера сигнала и кинетики мы выбрали несколько зондов Nabi1, включая Nabi1.213, Nabi1.242 и Nabi1.244, и временно экспрессировали их в первичных культивируемых нейронах гиппокампа. Однако экспрессия этих белков в основном приводит к внутриклеточным агрегатам (данные не показаны), что согласуется с предыдущим сообщением о том, что Mermaid, который также содержит FPs mKO и UKG, плохо экспрессируется в первичных нейронах гиппокампа [21]. Мы не смогли обнаружить сигналы потенциала действия от Nabi1 в нейронах и решили модифицировать несколько конструкций Nabi1, заменив пару FRET.
Датчики напряжения Nabi2 FP
Конструкции Nabi2 были созданы путем замены пары FRET Nabi1 на Clover (зеленый) и mRuby2 (красный) (рис. 5A) [20]. Пара Clover / mRuby2 VSFP-CR, как было ранее показано, может заменять пару FRET VSFP2.3 [21] в временно экспрессируемых нейронах [20]. Мы преобразовали восемь датчиков Nabi1 в датчики Nabi2 (таблица 2), заменив Clover в позиции для mKO и mRuby2 на позицию для UKG (рис. 5A). Мы выбрали восемь на основе размера сигнала и кинетики (рис. 2 и 3 и таблица 1).Датчики Nabi2 имеют донорную FP на N-конце, в отличие от Nabi1 (см. Обоснование в разделе «Материалы и методы»). Замена FP также привела к изменениям в линкерах между доменом измерения напряжения Ciona и структурами β-can FP (рис. 5A). Трассы сигналов от одиночных испытаний Nabi2.213, Nabi2.242 и Nabi2.244 показаны на рис. 5B. Отношения сигнал-шум ответов Nabi2 в клетках HEK293 имели тенденцию быть лучше, чем у аналогов Nabi1 (сравните фиг. 1C и 5B).В наших руках размеры сигналов и кинетика включения / выключения датчиков Nabi2 были лучше, чем у VSFP-CR (рис. 5B и 5C). Датчики напряжения только с Clover (донор FP) давали только незначительные оптические сигналы в отсутствие mRuby2 (акцептор FP) в той же конструкции (M. Shepheri-Rad и L. Cohen, неопубликованные наблюдения). Аналогичные наблюдения были получены с Mermaid 2; ни CFP, ни только YFP не имели существенного оптического сигнала [8]. После сбора данных для 4 испытаний продолжительностью 1,6 с при освещении дуговой лампой, как описано в разделе «Материалы и методы», интенсивность флуоресценции донора снизилась до 83 ± 2% для Nabi2.242 (N = 6) и 83 ± 1% для Nabi2,244 (N = 6) по сравнению с интенсивностью до испытаний, а интенсивность флуоресценции акцептора была снижена до 86 ± 1% для Nabi2,242 (N = 6) и 84 ± 2% для Nabi2.244 (N = 6). Мы сравнили следы донорского сигнала Nabi2.242, собранные по контуру и от всей клетки (S2, рис.). Сбор сигналов от контура клетки (плазматической мембраны) не сильно улучшил отношение сигнал / шум по сравнению с сигналами, полученными от всей клетки.
Рис 5.Наби2 зонды.
A. Nabi2 имеет Clover (зеленый) и mRuby2 (красный) в качестве пары FRET. Nabi1 и Nabi2 также различаются линкерами между доменом измерения напряжения Ciona (CiVSD) и β-банками FP. Домен Ciona , чувствительный к напряжению, и N-конец показаны серым цветом. Четыре трансмембранных домена S1-S4 обозначены черными полосами. FP имеют цветовую кодировку mKO (оранжевый), UKG (темно-зеленый), Clover (ярко-зеленый) и mRuby2 (красный). β-банки с FP показаны в виде вертикальных прямоугольников. B. Типичный донор (клевер; зеленый) и акцептор (mRuby2; красный) сигналов Nabi2.213, Nabi2.242 и Nabi2.244. Все следы были взяты из одиночных испытаний и без временной фильтрации. C. Наши результаты с использованием VSFP-CR [20] показаны из отдельных испытаний с использованием масштабных полос ΔF / F 10% и 5% и без временной фильтрации для сравнения. Для VSFP-CR использовались те же ступени напряжения, что и в B .
https://doi.org/10.1371/journal.pone.0141585.g005
Таблица 2. Сравнение зондов Nabi1 и Nabi2.
Δ F / F, постоянные времени и V 1/2 сравнивали с использованием усредненных оптических трасс 16 испытаний на временно трансфицированных клетках HEK293. ΔF / F и постоянные времени оценивали по оптическим откликам донора на деполяризацию 100 мВ. Мы исследовали 5–20 клеток для каждого зонда. V 1/2 был оценен путем подбора с помощью функции Больцмана.
https://doi.org/10.1371 / journal.pone.0141585.t002
Размер сигнала и кинетика.
Далее мы сравнили восемь зондов Nabi1 и восемь зондов Nabi2 на рис. 6 и в таблице 2. Замена FP привела к некоторому увеличению размера донорского сигнала (ΔF / F), но не изменила размер сигнала для акцептора (рис. 6A). Как и Nabi1, временные ходы сигналов Nabi2 лучше соответствовали двойным экспоненциальным функциям (S3 Рис). Кинетика сигнала зондов Nabi2 была аналогична Nabi1 (фиг. 6B), за исключением некоторого улучшения медленного компонента активации сигнала (фиг. 6B в середине) и уменьшения доли быстрого компонента затухания сигнала (фиг. 6B справа).Nabi2.213, Nabi2.242 и Nabi2.244 показали аналогичные временные константы и процент быстрых компонентов для сигналов акцептора и донора во время активации и распада (S1 рис.).
Рис. 6. Сравнение зондов Nabi1 и Nabi2.
А-Д . Размер сигнала и постоянные времени восьми зондов Nabi1 и восьми зондов Nabi2 были усреднены и сравнены с помощью t-теста. Звездочка (*) указывает статистические различия (p <0,05). A. ΔF / F зондов Nabi1 и Nabi2 для деполяризации 100 мВ в клетках HEK.Сигналы были взяты из усредненных сигналов зондов Nabi1 или Nabi2. Преобразование зондов Nabi1 в Nabi2 увеличивало размер донорского сигнала, но не акцепторного. B. Сравнение постоянных времени оптических ответов донора на деполяризацию 100 мВ. Слева: τ1 активации и затухания сигнала. Наби1 и Наби2 существенно не различались. В центре: Nabi2 имел более быстрый медленный компонент активации сигнала по сравнению с Nabi1 (p = 0,03). Спад сигнала существенно не изменился. Справа: Замена FP не изменила значительно процент быстрого компонента активации сигнала, но уменьшила процент быстрого компонента затухания сигнала в Nabi2 по сравнению с Nabi1 (p = 0.03). C. Зависимость сигнала от напряжения для трех датчиков Nabi1 и Nabi2. Значения ΔF / F были нормализованы к максимальному ΔF / F каждого зонда Nabi (N = 6–8 клеток для зондов Nabi1, 14-19 клеток для зондов Nabi2) и аппроксимированы функцией Больцмана. Левая панель: сигналы донора против напряжения . Правая панель: сигналы приемника в зависимости от напряжения. Пунктирные линии с открытыми символами соответствуют зондам Nabi1, а сплошные линии с замкнутыми символами — зондам Nabi2.
https://doi.org/10.1371/journal.pone.0141585.g006
В
1/2 .Кривые зависимости сигнала (ΔF / F) от напряжения как донорной, так и акцепторной флуоресценции зондов Nabi1 и Nabi2 имели сигмоидальные отношения и соответствовали уравнению Больцмана (рис. 6C, таблица 2). Кривые зависимости сигнала от напряжения для Nabi1 и 2.213, Nabi1 и 2.242 и Nabi1 и 2.242 показаны на рис. 6C. Каждый из зондов Nabi2 отвечал более отрицательным мембранным потенциалом по сравнению с соответствующим зондом Nabi1 как на донорные, так и на акцепторные сигналы (рис. 6, таблица 2).V 1/2 из восьми донорных сигналов датчиков Nabi2 были смещены на -31,8 ± 8,8 мВ от сигналов датчиков Nabi1 (p <0,01 при тестировании), а сигналы акцепторов датчиков Nabi 2 были смещены V 1/2 на -41,3 ± 4,9 мВ (p <0,01 по данным теста; таблица 2). Изменения значений V 1/2 донорных и акцепторных сигналов существенно не различались (p = 0,36 по t-критерию).
Нейронные сигналы.
Nabi2.213, Nabi2.242 и Nabi2.244 все показали хорошую локализацию плазматической мембраны в остро культивируемой нейрональной соме и отростках с некоторыми цитоплазматическими агрегатами (рис. 7A для Nabi2.244). Все 3 зонда имели измеримые ответы на единичные потенциалы действия; Результаты единичных испытаний для Nabi2.244 показаны на рис. 7. Сигналы от донора и акцептора, реагирующие на вызванный индивидуальный потенциал действия, были четко обнаружены (рис. 7В). Как и в случае с клетками HEK293 (рис. 5B), донорные сигналы были больше сигналов акцепторов. Донорный сигнал Nabi2.244 имел фракционное изменение флуоресценции 1,7 ± 0,1% (N = 6). Полная ширина на половине высоты этих оптических сигналов составляла 3,3 ± 0.2 мс для донора (N = 16) и 3,5 ± 0,3 мс для акцептора (N = 7). Nabi2.213 и Nabi2.242 имели сходные оптические ответы на вызванные потенциалы действия (данные не показаны). Nabi2.244 ответил на потенциал спонтанного действия, как показано на донорском сигнале из одного испытания (рис. 7C). Далее Nabi2.244 оценивали на предмет ответов на серию потенциалов действия, вызванных этапом фиксации тока в нейронах гиппокампа. Оптические отклики Nabi2.244 на спайки при 45 Гц наблюдались как для донора, так и для акцептора (рис. 7D).Сигналы представляли собой среднее значение всех пикселей, получающих свет от сомы и проксимальной части процессов, обозначенных зеленым цветом на правой панели фиг. 7E.
Рис. 7. Nabi2.244 ответил на потенциалы действия в первичных культивируемых нейронах гиппокампа.
A. Экспрессия Nabi2.244 в нейроне, как показано с помощью конфокальной лазерной сканирующей микроскопии. Показано объединенное изображение клевера / mRuby2. Масштабная линейка показывает 10 мкм. Nabi2.244 частично локализовался в плазматической мембране сомы и отростков.Стрелки указывают на мембранную локализацию флуоресцентных сигналов. Nabi2.244 также был обнаружен во внутриклеточных агрегатах. B. Репрезентативные следы сигналов донора (зеленый) и акцептора (красный) из одного испытания (флуоресценция), отвечающего на стимулированный потенциал действия (электрод) от нейрона, экспрессирующего Nabi2.244. Следы сигналов сглаживались двумя проходами биномиального фильтра нижних частот. C. Репрезентативный донорский сигнал от одного испытания (флуоресценция; зеленый), отвечающий на потенциал спонтанного действия (электрод; черная кривая без фильтрации, синяя кривая с фильтрацией) от нейрона, экспрессирующего Nabi2.244. Одиночная трасса сигнала показана сглаженной гауссовым фильтром нижних частот на частоте 50 Гц. D. Репрезентативные следы сигналов донора (зеленый) и акцептора (красный) из одного испытания во время серии стимулированных потенциалов действия (черный) от нейрона, экспрессирующего Nabi2.244. Оптические кривые от одного испытания ячейки с токовым ограничением показаны сглаженными за 10 проходов биномиального фильтра нижних частот. Следы нефильтрованного сигнала (пурпурный и темно-зеленый) накладываются друг на друга. E. Изображение нейрона с покоящейся интенсивностью флуоресценции (слева).Оптические сигналы в D были получены от сомы и проксимальных отростков, отмеченных зеленым (справа).
https://doi.org/10.1371/journal.pone.0141585.g007
Вклад tau1 для более коротких шагов напряжения.
Поскольку шаги напряжения 100 мс, которые мы использовали с элементами HEK293, намного больше, чем длительность потенциала действия, мы также оценили амплитудный вклад двух компонентов в шаг напряжения 5 мс. Значения для датчиков Nabi2 показаны в таблице 3.Быстрая составляющая изменения флуоресценции составляла большую часть ответов на шаг 5 мс.
Таблица 3. Расчетные ответы зондов Nabi2 на 5 мс деполяризации 100 мВ.
Усредненные следы доноров 16 испытаний были получены из временно трансфицированных клеток HEK293, подогнаны двойной экспоненциальной функцией и использованы для расчета ответов через 5 мс.
https://doi.org/10.1371/journal.pone.0141585.t003
Обсуждение
Расположение флуоресцентных белков и ответы напряжения
Размер сигнала и кинетика.
Положение флуоресцентного донора и акцептора в белках Nabi1 влияет на размер сигнала и константы времени ответа. Многие зонды Nabi1 имеют большую амплитуду сигнала (до 17% ΔF / F max ) и относительно быструю кинетику сигнала (рис. 1–3, таблица 1). Сильные флуоресцентные сигналы и быстрые ответы происходили из-за координации расположения донора и акцептора. Горячие точки для большого размера сигнала и быстрой кинетики были в основном сгруппированы между 84 -й и 100 -й аминокислотами для mKO и между 241 -й и 257 -й аминокислотами для UKG (рис. 2 и 3). .Несколько зондов Nabi1, таких как Nabi1.216, Nabi1.30, Nabi1.226, Nabi1.125, Nabi1.104, Nabi1.244 и Nabi1.49, показали быструю кинетику сигнала как для активации (τ1 on = ~ 2 мс), так и для затухания. (τ1 off = ~ 3 мс) (рис. 3, табл. 1). Мы сообщаем значения τ для деполяризации 100 мВ, но важно отметить, что значения τ сигналов зависят от напряжения; как правило, более быстрые значения τ для больших деполяризаций (например, рисунки 1 и 5).
Сравнение с другими датчиками FRET.
VSFP бабочка1.2 [13] и Mermaid2 [8] имеют сходные структуры «бабочки» с зондами Nabi (FRET FPs фланкируют трансмембранный домен S1-S4). VSFP Butterfly1.2 имел mKate на позиции 69, , и mCitrine, на уровне 250, , аминокислот. Многие зонды Nabi1 со вставкой UKG между 249 -й и 259 -й аминокислотами отвечали быстрой активацией сигнала, но медленной кинетикой затухания сигнала (фиг. 3B, таблица 1). Многие зонды Nabi1 и Nabi2 демонстрировали сигналы с большей динамикой сигнала, чем VSFP Butterfly1.2 [13] и ответил более быстрой кинетикой включения и выключения (рис. 1C и 1D). Mermaid2 и Mermaid2β [8] имели mUKG или CFP на 103 -й аминокислотах и mKO или YFP на 249 -й аминокислотах. Mermaid 2 показала размер сигнала до 20%, сравнимый с размером сигнала Nabi1 (Таблица 1), в клетках HEK293 [8]. Mermaid2 демонстрировала быструю кинетику включения, но имела относительно медленную кинетику распада [8]. Сигналы зондов Nabi2 были больше и быстрее, чем VSFP-CR (рис. 5B и 5C). VSFP-CR [20] имеет Clover и mRuby2 в тандеме на C-конце домена измерения напряжения с той же основной цепью VSFP2.3 [21]. Мы пришли к выводу, что, проверив больше местоположений FP, мы разработали улучшенные датчики напряжения на основе FRET.
В
1/2 .V 1/2 в основном определялся положением UKG на цитоплазматическом С-конце вольт-чувствительного домена и незначительно влиял на положение mKO на N-конце (рис. 4). Интересно, что зонды Nabi1 с низким V 1/2 имели относительно медленное затухание сигнала (Рис. 4B). Мы не понимаем причину взаимосвязи V 1/2 и местоположения UKG или взаимосвязь между V 1/2 и кинетикой затухания сигнала.
Влияние двух разных пар флуоресцентных белков на ответ напряжения
Размер сигнала и кинетика.
Зонды Nabi2 с Clover и mRuby2 имели гораздо лучшую экспрессию в нейронах по сравнению с зондами Nabi1 с mKO и UKG. Изменение FP не повлияло на быстрые компоненты активации и затухания сигнала (рис. 6B). Замена пары Nabi1 FRET на Clover / mRuby2 замедлила затухание сигнала за счет уменьшения процента быстрого компонента (рис. 6, таблица 2). В целом, мы наблюдали незначительные, а не драматические изменения кинетики сигнала при преобразовании зондов Nabi1 в Nabi2.
В
1/2 .Зависимость сигнала флуоресценции от напряжения для всех восьми зондов Nabi2 была смещена в сторону более отрицательных потенциалов по сравнению с зондами Nabi1 (рис. 6E, таблица 2). Таким образом, на зависимость сигнала от напряжения, по-видимому, влияет не только расположение FP в структуре магистрали, но и выбор пары FRET. Аминокислотные последовательности FPs UKG / mKO и Clover / mRuby2 весьма расходятся (27% идентичности и 45% гомологии между UKG и Clover; 44% идентичности и 61% гомологии между mKO и mRuby2).Одна из гипотез для объяснения сигнала FRET заключается в том, что он является результатом зависящего от напряжения сдвига в равновесии мономер-димер между двумя FP. Сдвиг V 1/2 с изменением FP может возникать из-за разницы в равновесии мономер-димер между двумя парами FP [25–27]. Однако, помимо этой разницы между FP, замена пар FP привела к изменениям в линкерах между доменом измерения напряжения Ciona и структурами β-can FP (рис. 5A).Были изменения как в длине, так и в аминокислотном составе линкеров. Это различие в линкерах может также лежать в основе некоторых функциональных различий между зондами Nabi1 и Nabi2, что согласуется с недавним сообщением [28].
Наби-зонды как датчики напряжения
ArcLight, как известно, производит устойчивый потенциал-зависимый сигнал в культивируемых нейронах млекопитающих [5] и в in vivo мухе [29]. Недавно сигналы ArcLight были измерены в ответ на вдыхание запаха в обонятельной луковице мыши in vivo .Большое частичное изменение (~ 4%) с хорошим отношением сигнал / шум было получено в единичных испытаниях [6]. Недавно разработанный датчик напряжения FP Bongwoori давал оптические отклики на потенциалы действия с частотой 60 Гц [9]. Nabi2 продемонстрировал кинетику сигнала, эквивалентную Bongwoori в нейронах (рис. 7D). Хотя размер сигнала зондов Nabi2 был не таким большим, как у ArcLight в клетках HEK293 [5], более быстрая кинетика зондов Nabi2 давала оптические сигналы во время потенциалов действия, которые были сопоставимы с таковыми из ArcLight.Более быстрая кинетика и разумные размеры сигнала могут сделать зонды Nabi2 полезными для записи in vivo . Датчики Nabi2 — это датчики с быстрым напряжением, которые могут быть полезны для мониторинга нейронной активности, особенно при использовании с ратиометрической визуализацией.
Положения FP для больших оптических сигналов и положения для быстрых ответов, как правило, группируются вокруг аминокислот ближе к домену S1-S4 (Рис. 2 и 3). С другой стороны, зонды с низким V 1/2 имели вставку FP дистальнее домена S4 (рис. 4).Чтобы избирательно контролировать потенциалы действия, датчики напряжения должны реагировать на мембранный потенциал выше порогового значения большим сигналом и быстрой кинетикой. С другой стороны, датчики напряжения со способностью сигнализировать об изменениях мембранного потенциала вблизи потенциала покоя могут быть полезны для обнаружения подпороговых синаптических потенциалов. Nabi2 показал смещенный влево сигнал против в зависимости от напряжения по сравнению с Nabi1 (рис. 5E). Некоторые зонды Nabi2 более чувствительны к потенциалам действия, в то время как другие будут относительно избирательными в отношении мембранных потенциалов около потенциала покоя.
Экспрессия датчиков FP-напряжения может добавлять мембрану дополнительную емкость и влиять на свойства пиков клеток-мишеней. Экспрессия ArcLight в культивируемых нейронах не влияла на временной ход и амплитуду потенциалов действия [5], а фотообесцвечивание и фототоксичность не были обнаружены в измерениях in vivo . Влияние емкостной нагрузки, связанной с VSFP2.3 (зонд на основе FRET) и VSFP3.1 (одиночный зонд FP), был оценен с помощью компьютерного моделирования [30].Использование чувствительной к напряжению области Ciona , где соотношение FP к S4 составляет 1: 1, по-видимому, приводит к снижению емкостной нагрузки по сравнению с использованием пробников напряжения на основе калиевого канала.
Недавние публикации включают новые подходы к разработке более совершенных датчиков напряжения флуоресцентных белков [2–4, 8–12]. Зонды Nabi2 имеют самый большой размер сигнала и самые быстрые оптические ответы в нейронах среди зондов на основе FRET. Пока не ясно, какой из этих типов зондов будет наиболее полезным для in vivo измерений активности мозга млекопитающих или какой подход приведет к наиболее быстрым дальнейшим улучшениям.Учитывая яркость, фотостабильность, чувствительность к pH, а также фармакологические и фотодинамические эффекты [20], зонды Nabi2 могут оказаться полезными для визуализации мембранного потенциала нейронов.
Мы исследовали взаимосвязь расположения FP и размера сигнала и динамики типа «бабочка» датчиков напряжения на основе FRET. Мы сообщаем о пробах Nabi2 с быстрой кинетикой сигнала и достаточно большими оптическими ответами, чтобы различать индивидуальные потенциалы действия в культуре нейронов. Информация о взаимосвязи расположения FP и функции пробника может предоставить стратегическое руководство для проектирования будущих датчиков напряжения.
Дополнительная информация
S1 Рис. Сравнение донорной и акцепторной кинетики зондов Nabi1 и Nabi2.
Постоянные времени кинетики активации сигнала ( A, B ) и распада ( C, D ), процент быстрого компонента активации сигнала ( E, F ) и распада ( G, H ) акцептора и Сравниваются донорные сигналы для зондов Nabi1 ( A, C, E, G ) и Nabi2 ( B, D, F, H ). Процент быстрого компонента акцепторного сигнала Nabi1.242 немного меньше, чем у донора во время активации сигнала (p = 0,01 по t-критерию). В остальном ни один из зондов Nabi1 и Nabi2 не показал заметной разницы в кинетике сигнала донора и акцептора.
https://doi.org/10.1371/journal.pone.0141585.s001
(TIF)
S2 Рис. Влияние ROI на размер сигнала.
Сигналы от края ячеек были на ~ 10% больше, чем в среднем по всем пикселям. А . Слева: изображение ячейки HEK293, полученное камерой NeuroCCD-SMQ 80×80 пикселей, используемой для быстрого получения изображений.В центре: изображение ячейки, наложенное на пиксели (зеленые), используемые для измерения сигнала края. Справа: изображение ячейки, наложенное на пиксели (красный цвет), используемое для измерения среднего значения всех пикселей, получающих свет от ячейки. В . Донорские кривые, показывающие среднее значение краевых (зеленых) и всех (красных) пикселей из ячейки HEK293, выражающей Nabi2.242. Следы от единственного испытания; из тех же данных, что и на фиг. 5В. Данные подвергались фильтрации нижних частот с двумя проходами биномиального фильтра 1-2-1.
https://doi.org/10.1371/journal.pone.0141585.s002
(TIF)
S3 Рис. Оценка соответствия временнóй зависимости сигналов флуоресценции.
Типичные оптические следы Nabi2.213, Nabi2.242 и Nabi2.244, отвечающих на деполяризацию 100 мВ, были подогнаны с помощью двойной или одинарной экспоненциальной функции для определения постоянных времени для активации сигнала (включен) или затухания сигнала (выключен). Остатки для оценки качества соответствия показаны для каждой точки данных в зависимости от времени.
https://doi.org/10.1371/journal.pone.0141585.s003
(TIF)
Благодарности
Мы благодарны доктору Чжоу Хану за помощь в конфокальной микроскопии и Бок Еум Кангу за предоставленную иллюстрацию чувствительного к напряжению домена Ciona , который мы модифицировали для Наби на рис. 1.
Вклад авторов
Задумал и спроектировал эксперименты: US TH LBC BJB. Проведены эксперименты: US MS HHP LJ. Проанализированы данные: US LBC.Написал статью: US LBC.
Список литературы
- 1. Loew LM, Cohen LB, Salzberg BM, Obaid AL, Bezanilla F. Зонды смещения заряда мембранного потенциала. Характеристика красителей аминостирилпиридиния на гигантском аксоне кальмара. Биофизический журнал. 1985. 47 (1): 71–7. pmid: 3978192; PubMed Central PMCID: PMC1435075.
- 2. Kralj JM, Douglass AD, Hochbaum DR, Maclaurin D, Cohen AE. Оптическая регистрация потенциалов действия в нейронах млекопитающих с использованием микробного родопсина.Природные методы. 2012; 9 (1): 90–5. pmid: 22120467; PubMed Central PMCID: PMC3248630.
- 3. Kralj JM, Hochbaum DR, Douglass AD, Cohen AE. Электрический пик в Escherichia coli, исследованный флуоресцентным белком, показывающим напряжение. Наука. 2011. 333 (6040): 345–8. pmid: 21764748.
- 4. Hochbaum DR, Zhao Y, Farhi SL, Klapoetke N, Werley CA, Kapoor V, et al. Полностью оптическая электрофизиология нейронов млекопитающих с использованием инженерных микробных родопсинов. Природные методы.2014. 11 (8): 825–33. pmid: 24952910; PubMed Central PMCID: PMC4117813.
- 5. Джин Л., Хан З., Платиса Дж., Вултортон-младший, Коэн Л.Б., Пиерибоне В.А. Потенциалы одиночного действия и подпороговые электрические события, отображаемые в нейронах с помощью флуоресцентного белкового датчика напряжения. Нейрон. 2012. 75 (5): 779–85. pmid: 22958819; PubMed Central PMCID: PMC3439164.
- 6. Storace DA, Braubach OR, Jin L, Cohen LB, Sung U. Мониторинг активности мозга с помощью датчиков напряжения белка и кальция.Научные отчеты. 2015; 5: 10212. pmid: 25970202
- 7. Димитров Д., Хе Й, Муто Х, Бейкер Б. Дж., Коэн Л., Акеманн В. и др. Разработка и описание усовершенствованного датчика напряжения флуоресцентного белка. PLoS One. 2007; 2 (5): e440. pmid: 17487283; PubMed Central PMCID: PMC1857823.
- 8. Tsutsui H, Jinno Y, Tomita A, Niino Y, Yamada Y, Mikoshiba K и др. Улучшенное обнаружение электрической активности с помощью датчика напряжения на основе чувствительной к напряжению фосфатазы.J Physiol. 2013; 591 (Pt 18): 4427–37. pmid: 23836686; PubMed Central PMCID: PMC3784191.
- 9. Piao HH, Rajakumar D, Kang BE, Kim EH, Baker BJ. Комбинаторный мутагенез домена, чувствительного к напряжению, обеспечивает оптическое разрешение потенциалов действия, запускаемых с частотой 60 Гц, с помощью генетически закодированного флуоресцентного датчика мембранного потенциала. Журнал неврологии: официальный журнал Общества нейробиологии. 2015; 35 (1): 372–85. pmid: 25568129.
- 10. Сен-Пьер Ф., Маршалл Д.Д., Ян Й., Гонг И., Шнитцер М.Дж., Лин М.З.Высокоточная оптическая регистрация электрической активности нейронов с помощью сверхбыстрого флуоресцентного датчика напряжения. Nat Neurosci. 2014. 17 (6): 884–9. pmid: 24755780.
- 11. Zou P, Zhao Y, Douglass AD, Hochbaum DR, Brinks D, Werley CA, et al. Яркие и быстрые разноцветные репортеры напряжения через электрохромный FRET. Nat Commun. 2014; 5: 4625. pmid: 25118186; PubMed Central PMCID: PMC4134104.
- 12. Гонг Й., Вагнер М.Дж., Чжун Ли Дж., Шнитцер М.Дж. Визуализация нервных импульсов в ткани мозга с использованием датчиков напряжения белка FRET-опсина.Nat Commun. 2014; 5: 3674. pmid: 24755708.
- 13. Akemann W, Mutoh H, Perron A, Park YK, Iwamoto Y, Knopfel T. Визуализация динамики нейронной цепи с помощью чувствительного к напряжению флуоресцентного белка. J Neurophysiol. 2012. 108 (8): 2323–37. pmid: 22815406.
- 14. Akemann W, Mutoh H, Perron A, Rossier J, Knopfel T. Визуализация электрических сигналов мозга с помощью генетически нацеленных чувствительных к напряжению флуоресцентных белков. Природные методы. 2010. 7 (8): 643–9. pmid: 20622860.
- 15.Villalba-Galea CA, Sandtner W, Starace DM, Bezanilla F. Датчики напряжения на основе S4 имеют три основных исполнения. Proc Natl Acad Sci U S. A. 2008; 105 (46): 17600–7. pmid: 18818307; PubMed Central PMCID: PMC2584729.
- 16. Villalba-Galea CA, Frezza L, Sandtner W., Bezanilla F. Чувствительные заряды чувствительной к напряжению фосфатазы Ciona Кишечник. J Gen Physiol. 2013. 142 (5): 543–55. pmid: 24127524; PubMed Central PMCID: PMC3813379.
- 17. Ли К., Вандерлинг С., Падуч М., Медовой Д., Сингхарой А., МакГриви Р. и др.Структурный механизм зависящего от напряжения стробирования в изолированной области измерения напряжения. Nat Struct Mol Biol. 2014; 21 (3): 244–52. pmid: 24487958; PubMed Central PMCID: PMC4116111.
- 18. Цуцуи Х., Карасава С., Окамура Ю., Мияваки А. Улучшение измерений мембранного напряжения с помощью FRET с новыми флуоресцентными белками. Природные методы. 2008. 5 (8): 683–5. pmid: 18622396.
- 19. Tsutsui H, Jinno Y, Tomita A, Okamura Y. Оптически обнаруженные структурные изменения в N-концевой области домена датчика напряжения.Биофизический журнал. 2013; 105 (1): 108–15. pmid: 23823229; PubMed Central PMCID: PMC3699739.
- 20. Лам AJ, St-Pierre F, Gong Y, Marshall JD, Cranfill PJ, Baird MA и др. Улучшение динамического диапазона FRET с помощью ярко-зеленых и красных флуоресцентных белков. Природные методы. 2012. 9 (10): 1005–12. pmid: 22961245; PubMed Central PMCID: PMC3461113.
- 21. Перрон А., Муто Х., Акеманн В., Гаутам С. Г., Димитров Д., Ивамото Ю. и др. Чувствительные к напряжению флуоресцентные белки второго и третьего поколения для мониторинга мембранного потенциала.Front Mol Neurosci. 2009; 2: 5. pmid: 19623246; PubMed Central PMCID: PMC2706653.
- 22. Попович М.А., Фуст А.Дж., Маккормик Д.А., Зечевич Д. Пространственно-временные характеристики инициации потенциала действия в пирамидных нейронах слоя 5: исследование с визуализацией напряжения. J Physiol. 2011; 589 (Pt 17): 4167–87. pmid: 21669974; PubMed Central PMCID: PMC3180577.
- 23. Нехер Э. Поправка на потенциалы жидкого перехода в экспериментах с патч-зажимом. Методы Энзимол. 1992; 207: 123–31.pmid: 1528115.
- 24. Ян Ф, Мосс Л.Г., Филлипс Г.Н. мл. Молекулярная структура зеленого флуоресцентного белка. Nat Biotechnol. 1996. 14 (10): 1246–51. pmid: 9631087.
- 25. Винкенборг Д.Л., Эверс Т.Х., Реулен С.В., Мейер Э.В., Мерккс М. Повышенная чувствительность датчиков протеазы на основе FRET путем изменения интерфейса димеризации GFP. Chembiochem. 2007. 8 (10): 1119–21. pmid: 17525917.
- 26. Котера И., Ивасаки Т., Имамура Х., Ноджи Х., Нагаи Т. Обратимая димеризация флуоресцентных белков Aequorea victoria увеличивает динамический диапазон индикаторов на основе FRET.ACS Chem Biol. 2010. 5 (2): 215–22. pmid: 20047338.
- 27. Дженсен К.К., Мартини Л., Шварц Т.В. Усиленная передача энергии резонанса флуоресценции между спектральными вариантами зеленого флуоресцентного белка посредством инженерии цинкового участка. Биохимия. 2001. 40 (4): 938–45. pmid: 11170415.
- 28. Юнг А, Гарсия Дж., Ким Е, Юн Би, Бейкер Би Джей. Длина линкера и состав сайта слияния улучшают оптический сигнал генетически закодированных флуоресцентных датчиков напряжения. Нейрофотоника.2015; 2 (2): в печати.
- 29. Цао Дж., Платиса Дж., Пиерибоне В.А., Раккулья Д., Кунст М., Нитабах М.Н. Генетически направленная оптическая электрофизиология в интактных нервных цепях. Клетка. 2013. 154 (4): 904–13. pmid: 23932121; PubMed Central PMCID: PMC3874294.
- 30. Akemann W, Lundby A, Mutoh H, Knopfel T. Влияние чувствительных к напряжению флуоресцентных белков на возбудимость нейронов. Биофизический журнал. 2009. 96 (10): 3959–76. pmid: 19450468; PubMed Central PMCID: PMC2712148.
Динамическая структурная биология на основе FRET: проблемы, перспективы и призыв к практикам открытой науки
Понимание того, как биомолекулы соединяют структурную динамику с функцией, лежит в основе нескольких дисциплин и остается выдающейся целью биологии. Связывание конформационных состояний и их переходов с биохимической функцией требует способности точно определять структуру и динамику биологической системы, которая часто изменяется при связывании лиганда или находится под влиянием химических и физических свойств окружающей среды.Наиболее хорошо зарекомендовавшие себя инструменты структурной биологии предоставили с высоким разрешением «снимки» состояний в кристаллизованной или замороженной форме (например, рентгеновская кристаллография и криоэлектронная микроскопия одиночных частиц, криоЭМ) или усредненные по ансамблю все конформации (например, ядерный магнитный резонанс, ЯМР; малоугловое рассеяние рентгеновских лучей, SAXS; малоугловое рассеяние нейтронов, SANS; двойной электронно-электронный резонанс, DEER; сшивающая масс-спектрометрия, XL-MS; ансамбль-FRET). В последние годы дальнейшие разработки позволили этим традиционным структурным инструментам обнаруживать конформационную динамику и промежуточные продукты реакции.Например, методы ЯМР (Anthis and Clore, 2015; Clore and Iwahara, 2009; Palmer, 2004; Ravera et al., 2014; Sekhar and Kay, 2019) и методы электронного парамагнитного резонанса (Jeschke, 2018; Jeschke, 2012; Krstić). et al., 2011) были продвинуты для изучения конформационной динамики и захвата временных промежуточных соединений. Кристаллографические исследования с временным разрешением использовались для определения функционально значимых структурных смещений, связанных с биологической функцией (Kupitz et al., 2014; Moffat, 2001; Schlichting et al., 1990; Шлихтинг и Чу, 2000; Schotte et al., 2003). Достижения в микрожидкостных устройствах для смешивания и распыления позволили использовать криоЭМ с временным разрешением (Feng et al., 2017; Kaledhonkar et al., 2018) и масс-спектрометрию с поперечными связями (XL-MS или CL-MS) (Braitbard et al., 2019 ; Brodie et al., 2019; Chen et al., 2020; Iacobucci et al., 2019; Murakami et al., 2013; Славин, Калисман, 2018). Прогресс в вычислительных методах также предоставил новые инструменты для изучения биомолекулярной структуры и динамики. Каждое из этих достижений подчеркивает возросшее понимание того, что необходимо напрямую и непрерывно отслеживать динамические свойства отдельных биомолекул, чтобы понять их функции и регуляцию.
В этом контексте исследования FRET (называемые резонансным переносом энергии флуоресценции или резонансным переносом энергии Фёрстера [Braslavsky et al., 2008]) на ансамблевом и одномолекулярном уровнях стали важными инструментами для измерения структурной динамики в течение как минимум 12 порядков величины во времени и картирование конформационных и функциональных неоднородностей биомолекул в условиях окружающей среды. FRET изучает затухание флуоресценции на уровне ансамбля (Grinvald et al., 1972; Haas et al., 1975; Хаас и Стейнберг, 1984; Hochstrasser et al., 1992) (FRET с временным разрешением) позволили уже в начале 1970-х годов изучать структурные неоднородности во временных масштабах, превышающих время жизни флуоресценции (несколько нс). Этот подход используется до сих пор (Becker, 2019; Orevi et al., 2014; Peulen et al., 2017) и перенесен в исследования одиночных молекул. Возможность измерения FRET в отдельных молекулах (Deniz et al., 1999; Ha et al., 1996; Lerner et al., 2018a) сделала этот метод еще более привлекательным.Подход одномолекулярного FRET (smFRET) широко использовался для изучения конформационной динамики и биомолекулярных взаимодействий в стационарных условиях (Dupuis et al., 2014; Larsen et al., 2019; Lerner et al., 2018a; Lipman et al. ., 2003; Margittai et al., 2003; Mazal and Haran, 2019; Michalet et al., 2006; Orevi et al., 2014; Ray et al., 2019; Sasmal et al., 2016; Schuler et al., 2005; Schuler et al., 2002; Steiner et al., 2008; Zhuang et al., 2000). Примечательно, что во многих механистических исследованиях достаточно использовать FRET для различения различных конформаций и определения кинетических скоростей, так что абсолютные эффективности FRET и, следовательно, расстояния не нужно определять.Однако возможность точного измерения расстояний и кинетики с помощью smFRET привела к его появлению в качестве важного инструмента в эту новую эру « динамической структурной биологии » для картирования биомолекулярных неоднородностей и измерения структурной динамики в широком диапазоне временных масштабов (Lerner et al., 2018a; Mazal, Haran, 2019; Sanabria et al., 2020; Schuler, Hofmann, 2013; Weiss, 1999).
Одномолекулярный FRET (smFRET) имеет много преимуществ в качестве метода структурной биологии, в том числе:
чувствительность к макромолекулярным расстояниям (2.5–10 нм),
способность разрешать структурные и динамические неоднородности,
высококачественных измерений с низким потреблением образцов интересующих молекул (низкие концентрации и низкие объемы), поскольку образец анализируется по одной молекуле за раз,
определение структурных переходов в равновесии, следовательно, без необходимости синхронизации,
возможность обнаружения (очень) редких событий.В самом деле, в биологии наиболее интересными для изучения молекулы часто являются редкие, функционально активные молекулы среди моря неактивных молекул,
высокая чувствительность и специфичность для меченых молекул. Поскольку только меченая молекула вносит уникальный вклад в детектируемый сигнал, эти индикаторы также могут применяться в качестве FRET-репортеров в тесноте (Dupuis et al., 2014; Soranno et al., 2014; Zosel et al., 2020b) (отсюда smFRET может использоваться для проверки результатов, полученных изолированно, или обнаружения модуляции конформационных предпочтений и / или структурной динамики посредством так называемых пяти взаимодействий [Guin and Gruebele, 2019]), и
высокая специфичность для остатков / доменов за счет специфической маркировки.Биомолекулы могут быть специально помечены уникальной парой красителей, что позволяет проводить измерения smFRET для всех размеров молекул, включая большие сложные сборки (см. Рисунок 1 [Kilic et al., 2018]), активные биологические машины (например, рибосомы) ( Dunkle et al., 2011) и даже на целых нативных вирионах (Lu et al., 2019; Munro et al., 2014).
Рабочий процесс моделирования динамических структур по измерениям FRET.
( A ) Интеграционное моделирование требует структурной и динамической информации. Предварительная информация из традиционных подходов (рентген, ЯМР, криоЭМ) вместе с вычислительными инструментами определяет пространство возможных решений для структурного моделирования с помощью FRET. Комбинация структурной (расстояния между красителями) и динамической информации (кинетическая связь и обменные курсы) позволяет идентифицировать непротиворечивую модель. ( B ) Изучение структуры и динамики хроматиновых волокон.Комбинированное TIRF и конфокальное FRET исследование структуры и динамики хроматиновых волокон с использованием трех позиций маркировки FRET (DA1-3) для двух пар красителей с различными расстояниями Ферстера. Расстояния Фёрстера (определены в разделе Расстояния между красителями, уравнение 6). Предварительная структурная информация, полученная с помощью криоэлектронной микроскопии (вверху слева) (Song et al., 2014) и рентгеновской кристаллографии (вверху, справа PDB ID: 1ZBB Schalch et al., 2005), объединена со структурной и динамической информацией. полученные в результате экспериментов FRET на иммобилизованных молекулах, измеренных с помощью микроскопии полного внутреннего отражения (TIRF), и на свободно диффундирующих молекулах с помощью конфокальной микроскопии (Kilic et al., 2018). На основе объединенной информации получена согласованная модель конформаций хроматиновых волокон со смещенными регистрами, которые связаны медленными (> 100 мс) и быстрыми процессами декомпакции (150 мкс), которые протекают не напрямую, а скорее через открытое волокно. конформация. Рисунок 1B был воспроизведен с рисунков 1, 3 и 6 в Kilic et al., 2018, Nature Communications с разрешения, опубликованном под Международной общественной лицензией Creative Commons Attribution 4.0 (CC BY 4.0; https: // creativecommons.org / licenses / by / 4.0 /).
© 2018, Kilic et al. Панель B была воспроизведена с рисунков 1, 3 и 6 в Kilic et al., 2018 с разрешения, опубликованного в соответствии с Международной общественной лицензией Creative Commons Attribution 4.0.
Несколько методов были использованы для определения структурных ансамблей, таких как ЯМР, одночастичная криоЭМ или XL-MS, а недавно также smFRET в интегративном / гибридном (I / H) подходе с компьютерным моделированием для преодоления разреженности экспериментальных данных. относительно атомистического описания (Берман и др., 2019; де Соуза и Пикотти, 2020; Димура и др., 2020; Gauto et al., 2019; Кукос и Бонвин, 2020; На и Пэк, 2020; Тан и Гонг, 2020; Webb et al., 2018). Структурные модели I / H, полученные из экспериментов smFRET с использованием расстояний между красителями в качестве ограничений, были описаны для гибких свернутых белков (Brunger et al., 2011; Hellenkamp et al., 2017; Margittai et al., 2003; McCann et al., 2012). ), конформационные ансамбли неупорядоченных / неструктурированных и развернутых белков (Borgia et al., 2018; Holmstrom et al., 2018; Schuler et al., 2020), нуклеиновые кислоты и комплексы белок-нуклеиновая кислота (Craggs et al., 2019; Craggs, Kapanidis, 2012; Kalinin et al., 2012; Lerner et al., 2018b; Muschielok et al., 2008). ; Возняк и др., 2008).
Еще одним уникальным аспектом исследований smFRET является то, что структурная, кинетическая и спектроскопическая информация о больших и сложных системах может быть записана одновременно в одном измерении. Это облегчает объединение динамической и структурной информации в интегративный подход к (рис. 1A) (Hellenkamp et al., 2017; Килич и др., 2018; Ли и др., 2020b; Санабрия и др., 2020; Вассерман и др., 2016; Янез Ороско и др., 2018):
.определяют количество возможных структур, согласующихся с данными,
потенциально снижает неоднозначность между различными структурными моделями, совместимыми с экспериментальными данными, а
раскрывают структурно разрешенные динамические пути обмена.
В качестве примера на рисунке 1B показан результат мультимодального исследования smFRET конформационного ландшафта 12-мерного массива хроматина (~ 2.5 MDa) (Kilic et al., 2018) с динамикой, происходящей во временных масштабах от наносекунд до часов. SmFRET эксперименты могут обнаруживать гибкие конформации хроматина (рис. 1B, средняя панель), показывая их динамическую структурную неоднородность (рис. 1B, нижняя панель), в отличие от хорошо упорядоченных статических структур хроматиновых волокон (рис. 1B, верхняя панель). Эти гибкие, частично открытые и открытые конформации, которые довольно многочисленны в растворе (популяция> 70%; рис. 1B, нижняя панель), не были разрешены ранее, хотя они необходимы для правильной организации и функции генов.Они представляют собой центральный узел взаимопревращений для отдельных регистров стэка хроматина и их трудно обнаружить с помощью других структурных методов. Такой подход к визуализации биомолекул в действии в условиях окружающей среды подчеркивает важность их динамической природы, разрешая переходы между различными конформационными состояниями, что во многих случаях способствует их функции (Aviram et al., 2018; Henzler-Wildman et al., 2007; Iljina et al., 2020; Lerner et al., 2018b; Sanabria et al., 2020; Tassis et al., 2020).
ИзмеренияSmFRET обычно выполняются с использованием двух подходов: с использованием иммобилизованных на поверхности молекул с использованием флуоресцентной микроскопии полного внутреннего отражения (TIRFM) и обнаружения на основе камеры или со свободно диффундирующими молекулами в растворе с использованием конфокальной микроскопии и точечных детекторов. Экспериментальные системы доступны в продаже, но, как правило, их изготавливают самостоятельно. Образцы подготавливаются, а данные собираются с использованием протоколов для конкретных лабораторий, где данные хранятся в различных форматах файлов и анализируются с использованием набора все более мощного программного обеспечения.Для полевых исследований в целом и для структурных исследований в частности важно продемонстрировать, что smFRET как метод воспроизводим и надежен независимо от того, где и как измеряется образец. С этой целью под руководством Торстена Хугеля двадцать лабораторий объединились для измерения smFRET на нескольких конструкциях дцДНК (Hellenkamp et al., 2018a). Изучая шесть различных образцов с разными красителями и различными расстояниями между красителями, средняя эффективность FRET, полученная участвующими лабораториями, показала удивительно высокую степень согласия (ΔE между 0.02 и 0,05 в зависимости от деталей образца). Количественная оценка и воспроизводимость измерений smFRET на основе интенсивности и обсуждение анализа данных стали важной вехой. Эти стандарты дцДНК FRET теперь доступны для ежедневной калибровки и особенно полезны для новых групп, присоединяющихся к сообществу.
Вдохновленный идеями, полученными в ходе вышеупомянутой попытки FRET (Hellenkamp et al., 2018a), были начаты новые многолабораторные слепые исследования.Следующее сравнительное исследование FRET, проведенное Thorben Cordes, исследует надежность и надежность экспериментов smFRET на белках, претерпевающих индуцированные лигандом конформационные изменения (Gebhardt et al., В стадии подготовки). В этом исследовании используются два различных модельных белка для оценки воспроизводимости и точности smFRET на основе белков для измерения расстояния между красителями. Белковые системы ставят новые задачи, включая статистическую маркировку красителей, специфические для сайта свойства красителей, стабильность белков, транспортировку, хранение и конформационную динамику.Следовательно, в исследовании также оценивается способность smFRET обнаруживать и количественно оценивать динамику в различных временных масштабах от микросекунд до секунд. Еще одна задача FRET, инициированная Соней Шмид, — это программа kinSoftChallenge (http://www.kinsoftchallenge.com, Götz et al., В стадии подготовки), которая оценивает существующие инструменты для извлечения кинетической информации из временных траекторий одиночных молекул. Эта задача направлена на: (1) продемонстрировать способность кинетического анализа на основе smFRET точно выводить динамическую информацию и (2) предоставить сообществу средства оценки различных доступных программных инструментов.
Одним из важных результатов различных исследований FRET в нескольких лабораториях было то, что, хотя согласие было хорошим, его можно было улучшить еще больше. В частности, анализ данных и, в частности, исправления могут повлиять на определенную эффективность FRET и результирующие расстояния. Следовательно, открытое обсуждение того, какие подходы работают наиболее надежно, при каких условиях необходимо. Доступ к первичным данным и возможность их обработки с помощью различных подходов к анализу были и останутся наиболее прозрачным способом продвижения вперед в этой области.В настоящее время это сложно, учитывая множество вариантов используемых методов, их документации, форматов файлов и экспериментальных процедур, применяемых в разных лабораториях, для установления оптимальных условий, рабочего процесса и передовых практик даже для существующих, хорошо протестированных методов, поскольку сравнение этих методов затруднительно. требует много времени, а необходимая информация во многих случаях недоступна. С расширением открытых научных практик и представлением опубликованных данных в репозитории необходим консенсус относительно того, какие данные и метаданные следует хранить и в каких возможных форматах, чтобы их могло легко использовать сообщество.
В связи с этими соображениями и многочисленными возможностями для роста сообщества smFRET, несколько лабораторий, обладающих опытом в FRET, без претензии на исчерпывающий или исключительный характер, собрались, чтобы поддержать эти усилия и предложить шаги по организации сообщества вокруг последовательной и открытой науки. практики. Это действие переводится в общие методологические рекомендации или предложения, которые мы представляем после типичного рабочего процесса эксперимента smFRET, включая подготовку и определение характеристик образцов, описание установки, сбор и сохранение данных, а также анализ данных.Эти рекомендации о том, как «практиковать» smFRET, являются , а не попыткой упорядочить сообщество, а скорее первоначальным предложением, которое направлено на поощрение открытого диалога о существующих практиках в нашей области и приводит к более высокой воспроизводимости результатов экспериментов smFRET. Затем мы обсуждаем практику открытой науки, а также первые шаги, которые были предприняты для формирования международного сообщества FRET. В заключение мы выделим несколько областей, в которых smFRET окажет большое влияние в различных областях науки в ближайшем будущем.
Covid-19: малые предприятия сталкиваются с неясными перспективами, поскольку помощь закончилась
На этой неделе был отмечен первый полный месяц карантина для многих малых предприятий в США, без шансов на то, что жизнь в ближайшее время вернется к нормальной жизни.
Федеральный пакет помощи в размере 349 миллиардов долларов для малых компаний закончился менее чем за две недели, в результате чего многие владельцы семейных и семейных магазинов отключились после нескольких дней, отчаянно пытаясь найти спасательный круг для своего бизнеса и сотрудников. Среди тех, кому удалось получить ссуду, обеспеченную государством, некоторые говорят, что они беспокоятся о неопределенном будущем после двух месяцев помощи, предоставляемой программой.
Из-за того, что в Вашингтоне застопорились усилия по увеличению финансирования, реальность на местах часто мрачна, особенно для очень малых предприятий с несколькими сотрудниками. Согласно недавнему опросу, опубликованному в статье Национального бюро экономических исследований, средняя компания с ежемесячными расходами в размере 10 000 долларов США имеет достаточно наличных средств только на две недели.
Миллионы владельцев бизнеса по всей стране пытаются выжить. Их голоса редко слышны.Некоторые думают о закрытии своего бизнеса, другие ожидают, что в конечном итоге снова откроются. Вот некоторые из них, размышляющие о прошедшем месяце и смотрящие на свое будущее:
Заказ термометров
В 9.25 утра 3 апреля Бобби Лэнс получил электронное письмо из своего банка, в котором ему предлагалось подготовиться к правительственной программе кредитования малого бизнеса, которая должна была быть запущена в онлайн-режиме через пять минут. Затем он провел следующие 60 минут за своим компьютером, яростно щелкая мышью, чтобы отправить заявку.«Это было тревожное время», — сказал он о первых днях апреля, добавив, что иногда выпивал два бокала вина, чтобы успокоить нервы.
Те дни сейчас кажутся почти далеким воспоминанием. Лэнс, владеющий кафе Sweet Dreams Ice Cream Café и двумя другими предприятиями по производству продуктов питания в непосредственной близости от Disney World в Орландо, штат Флорида, с тех пор подал заявку на другой государственный заем, освоил все, от патогенов до тестирования на вирусы, и поделился своими знаниями с другие владельцы бизнеса.А теперь он сосредоточился на бизнесе в пост-карантинном мире.
Пока Лэнс ждет, получит ли он федеральное финансирование, 66-летний парень готовится к открытию. По его словам, он заказал маски и пластиковые маски для лица для своих пяти сотрудников, термометры для проверки их температуры и изучил для них курсы санитарии «больничного качества». Лэнс также получил предложения от санитарных компаний о проведении более регулярной глубокой уборки своего кафе-мороженого в стиле 1950-х годов, и он начал проектировать перегородки из оргстекла для сидений, стоящих спиной к спине.
«Сначала ты оцепенел, но потом нужно продолжать и сохранять позитивный настрой», — сказал он. «Я занимаюсь бизнесом 42 года и не смогу жить с собой, если заставлю кого-то заболеть».
Болезненные увольнения
Джастин Каталана, основатель пивоваренной компании Fort Point Beer Company из Сан-Франциско, предпринял болезненные и своевременные действия перед лицом Covid-19.
В выходные 13 марта, перед тем как города Bay Area объявили о размещении на месте заказов, пивоварня уволила 70 из 200 сотрудников и закрыла три бара и ресторана, которыми она владеет.Увольнения продолжались до марта и были сделаны, чтобы сотрудники могли оформить страховку по безработице. По состоянию на пятницу в компании работало 65 человек.
Продажи в бары и рестораны города полностью прекратились. Но есть одно яркое пятно: бизнес с продуктовыми сетями и магазинами на углу значительно вырос.
«Мы будем строить бизнес вокруг того, что приносит наибольший доход», — сказал Каталана. «Мы надеемся, что в следующие пару месяцев мы будем работать на уровне примерно 40% от нашей выручки.”
План Catalana основан на заказе жилья на месте на срок не менее 12 недель до конца мая.
Компания подала заявку на участие в федеральном фонде спасения Программы защиты заработной платы и получила подтверждение того, что ссуда была одобрена. Однако до сих пор не поступило никаких средств. Он также подал заявку на участие в другой федеральной программе под названием «Ссуда на случай катастрофического ущерба» и все еще ожидает получения этих средств.
Catalana также продолжила вносить арендную плату в трех своих торговых точках, в том числе за выгодное место на фасаде здания Ferry Building в Сан-Франциско.Его надежда: в конечном итоге он сможет снова открыть все три бара и ресторана и снова нанять персонал. Он ведет переговоры с домовладельцами о помощи.
«Не спать по ночам»
Джон Данцлер работал над бизнес-планом для своего ресторана и пивоварни с 2008 года. Он был в нескольких днях от открытия в районе Сохо на Манхэттене, когда поразил коронавирус.
«Во многих отношениях это было довольно приблизительное время для нас», — сказал он. «Мы практически мгновенно изменили нашу бизнес-модель.”
Сейчас генеральный директор и соучредитель Torch & Crown Brewing Co. превратил свой ресторан в центр сбыта и до сих пор держит своих 20 сотрудников занятыми доставкой пива в Нью-Йорк. Сам Данцлер также разносит пиво людям, застрявшим дома на своем внедорожнике Lexus 2003 года — старом автомобиле, который «ревет» и уже проехал 215 000 миль.
«В это можно уместить много пива, мы узнали», — сказал он. «Это определенно не то, как мы составляли это в бизнес-плане несколько лет назад.Но он выполняет свою работу ».
Доставка 4 упаковок пива пока помогает, но выручка составляет всего 40% от того, что было бы. Данцлер получил от 150 000 до 200 000 долларов в рамках программы защиты заработной платы, но говорит, что не уверен, получится ли это, потому что он продолжает читать о том, как все финансирование было израсходовано. И даже если он получит чек, его хватит примерно на месяц зарплаты персонала.
«Это не дает мне спать по ночам», — сказал он.«Что произойдет, когда закончатся деньги — а мы все еще не знаем, откроемся ли мы или нет».
«Really Frpting»
Джон Некел совместно с двумя другими партнерами владеет четырьмя барами в Портленде, штат Орегон. Все бары закрыты, весь персонал уволен с почасовой оплаты с 16 марта. Первоначально он держал наемных менеджеров в течение двух недель в надежде, что это будет кратко, но их тоже пришлось уволить.
Процесс подачи заявки на получение федеральной ссуды на спасение был запутанным и разочаровывающим.Ссуды в программе защиты заработной платы, разработанные в качестве краткосрочной временной меры до восстановления экономики, конвертируются в гранты, если вырученные средства используются для покрытия заработной платы в течение примерно двух месяцев и других утвержденных расходов, таких как аренда. Это создало загадку для многих владельцев бизнеса, предприятия которых закрыты по государственному заказу: должны ли они повторно нанять своих работников?
«Мы не можем платить им за то, чтобы они ничего не делали, и мы не знаем, когда мы снова откроемся», — заявил Накель ранее в апреле. «Что, если мы вернемся и новое правило для баров и ресторанов гласит, что они должны работать на половину мощности и оставаться на расстоянии шести футов друг от друга — наша бизнес-модель такова, что мы не можем работать на половину мощности.Если это то, куда мы направляемся, то, возможно, нет смысла когда-либо открываться заново. Меня не волнует, на какую сумму, если мы не сможем открыть снова. Эта часть действительно пугает ».
«Волшебник страны Оз»
Эрик Бруун владеет SoCo Creamery, магазином мороженого и оптовым поставщиком в Грейт-Баррингтоне, штат Массачусетс. В понедельник, 13 апреля, ему сказали, что его заявка на ссуду в рамках программы защиты зарплаты была одобрена, но он еще не получил никаких средств.
«Я очень благодарен за это и понимаю, что для этого нужно время, но есть часы, которые тикают в моем бизнесе, и я должен предпринять различные шаги, чтобы задержать время до тех пор, пока ссуда не будет получена», — сказал он.«Кредитор, с которым я работаю, не может быть лучше, не может быть более отзывчивым, но она стоит перед системой, за которой вы не видите. Деньги поступают от Волшебника страны Оз ».
Он повторно нанял некоторых работников, занятых неполный рабочий день, на основе получения государственного финансирования. Он считает, что когда-нибудь получит финансирование, но в целом его одолевает чувство неуверенности.
«Когда и как мы вернемся к новому нормальному состоянию — это вопрос», — сказал он. «Как производитель мороженого, мы с нетерпением ждем лета, и всегда есть ощущение, что лето может никогда не наступить.»
« Nobody’s Lending »
Лиза Ледер — кастинг-директор и фотопродюсер, работавшая с компаниями любого размера — от малых предприятий до Estee Lauder Cos. И Levi Strauss & Co. Она владела и управляла LL Production и Кастинг в Нью-Йорке с 2005 года.
«У меня были деньги, и в марте у меня все было замечательно», — сказал Ледер. «Все было остановлено 12 марта, поэтому все деньги, на которые я рассчитывал платить людям, ушли. Я никогда раньше не был в такой ситуации.Я никогда в жизни не опаздывал с оплатой продавцу ».
Ледер — единственный сотрудник, которому сложно получить помощь. Она подала заявку на получение каждой ссуды, которую только могла: программа защиты зарплаты и еще одна федеральная программа под названием «Ссуда на случай причинения вреда здоровью», а также программы города Нью-Йорка. Она ничего не слышала.
Ее бизнес работает так, что она обычно получает бюджет от клиента и деньги заранее, а затем платит людям за выполнение работы. В это время в прошлом году она принесла брутто 70 000 долларов за март.В начале месяца она принесла 13 000 долларов и теперь застряла, пытаясь найти 50 000 долларов, которые, по ее оценкам, она должна.
Последний месяц был нервным и выводящим из себя. Когда полторы недели назад она позвонила в Управление малого бизнеса и спросила о статусе ее заявки, представитель ответил, что «понятия не имеет», как проверить статус, сказала она.
«Никто не дает взаймы», — сказала она. «Если вы действительно не богаты или действительно бедны, вы ничего не получите.”
— При содействии Лесли Паттона
Прежде чем оказаться здесь, он находится на терминале Bloomberg.
УЧИТЬ БОЛЬШЕУолл-стрит потерпела крах из-за ослабления надежд на торговую сделку, ухудшая перспективы
Нью-Йорк (AFP) — Затуманенные перспективы торговой сделки между США и Китаем и падение доходности казначейских облигаций США повлияли на Уолл-стрит в понедельник, в результате чего основные индексы упали более чем на один процент.
Торговый центр в Нью-Йорке сильно пострадал от падения бирж в Лондоне, Париже и Франкфурте, а рост кризиса в Гонконге стал еще одним негативным катализатором.
Аналитики считают, что недавняя эскалация между Вашингтоном и Пекином по вопросам торговли омрачила настроения, способствуя бегству от рискованных активов к традиционным безопасным убежищам, таким как золото.
Goldman Sachs заявил, что маневры на прошлой неделе показали, что борьба «по-видимому, переросла в полномасштабный конфликт», добавив в своем отчете, что они больше не ожидают торговой сделки между Пекином и Вашингтоном до президентских выборов 2020 года.
Goldman сказал, что сокращение капитальных расходов из-за торговой войны может нанести дополнительный урон экономическому росту США на 0.От 1 до 0,2 процента, оценка «общей неопределенности и сопротивления настроений», говорится в примечании.
Доходность 10-летних казначейских облигаций США, часто рассматриваемая как барометр ожиданий будущего экономического роста, резко упала.
Другие факторы, влияющие на акции, включали растущие беспорядки в Гонконге, из-за которых был закрыт аэропорт, неудачная победа на первичных выборах в Аргентине популистского левоцентристского кандидата Альберто Фернандеса, который резко ограничил курс песо, и нарастающий политический кризис в Италии, которого не ожидалось вотум доверия правительству.
«Китай по-прежнему находится в эпицентре беспорядков, поскольку сохраняющаяся торговая напряженность и растущие протесты в Гонконге оказывают давление на рисковые активы во всем мире», — сказал в комментарии стратег Gorilla Trades Кен Берман.
В Гонконге внезапная остановка работы произошла, когда китайское правительство выразило растущий гнев на протестующих, назвав некоторые жестокие демонстрации «терроризмом», а Вашингтон призвал «все стороны» воздерживаться от насилия.
Городские власти заявили, что намерены открыть аэропорт к 6:00 утра вторника (22:00 GMT понедельника), но сотни протестующих остались в зале прибытия до поздней ночи, без каких-либо признаков того, что они собираются уехать.
История продолжается
Индекс основных акций Гонконга закрылся снижением сразу после появления новостей о закрытии.
Гонконгская авиакомпания Cathay Pacific тем временем в понедельник предупредила сотрудников, что их могут уволить за поддержку «незаконных протестов», поскольку на компанию оказывается давление со стороны Пекина.
Акции перевозчика упали более чем на четыре процента после того, как Пекин ввел новые правила, запрещающие сотрудникам авиакомпаний, участвующим в протестах, совершать полеты на материк и над ним.
Тем временем в Аргентине курс песо и фондовая биржа Буэнос-Айреса резко упали после сокрушительного поражения президента Маурисио Макри на партийных праймериз в минувшие выходные.
— Ключевые показатели к 2050 году по Гринвичу —
Нью-Йорк — Dow: DOWN 1,5% при 25 896,44 (закрытие)
New York — S&P 500: DOWN 1,2% при 2 882,70 (закрытие)
New York — Nasdaq: DOWN 1,2% на уровне 7863,41 (закрытие)
Лондон — FTSE 100: снижение на 0,4 процента при 7 226,72 (закрытие)
Франкфурт — DAX 30: снижение на 0,1 процента при 11 679,68 (закрытие)
Париж — CAC 40: снижение на 0,3 процента при 5310,31 (закрытие)
EURO STOXX 50: СНИЖЕНИЕ на 0,2 процента до 3 326.55 (близко)
Гонконг — Hang Seng: СНИЖЕНИЕ на 0,4 процента до 25 824,72 (близко)
Шанхай — Composite: рост на 1,5 процента до 2 814,99 (близко)
Токио — Nikkei 225: закрыто в праздничный день
евро / доллар: рост на 1,1217 доллара с 1,1200 доллара в 21:00 по Гринвичу в пятницу
Фунт / доллар: рост на 1,2076 доллара с 1,2033 доллара
Евро / фунт: ВНИЗ на 92,84 пенсов с 93,08 пенсов
Доллар / иена: вниз на 105,28 иен с 105,62 иен
Нефть Brent North Sea: UP 0.1% по 58,57 долларов за баррель
West Texas Intermediate: рост на 0,8% по 54,93 доллара за баррель
burs-jmb / hs
Изучение государственного парка Maquoketa Caves и живописной дороги Grant Wood Scenic Byway
Прокатитесь по живописной дороге Грант-Вуд округа Джексон, чтобы пройти по жизненной дороге Айовы.
Из мартовского / апрельского выпуска журнала Iowa Outdoors за март / апрель 2016 г.
Над восточной Айовой полная луна.Холодные чистые ручьи блестят, словно серебряные нити, сквозь поля и поля. Лунные лучи ласкают южное притяжение реки Миссисипи. В этом крошечном райском уголке между Макокетой и Бельвью человек и природа нашли баланс, который искрится холодной весенней ночью.
Через этот оплот традиционного фермерского пейзажа вьется дорога. Живописная дорога Грант-Вуд ведет путешественников мимо местных известняковых построек, молочных ферм и холмистых холмов, о которых водители между штатами никогда не узнают.
Вода ставит это место на ступеньку выше остальных. Рыболовы ловят рыжую и радужную форель из зарыбленных ручьев, подпитываемых весной. Гребцы обнимают управляемую реку Макокета. Миссисипи примыкает к Белвью, редкому речному городу без железнодорожных путей, закрывающих вид. Вырезанный водой государственный парк Maquoketa Caves и панорамный вид на реку — лучшее вознаграждение для походов в государственный парк Bellevue.
В округе Джексон, вдоль живописной дороги Грант-Вуд, если вы приедете полюбоваться пейзажем, вы останетесь ради воды.
Маленькие чудеса
Буйные совы резвятся по зрелым соснам. Coyotes yap. Чтобы не забыть, что это Айова, к припеву присоединяется корова. Ночью в палатке в государственном парке Maquoketa Caves State Park — это слух.
Этот маленький парк на 323 акрах, в семи милях к северо-западу от Макокеты, является фаворитом штата. Все 13 пещер, образованных эрозией дождевой воды в известняке, подходят для исследования. Шесть протяженных миль троп проходят мимо известняковых образований, крутых обрывов и готовых для фотографий объектов, таких как мост из натурального камня в 50 футах над Раккун-Крик и 17-тонная «сбалансированная скала».”
Судя по наконечникам стрел и глиняной посуде, давно найденной в пещерах, это место было популярно на протяжении тысячелетий. Местный центр интерпретации дополняет исторические детали. Джилл и Кайл Голи из Пеллы пробираются через гигантскую пещеру Дэнсхолл с сыновьями Коннором, 3 года, и Томасом, 6 лет. Мальчики качаются по ледяным камням, фонарики мерцают в темной глубине.
«Я вижу летучих мышей!» Коннор беспокоит.
«Летучие мыши не причинят тебе вреда», — уверяет Джилл. «Кроме того, здесь нет летучих мышей.”
Мальчики проталкивают свои маленькие тела через грязно-коричневую трещину в стене.
«Вау!» звучит голос Томаса изнутри.
«Летучие мыши!» — отвечает Коннор.
Пещеры легко выдержат два дня увлеченных исследований. Так что хорошо, что на ферме Блафф-Лейк-Сэтфиш, в нескольких милях к западу, по выходным подают обеды «сколько угодно». Часовое ожидание возможно между баром, утками и гусями и прудом с сомами, где скрывается особый вечер пятницы.
Неуловимая рыба
Живописная дорога Грант-Вуд тянется на 60 миль между Анамосой и Бельвью.Крутые холмы, долины, глубокое дно ручьев, высокие церковные шпили и здания из известняка были источником вдохновения для художника из Айовы Гранта Вуда в 1930-х годах, который писал: «Истинное художественное выражение должно вырасти из самой почвы». Регионалист основал Колонию искусств в Каменном городе недалеко от Анамосы, чтобы отдать дань уважения искусству изысканным красотам Среднего Запада.
Этот район вдохновлен классическими картинами, такими как «Каменный город» и «Осенняя вспашка», но дорога находится далеко от изюминки округа. Выезжая из пещер Макокета, следуя по дороге в сторону Белвью, вы сможете увидеть зарыбленные ручьи с форелью, такие как ручьи Биг и Литл Милл и ручей Браш, чтобы увидеть одни из лучших пейзажей Айовы.
«Одна вещь о форели: она не живет в уродливых местах», — говорит Брайан Хейс, рыбный биолог ДНР, отслеживающий водотоки. «Это родниковая вода, прозрачная и холодная, с обнаженными камнями, красивыми деревьями и … красивой местностью».
Удивительно, но для ловли форели не нужно много оборудования. Рыбная ловля в фермерском стиле — это не фантастика (хотя, конечно, может быть). Ловля форели может быть такой же простой, как сплит-шот, Power Bait, резиновые сапоги и способность быть очень хитрым.
Биолог из рыболовства Скотт Гриттерс привязывает блесну к своей двухфунтовой световой леске на участке Литл-Милл-Крик. Он указывает на тихий бассейн сразу за бурлящей рекой.
«Я гарантирую, что там 200 или 300 форелей», — говорит он.
Идя по берегу, Гриттерс держится на расстоянии от воды, пока не будет готов ловить рыбу. Если форель увидит тебя, она не клюнет. Форель плывет против течения, и Гриттерс, по сути, крадется за своим уловом. Он бросает — энергичный, быстрый удар — и позволяет своей приманке течь обратно по течению к нему.Он бросает еще два раза, затем идет дальше. Он говорит, что если они не клюют, то не скоро передумают. Зерноуборщик идет вверх по течению, хотя некоторые рыболовы работают на одном участке весь день, немного ловят рыбу, дают воде отдохнуть на полчаса, а затем снова на рыбалке.
Районные фермеры обычно открыты для совместного использования доступа к потокам — просто спросите. На объектах с постоянным разрешением установлены знаки DNR и деревянные лестницы через заборы. Проконсультируйтесь с картой форели DNR, на которой указаны номера окружных площадок для точек общественного доступа.Как бы вы ни находили свою золотую середину, помните: это хорошая карма — оставлять сайты чище, чем вы их нашли, а ворота фермы закрыты за вами.
Очарование городка
Бельвю — это крошечный городок с очаровательным замком и плотиной, муниципальным парком на берегу Миссисипи и вкусным мороженым в Grandpa’s Parlour на Мейн-стрит.
Характер Белвью закреплен на идиллическом красном строении — старейшей мельнице штата Айова — на берегу Биг-Милл-Крик. Врач Маршаллтауна на пенсии Дэрил Эггерс спас Potter’s Mill, когда купил ее в ветхом состоянии в 1980 году.Фундамент и плотина толщиной 11 футов, которые приводили в действие мельницу, были построены из известняка с обрывов через ручей. Его обрамляли местные породы дерева (грецкий орех и дубовые балки ручной работы).
В 1985 году Эггерс и его жена Кэролайн открыли Potter’s Mill как ресторан. Сегодня новые владельцы владеют комнатами для завтраков наверху и рестораном, где подают барбекю и южную кухню с живым блюзом и джазом. Это идеальное место для круп, ребрышек, гамбо и других классических блюд.
«Горожане до сих пор благодарят нас за спасение этого места», — говорит он.«Я не сомневаюсь, что это здание не удалось бы спасти».
Чтобы оценить статус Бельвью как культового города Айовы, посмотрите на него с высоты птичьего полета в государственном парке Бельвью. Красота в 720 акров известна панорамными видами, крупнейшим садом бабочек в Айове (см. Врезку) и курганами кочевого леса.
Дубы и клены мерцают на ветру, как поясняет смотритель парка Рон Джонс, когда-то парк служил полем для гольфа. «Мы все еще находим здесь мячи для гольфа», — смеется он. Восемь миль тропы через ветер.
«Это, наверное, мой любимый парк», — говорит Джонс, глядя с Кафедры возле главного входа, где группы позируют для того, что, вероятно, окажется на семейной рождественской открытке.
 Либо автомобиль ставят перед ровной стеной, ка которую наносят разметку.
Либо автомобиль ставят перед ровной стеной, ка которую наносят разметку.




